IX. FENÓMENO DE ÓSMOSIS INVERSA
El lamento del antiguo marinero que gritaba "agua, agua por doquier, pero ninguna gota para beber", sigue siendo el grito de mucha gente de muchas islas y áreas costeras rodeadas por un océano, donde el agua potable para beber y cocinar es escasa. |
EL FENÓMENO de ósmosis normal o también llamada directa, expresada
en capítulos pasados, representa la respuesta de un sistema discontinuo cuando
dos recipientes con solución a diferentes concentraciones se ponen en contacto
por medio de una membrana semipermeable. El flujo osmótico se origina del recipiente
de solución diluida al recipiente de solución concentrada (diagrama a, figura
14). Es un proceso espontáneo para llevar el sistema a su estado de equilibrio.
Ello ocurre cuando el flujo osmótico eleva una columna de líquido sobre la solución
concentrada, cuyo peso produce la presión osmótica de equilibrio (diagrama b,
figura 14). La segunda ley de la termodinámica asegura que este proceso es irreversible,
en vista de que para reintegrar el sistema a su estado inicial tiene la necesidad
de realizar un trabajo mecánico neto. Esta labor mecánica se realiza en la solución
concentrada, de tal manera que el flujo del solvente ocurre en dirección opuesta
al flujo osmótico original. Para que tal cosa se realice, es obligatorio que
la presión aplicada tenga un valor mayor a la diferencia de las presiones osmóticas
entre los recipientes (véase el diagrama c, figura 14).
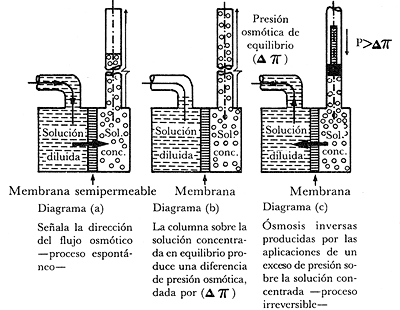
Figura 14
El proceso de ósmosis inversa fue propuesto por primera vez por Charles E. Reid en 1953 para obtener agua potable del agua de mar. La propuesta de Reid fue sometida a la consideración de la Oficina de Aguas Salinas de EUA y surgieron algunas objeciones, una de ellas consideraba a la ósmosis inversa como un proceso impráctico y que en caso de funcionar sería una curiosidad de laboratorio. La duda más seria a la propuesta de Reid fue cuando se hizo ver que el estado del arte carecía de una membrana adecuada para realizar eficientemente el proceso de ósmosis inversa. En efecto, al aprobarse el proyecto Reid se enfrascó en un problema mayúsculo para conseguir la membrana que tuviera la capacidad de realizar ese proceso. Las dificultades básicamente eran las siguientes:
a) Carencia de una membrana que resistiera químicamente las soluciones salinas.
b) Las membranas eran muy poco porosas para permitir el libre tránsito del solvente (agua pura) y demasiado abiertas para tener un adecuado coeficiente de reflexión de Staverman (bajo rechazo de sales).
La solución del problema de la separación de agua pura a partir de agua de mar o salobres fue resuelta por el descubrimiento de la membrana de acetato de celulosa por el mismo Reid y E. J. Breton en 1959.
A este descubrimiento siguió otro efectuado por S. Loeb y S. Sourirajan en los años de 1960 a 1962 al demostrarse que la membrana de Reid y Breton mejoraba considerablemente el flujo de solvente y rechazo de sales, si la membrana se hacía asimétrica en lugar de homogénea. Luego se supo, por observaciones al microscopio electrónico, que la asimetría en la membrana de Loeb y Surirajan se debía a la presencia de una delgada película de polímero en fase amorfa con secciones cristalinas sobre la superficie de la membrana. Esta película es la parte activa de la membrana y responsable de la exclusión de los solutos. El cuerpo restante de la membrana sirve de soporte y es una estructura polímera esponjada altamente porosa.
Con este tipo de membrana se realizó eficientemente el proceso de ósmosis inversa, acallando a los que pensaron que esa inversión nunca funcionaría. A pesar de este triunfo tecnológico, el precio que se paga es alto, por el costo elevado de energía que cobran las irreversibilidades. En un principio se creyó que el proceso de ósmosis inversa sería altamente eficiente, pues se pensó que bastaría con exceder la presión osmótica del sistema para lograr la inversión osmótica. Aquí no se tomaba muy en cuenta la segunda ley de la termodinámica debido a que se requiere un trabajo extra para su funcionamiento en contra de irreversibilidades y entre más lejos del equilibrio se opere, mayor será ese costo extraordinario de energía. En efecto, resultó que el funcionamiento de dicho efecto requiere de la aplicación de una presión mucho mayor (4 ó 5 veces mayor) al valor de la presión osmótica efectiva e invertir energías 10 veces más que la requerida, si el proceso fuera reversible, por ejemplo, la presión osmótica del agua de mar es de 24 atmósferas, mientras que los equipos que obtienen agua potable a partir de agua de mar operan con presiones de 100 atmósferas o mayores. Ello implica costos de equipo y mantenimiento elevados.
Uno de los logros de la década de los años sesenta fue hacer económica la aplicación de la ósmosis inversa en la obtención de agua potable a partir de aguas salobres y de mar, y entrar francamente en competencia con otros sistemas de separación de pequeña o gran escala. Esta posibilidad fue una consecuencia de la perfección de la membrana de acetato de celulosa y un entendimiento más claro de los procesos de interacción de una solución salina con dichas membranas. En esta década se consiguió comprender los efectos de compactación y de oclusión de las membranas bajo operación, así como percibir la necesidad de tratamientos bioquímicos del agua de alimentación, por la presencia de microorganismos que utilizan a la membrana como nutriente. En particular, el conocimiento de la capa de polarización como efecto adverso fue decisivo en los avances anteriores. Este efecto se ha señalado como el recíproco del osmótico, tal como se indicó en el capítulo V, y es causa de la formación de una capa de iones cuando durante el tránsito del flujo volumétrico se acumulan solutos que no pueden pasar y se concentran a la entrada de la membrana. Esta capa de iones salinos elevan la presión osmótica local de la solución frente a la membrana y por lo mismo aumenta la presión de operación para mantener un flujo del solvente. La eliminación de este efecto adverso fue determinante en el diseño de los módulos que sirven de apoyo a la membrana, en vista de que para eliminar esa capa de polarización se utiliza la agitación convectiva, provocando un flujo turbulento en la solución alimentadora. De esta manera, las celdas donde las membranas ejecutan la separación presentan diseños geométricos de manera que los flujos sean violentos (altos números de Reynolds).
Otro de los avances de la década de los sesenta fue la elaboración de modelos que interpretaban los procesos de transporte de una membrana. Entre otras, están las aportaciones de H. K. Londsdale, U. Merten y R. L. Riley en 1965. El año siguiente se conocen las contribuciones de Spiegler y Kedem, Gradzinski y Kedem, Mears y Merten. Estos modelos siguen los lineamientos teóricos dados por Kedem Katchalsky en 1958 y predicen relaciones entre distintas variables del sistema, como los flujos de soluto y solvente, porcentaje de rechazo, espesor y permeabilidad de la membrana. Esto permitió un manejo adecuado de los parámetros de diseño en la construcción y verificación de plantas de prueba o pilotos y luego su comercialización en plantas del orden industrial.
En la década de los años sesenta, el estudio y aplicación de la ósmosis inversa se relacionó con la desalación de aguas salinas y del tratamiento de aguas de reúso, como la purificación de agua de desechos industriales y de drenaje.
Por otra parte, en la década de los setenta se consiguió un conocimiento más detallado sobre el funcionamiento de la membrana; en particular se discutió el mecanismo por el que una membrana de acetato de celulosa permite el paso del solvente e impide el tránsito de los solutos. El fenómeno de la causa de la selectividad de una membrana fue discutido primeramente en los trabajos de Reid y Breton en 1959, constituyendo una constante preocupación en las explicaciones físicas de los modelos de la década anterior.
Algunos puntos se establecieron en la década de los sesenta y aparecen en nuestra época como un conocimiento fraccionado. Algunas teorías han formulado una explicación sobre la causa del fenómeno de la selectividad de una membrana, sin que existan correlaciones de observaciones experimentales donde se observe claramente la influencia de las propiedades de las estructuras poliméricas. Este problema al parecer no está resuelto y pone de relieve la necesidad de estudiar a nivel fundamental la interacción de una solución electrolítica con un material polimérico. La información básica que se obtiene del mecanismo de la selectividad en la década de los sesenta, es su relación con la presencia de grupos químicos o radicales en las cadenas poliméricas en el material de la membrana. Estos grupos químicos rechazan los iones por acciones electromagnéticas, a la vez que se permite el acceso de las moléculas de agua por propiedades hidrofílicas de la membrana; es decir, el agua es absorbida por el material polimérico y transmitido de un punto a otro por influencia de transiciones en los puentes de hidrógeno; esto ocurre cuando no hay espacios porosos para un flujo volumétrico. De manera que se confirma la importancia de aglutinar centros de rechazo en la superficie de una membrana hidrofílica.
El conocimiento de estos mecanismos de selectividad permitió predecir el comportamiento de las membranas en variadas aplicaciones. También aparecieron nuevas membranas utilizando otro tipo de polímeros que presentan más ventajas en comparación con las de acetato de celulosa. En esta década de los setenta, se logró dar una clasificación útil de las membranas en relación a procesos de separación y el mecanismo de acción a su vez relacionada con su estructura. Después de todo, la ósmosis inversa ha ganado gran popularidad, se recrearon métodos de operación con diversas membranas, y actualmente existe un sinnúmero de aplicaciones industriales. Esto lo comentaremos en el siguiente capítulo.