II. LA MATERIA
AL DESCUBRIRSE la radiactividad, los científicos empezaron a preguntarse
la razón por la que la muestra de radio que aislaron los esposos Curie se encontraba
a mayor temperatura que el recinto en que se trabajaba. En realidad no comprendían
el origen de las radiaciones emitidas por el uranio y los otros elementos radiactivos.
Se dieron cuenta de que la energía se originaba en el átomo y que éste no tenía
una estructura sencilla como se pensaba.
Fue Joseph John Thomson quien, en 1907, propuso un modelo del átomo, al que visualizó como una esfera con carga positiva, distribuida en el volumen del átomo de aproximadamente 0.000 000 01 cm de diámetro. Supuso que partículas con cargas negativas, electrones, estaban dispersos en alguna forma ordenada en esta esfera. Éste fue el primer modelo del átomo que trató de explicar su constitución. Pero este modelo no fue capaz de explicar los experimentos que realizaba Ernest Rutherford, científico neozelandés, quien utilizaba una fuente de polonio emisora de radiación alfa como herramienta para realizar sus estudios.
Aparece en nuestra historia este personaje, a quien se debe un gran número de descubrimientos que cambiaron el rumbo de la ciencia; se le mencionará en varias ocasiones en este libro, pues la humanidad está endeudada con él por su brillante imaginación y habilidad experimental demostradas en su interpretación de la radiactividad. Rutherford nació en 1871 en Nueva Zelanda. Estudió alli matemáticas y ciencia. Después ganó una beca para estudiar en Cambridge, Inglaterra. Tenía apenas 24 años cuando ya realizaba trabajo de postgrado en ondas electromagnéticas en el laboratorio Cavendish bajo la dirección del profesor Thomson, ya conocido en esta historia. Después de trabajar en universidades de varios países, finalmente regresó a Cavendish, Cambridge, donde tomó el lugar de su maestro Thomson como profesor de física.
LAS RADIACIONES EMITIDAS POR LOS ELEMENTOS RADIACTIVOS
Ernest Rutherford y su colaborador químico Frederick Soddy propusieron una teoría que describía el fenómeno de la radiactividad. A este proceso se le conoce ahora como decaimiento radiactivo. En 1902, explicaron la naturaleza de la radiactividad y encontraron que el átomo ya no podía considerarse como una partícula indivisible; estudiaron los productos del decaimiento de un material radiactivo separado químicamente del resto de los elementos de donde provenía, y descubrieron que los materiales radiactivos, al emitir radiación, se transforman en otros materiales, ya sea del mismo elemento o de otro.
La radiación emitida por el uranio y otros elementos radiactivos resultó ser bastante compleja; estaba constituida principalmente por tres componentes, a los cuales Rutherford les dio los nombres de alfa (a), beta (b) y gamma (g), respectivamente, tomados de las tres primeras letras del alfabeto griego.
Cuando se hacía pasar un haz de la radiación a través de un campo magnético, los científicos encontraron que una parte, los rayos alfa, se desviaba ligeramente en un sentido; otra parte, los rayos beta, se desviaba fuertemente en el sentido contrario, y, finalmente, una tercera parte, los rayos gamma, no se desviaba.
Rutherford fue el primero en detectar los rayos alfa, y descubrió que, en presencia de campos magnéticos, se desvían en forma opuesta a la de los electrones. De aquí se concluyó que los rayos alfa tenían que estar cargados positivamente. Como además resultaban desviados sólo muy ligeramente, calcularon que debían de tener una masa muy grande; en efecto, resultó que tenían cuatro veces la masa del hidrógeno. Rutherford los identificó más tarde como átomos de helio cargados positivamente.
Becquerel demostró que los rayos beta consisten en electrones cargados negativamente, ya que se desvían en el mismo sentido y en la misma proporción que éstos.
Finalmente, Rutherford y Audiade, otro colaborador suyo, descubrieron que los penetrantes rayos gamma son en realidad radiaciones electromagnéticas parecidas a los rayos X y a la luz visible, pero de diferente energía.
¿Cómo podría explicarse la existencia de los elementos radiactivos si continuamente
se están desintegrando? Era de esperarse que se hubieran acabado. Fueron Rutherford
y Soddy quienes contestaron esta pregunta: observaron que para cada material
radiactivo se podía asignar un tiempo en el que decaían la mitad de los átomos
de la actividad original; este tiempo recibió el nombre de vida media. Después
de haber transcurrido una vida media, sólo podían encontrar aproximadamente
la mitad de la actividad que tenían originalmente; después de dos vidas medias,
sólo la cuarta parte, y así sucesivamente, hasta que el material radiactivo
se perdía en su mayor parte (Fig. 2). Graficando la actividad de las radiaciones,
encontraron que disminuía en el curso del tiempo y tenía una forma que los matemáticos
llaman exponencial decreciente (Fig. 3).
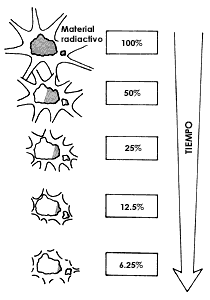
Figura 2. Después de una vida media sólo se tiene la mitad, el 50%, de
la actividad del material radiactivo. Después de dos vidas medias sólo se tiene
el 25%, y así sucesivamente, hasta que en la práctica no se puede medir la actividad
del material radiactivo.
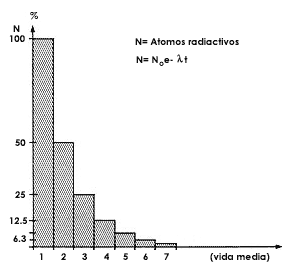
Figura 3. Actividad de un isótopo radiactivo en función del tiempo transcurrido.
Después de una vida media el isótopo radiactivo le queda sólo la mitad de su
radiactividad.
Esta curva y su relación matemática expresa la rapidez con la que se transforma el material radiactivo en otro material, el proceso se llama decaimiento o desintegración radiactiva.
Uno de los experimentos de más trascendencia de Rutherford y sus colegas, y
el que tal vez ayudó más a los científicos a comprender la estructura atómica,
consistió en utilizar partículas alfa emanadas de una fuente radiactiva para
bombardear una lámina delgada de material. Las partículas alfa incidían en una
placa fotográfica después de haber atravesado la placa de metal. Casi todas
ellas traspasaban la hoja de metal sin cambiar su dirección, y pocas partículas
rebotaban en diversas direcciones; esto último lo dedujo Rutherford por los
bordes de las manchas en la placa, que no se veían nítidos, sino todo lo contrario:
se observaba una zona difusa (Fig. 4).
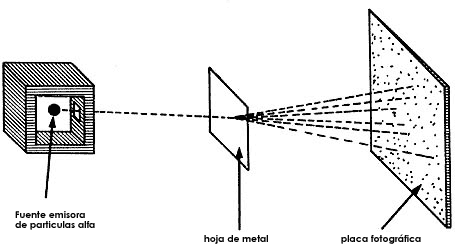
Figura 4. Las partículas emitidas por la fuente radiactiva se desvían al pasar
a través de una hoja metálica. El grado de desviación queda registrado cuando
las partículas chocan con la placa fotográfica.
Estos experimentos, aparentemente tan sencillos, cuyos resultados pudieron haber pasado inadvertidos para muchos, fueron muy significativos para Rutherford, quien obtuvo de ellos resultados verdaderamente asombrosos; concluyó de sus experimentos que la mayoría de las partículas alfa pasaban a través de la hoja de metal sin afectarse ni desviarse, como si pasaran a través de un agujero, mientras que otras pocas se desviaban intensamente, causando esa difusión observada en la placa fotográfica. Si el modelo del átomo de Thomson fuera correcto, las cargas positivas y negativas estarían bien difundidas en todo el material y todas las partículas alfa pasarían desviándose muy poco. El hecho de que sólo algunas partículas alfa se desviaran enormemente significaba para Rutherford que en alguna parte del átomo debía de existir un núcleo muy denso y cargado positivamente, capaz de rechazar las partículas alfa, también cargadas positivamente.
Como consecuencia de sus experimentos y cálculos, Rutherford encontró algo
que le debió de parecer sumamente extraño: la masa del átomo estaba encerrada
casi toda en un núcleo; el átomo era como una esfera prácticamente hueca, y
el tamaño del átomo debía de ser inmensamente mayor que el de ese núcleo.
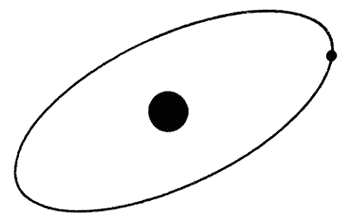
Su modelo del átomo que propuso en 1911, tenía un núcleo muy pequeño y muy denso cargado positivamente, rodeado de electrones cargados negativamente en movimiento alrededor del núcleo.
En la época en que Rutherford (Fig. 5) proponía su modelo nuclear del átomo,
las únicas partículas conocidas que podían constituir la materia eran los protones,
partículas de carga positiva, y los electrones, partículas de carga negativa.
Rutherford pensó originalmente que el núcleo podría estar formado por protones;
sin embargo, no pudo explicar su modelo del núcleo con la presencia de sólo
estas partículas, ya que supuso que podría ser muy inestable, en virtud de la
carga positiva tan condensada que tendría. Así fue como predijo, en 1920, la
existencia de una partícula nuclear neutra, que, según supuso, era necesaria
para la estabilidad del núcleo. Fue necesario esperar la llegada de los años
treinta para que el "neutrón", como lo llamaron más tarde, fuera descubierto.

Durante mucho tiempo se trató de encontrar al neutrón postulado por Rutherford; pero fue una casualidad, como sucede muy a menudo con los descubrimientos científicos, lo que hizo posible este descubrimiento. En 1930, dos físicos alemanes, Bothe y Becker, observaron una radiación emitida por núcleos de boro, berilio y litio cuando eran bombardeados por la radiación alfa. Las partículas desconocidas que se emitían posteriormente a la irradiación eran muy penetrantes y capaces de atravesar capas gruesas de elementos pesados sin ser absorbidas en forma notoria. Poco después, en el Instituto del Radio en París, dos científicos franceses, a los que nos referiremos en este libro en muchas ocasiones al tratar la radiactividad artificial, Frédéric e Irčne Joliot-Curie, estudiaron la absorción de los rayos que habían encontrado Bothe y Becker. Observaron la propiedad que tienen estas partículas de ser absorbidas rápidamente por substancias con un contenido alto de hidrógeno, como la parafina y el agua, y también de proyectar los átomos de hidrógeno de estas substancias a una gran velocidad. Los resultados de los trabajos publicados por los Joliot-Curie provocaron la sorpresa de los físicos del laboratorio Cavendish de Cambridge. James Chadwick, científico de este laboratorio, estudió la radiación observada por ellos y su propiedad de proyectar los átomos de hidrógeno fuera de la parafina.
Después de estudiar su naturaleza y las características de su recorrido a través de la materia, Chadwick concluyó que esta partícula nueva tenía una masa muy semejante a la del protón, pero sin carga eléctrica alguna, y era precisamente la partícula que él suponía presente en la materia y que estaba buscando sin éxito desde hacía muchos años: el neutrón. La radiación encontrada por Bothe y Becker estaba constituida por neutrones, partículas predichas por Rutherford en el mismo laboratorio. Fueron necesarios más de 12 años de trabajo sobre el mismo tema por físicos alemanes, franceses e ingleses para establecer la existencia del neutrón. El descubrimiento del neutrón permitió resolver los problemas que existían para explicar la constitución del átomo. Chadwick reconoció que el neutrón formaba parte de todos los núcleos, con excepción del de hidrógeno.
LO QUE SE SABE AHORA SOBRE LA MATERIA
Finalmente se fueron juntando las piezas del rompecabezas para formar una imagen del átomo. Con el descubrimiento del neutrón se fortaleció el modelo nuclear del átomo de Rutherford.
Posteriormente se presentarían cambios a este modelo para explicar con más exactitud los fenómenos observados; sin embargo, el concepto del modelo nuclear del átomo no cambió.
Según la teoría atómica, lo que nos rodea está formado de moléculas y éstas de elementos, sustancias sencillas que no pueden descomponerse en sustancias más sencillas por cambio químico. Los elementos, a su vez, están formados por átomos, partículas extremadamente pequeñas que el ojo humano no puede distinguir. Es fácil darse cuenta de que debe de existir un gran número de ellos, ya que una gota de agua contiene aproximadamente 1 000 000 000 000 000 000 000 (1021, es decir, mil trillones) de átomos. Esta cantidad tan grande da idea de la pequeñez del átomo y del gran número de ellos que existen en todo lo que nos rodea.
Los átomos, de acuerdo con la teoría de Rutherford, están constituidos por un núcleo de carga eléctrica positiva, rodeado por una nube de electrones o negatrones, con carga eléctrica total de igual magnitud que la del núcleo, pero de signo opuesto. Los electrones, que giran alrededor del núcleo a grandes velocidades, tienen carga eléctrica negativa y una masa muy pequeña; una dosmilésima parte de la masa de un protón.
El tamaño del núcleo es tan pequeño, comparado con el resto del átomo, que si el átomo fuera una esfera de 1 kilómetro de diámetro, su núcleo tendría apenas el tamaño de una canica de 1 cm y los electrones se verían apenas como puntos a los que difícilmente se les podría medir sus dimensiones. De hecho, el núcleo contiene casi toda la masa del átomo, y en muchos casos es aproximadamente 4 000 veces más pesado que los electrones periféricos, pero tiene dimensiones muy pequeñas.
Por ser precisamente la parte fundamental del núcleo, a los protones y neutrones se les llama nucleones. A pesar de su pequeñez, el núcleo del átomo es muy pesado: si se pudiera juntar materia nuclear en un volumen de 1 cm³, su peso sería de doscientos millones de toneladas.
Una vez que se estableció el modelo nuclear del átomo, se hizo evidente que las transformaciones radiactivas son procesos nucleares. Todos los núcleos, excepto el del hidrógeno, están formados principalmente por protones y neutrones. El número de protones, que es también igual al número de electrones extranucleares en el átomo neutro, es su número atómico. Por otra parte, el número total de nucleones, es decir de protones y neutrones, se conoce como masa atómica.
Los números atómicos de los elementos conocidos van desde 1 para el hidrógeno hasta el 106 para el elemento más pesado conocido. Se conocen, además, núcleos con número de neutrones desde cero hasta 159. Los números de masa (masa atómica) de los elementos conocidos varían desde 1 hasta 263. Es importante notar que en el caso de los elementos más ligeros la masa atómica es aproximadamente el doble del número atómico. Esto es otra forma de decir que estos núcleos ligeros contienen aproximadamente números iguales de protones y neutrones. El helio-4, en particular, tiene 2 protones y 2 neutrones.
Los científicos acostumbran expresar en forma taquigráfica la nomenclatura de los núcleos con diferentes propiedades físicas. El símbolo utilizado para denotar las especies nucleares es el símbolo químico del elemento con el número de masa como superíndice izquierdo y el número atómico como subíndice izquierdo; así, el helio de masa 4 se transcribe: 4/2He. En la literatura antigua se utilizaba también poner el número de masa como superíndice derecho: 2He4, nomenclatura que en ocasiones aún se encuentra en la literatura. Sin embargo, el subíndice, que indica el número atómico, a menudo se omite, pues cada elemento químico tiene su número atómico característico. Existe también la costumbre de simplificar esta nomenclatura escribiendo el nombre del elemento seguido de un número que indica su número de masa: helio-4.
Las masas de los núcleos atómicos son tan pequeñas cuando se expresan en gramos (menos de 10-21 gramos), que se expresan en general en una escala diferente. La escala que se acepta universalmente en la actualidad está basada en la masa de un átomo de carbono-12 tomado exactamente como 12 000 000 unidades atómicas de masa. La información a este respecto para cada elemento se encuentra distribuida muy ampliamente en la literatura de tablas que dan la información; sin embargo, es importante hacer notar que esta información está dada en general para las masas atómicas y no sobre las masas nucleares. En otras palabras: las masas tabuladas incluyen las masas de los electrones extranucleares en los átomos neutros.
MENDELEEV, SU TABLA PERIÓDICA DE LOS ELEMENTOS Y LA RADIACTIVIDAD
Mendeleev, en 1864, clasificó los elementos conocidos en esa época en lo que
llamó tabla periódica (Fig. 6).
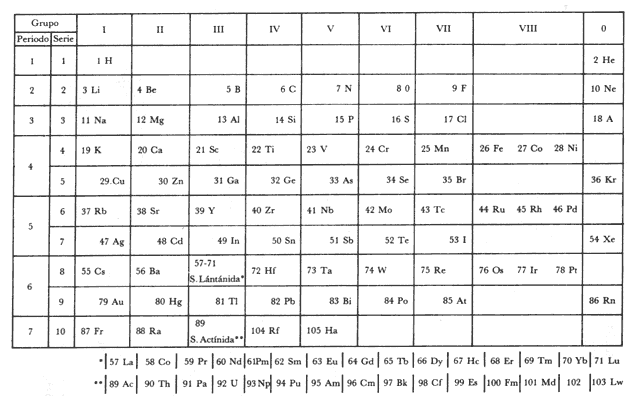
Figura 6. Tabla periódica de los elementos. Mendeleev agrupó los
elementos con propiedades semejantes uno junto a otro horizontalmente, mientras
que en las tablas actuales, como la que se muestra, se colocan uno debajo del
otro. Mendeleev ordenó los elementos por sus pesos atómicos; ahora se ordenan
conforme a sus números atómicos. Así pues, hay varias diferencias entre la tabla
original del científico ruso y las actuales.
Para comprender la importancia de la tabla periódica de los elementos retrocedamos en el tiempo al año de 1815, cuando el científico y médico inglés William Prout observó que, al escoger el peso del hidrógeno como la unidad, las masas atómicas de la mayoría de los elementos ligeros eran muy aproximadamente cercanas a números enteros. Esto lo llevó a concluir que los átomos de todos los elementos deberían de estar formados por átomos de hidrógeno. De acuerdo con esta teoría, el átomo de oxígeno estaría formado por 16 átomos de hidrógeno, y el carbono por 12. Ahora sabemos que Prout estaba muy cerca de la realidad; sin embargo, su idea no fue aceptada en esa época. Sólo 54 años despúés, cuando estas ideas se cristalizaron, Dimitri Mendeleiev en Rusia y Lothar Meyer en Alemania, en el mismo año, publicaron tablas similares, en las que establecieron las leyes de las propiedades de los elementos, a los que ordenaron de acuerdo con sus masas atómicas, comenzando por el hidrógeno, el más ligero de ellos. Mendeleiev agrupó los elementos, por orden creciente de sus pesos atómicos, en periodos o series, de manera que quedasen ordenados por propiedades semejantes.
Huecos en la clasificación de Mendeleev
En la época de Mendeleev faltaban aún numerosos elementos por descubrirse, y constituían los huecos en la tabla que elaboró. En vez de considerarlos como excepciones de su sistema de clasificación Mendeleev supuso, con osadía, que los huecos de su clasificación correspondían a elementos desconocidos en esa época; y como si eso fuera poco, se lanzó a describir los elementos faltantes. Se puede decir que la importancia de su tabla periódica de los elementos se basa más en los huecos que encontró que en la tabla misma. Mendeleev se fijó de modo especial en tres huecos que quedaban junto a los elementos boro, aluminio y silicio y que correspondían a elementos aún no conocidos, sabiendo de ellos solamente el sitio que ocuparían en la tabla cuando fuesen descubiertos. Llegó incluso a ponerles nombres a los elementos que correspondían a esos huecos: ekaboro, ekaaluminio y ekasilicio.
Tomando en cuenta que las propiedades de los elementos en un mismo grupo son semejantes, Mendeleev pudo predecir sus propiedades físicas y químicas. Quizás la tabla de Mendeleev no habría tenido tanta importancia si no se hubieran verificado sus predicciones. Los diferentes elementos que faltaban dentro de la tabla fueron descubriéndose generalmente a partir de los minerales de los elementos vecinos, ya que las propiedades químicas similares tienden a reunir a los elementos del mismo grupo.
Los tres elementos mencionados, ekaboro, ekaaluminio y ekasilicio, fueron descubiertos en un periodo de quince años a partir de la descripción de Mendeleev. Con el descubrimiento del germanio, la hipótesis se fortaleció, pues las propiedades de ese elemento se parecían asombrosamente a las del ekasilicio predicho por Mendeleev. Igualmente sorprendentes resultaron los descubrimientos del galio, que correspondía al ekaaluminio, y del escandio, correspondiente al ekaboro. Nadie podía dudar después de esto de la validez o utilidad de la tabla periódica.
A pesar del gran éxito que había tenido el sistema de Mendeleev, aún tenía que resistir la repercusión del descubrimiento de varios materiales radiactivos, para los que no parecía encontrarse sitio en la tabla periódica.
Todavía en los años veinte de este siglo quedaban por descubrirse varios elementos, entre ellos los análogos del manganeso, cuya existencia fue anticipada por Mendeleev, quien los llamó ekamanganeso y dvimanganeso. Transcurrieron más de 50 años hasta que se descubrió el renio, que correspondía al dvimanganeso de Mendeleev. De hecho, el renio fue el último de los elementos estables descubiertos; y fue necesario el desarrollo de la física nuclear y de la radioquímica para descubrir, finalmente, que los elementos faltantes eran radiactivos de vida media bastante más corta que la vida de nuestro planeta y que, por consiguiente, no existían en la Tierra.
Ya para el año de 1912 se habían encontrado un gran número de diferentes materiales radiactivos; pero ¿cómo se podían acomodar en la clasificación periódica de los elementos? Había docenas de estos materiales radiactivos, y en la tabla de Mendeleev no había sitio para ellos.
Frederick Soddy, quien había colaborado anteriormente con Rutherford en la explicación del comportamiento de la radiactividad natural, sabía que el núcleo de un átomo radiactivo pierde peso y carga positiva al emitir una partícula alfa. No obstante, cuando un núcleo emite una partícula beta su peso permanece casi sin cambio, pero su carga aumenta. Así fue como Soddy pudo deducir los pesos y la carga nuclear de muchos productos radiactivos. En varios casos, dos productos radiactivos diferentes tenían la misma carga nuclear pero diferentes pesos. La carga positiva que posee un núcleo es la que determina la cantidad de electrones necesarios para neutralizar el átomo; la carga del núcleo es, por lo tanto, la responsable de sus características exteriores, o sea, las propiedades químicas del átomo.
Esta conclusión se confirmó cuando Soddy encontró que los diferentes materiales radiactivos no siempre se podían separar unos de otros por técnicas químicas, lo cual indicaba que eran partes de un mismo elemento químico, que cada grupo de especies inseparables correspondía a un solo elemento químico y que en el mismo sitio de la tabla periódica quedaban clasificados átomos químicamente iguales con núcleos diferentes y con propiedades físicas distintas. Soddy propuso el nombre de isótopo, del griego iso —igual— y topos —lugar—, para designar a las especies de un grupo; ese nombre indica, pues, que tales especies ocupan el mismo lugar en la clasificación de los elementos. Actualmente en cada casilla de la tabla de elementos se clasifican todos los átomos con el mismo número de protones, o sea, con el mismo número atómico, aun cuando su masa sea diferente como consecuencia de tener diferente número de neutrones. De acuerdo con esta definición, todos los núcleos que tienen el mismo número de protones, pero con diversas combinaciones de neutrones, se llaman isótopos. Todos los isótopos de un elemento tienen la misma cantidad de electrones periféricos, y esta cantidad es igual al número de protones del núcleo. Como el comportamiento químico de los elementos depende de sus electrones, entonces se puede decir que todos los isótopos de un elemento se comportan químicamente en la misma forma. En la naturaleza se encuentran elementos que tienen varios isótopos.
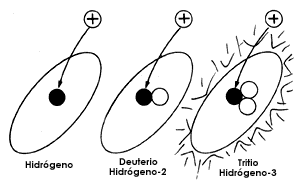
El elemento más sencillo, el hidrógeno, tiene un solo protón, pero se conocen
tres isótopos de este elemento: el hidrógeno-l, el hidrógeno-2 o deuterio, y
finalmente el hidrógeno-3 o tritio, cuyos núcleos están formados solamente por
1 protón; el primero de ellos no tiene neutrones, mientras que el segundo, el
deuterio, tiene un solo neutrón, y el tritio tiene 2 neutrones (Fig. 7).
Agua. De acuerdo con el isótopo de hidrógeno que contengan, existen diferentes moléculas de agua:
El agua ligera está formada por dos átomos de hidrógeno y uno de oxígeno:
el agua pesada tiene un átomo de deuterio:
y, finalmente, el agua tritiada tiene un átomo de tritio:
El uranio que existe en la naturaleza también tiene varios isótopos: el uranio-234, el uranio-235 y el uranio-238. Todos ellos tienen 92 protones en el núcleo; el primero tiene sólo 142 neutrones, mientras que el segundo tiene 143, y el último tiene 146.
Los isótopos estables con pocos protones tienen, en general, un número igual
de neutrones; pero a medida que aumenta el número de protones va aumentando
la carga positiva concentrada, y para estabilizar el átomo aumenta también el
número de neutrones; de otra forma, la repulsión entre las cargas positivas
de los protones haría que el átomo fuera muy inestable. Esto se puede ver en
la gráfica que muestra el número de neutrones de un núcleo en función de su
número de protones (Fig. 8). A esta curva se le llama curva de estabilidad del
núcleo, y muestra que los núcleos estables con pocos protones es tán a lo largo
de una línea diagonal, donde existen igual número de protones y neutrones, pero
a medida que aumenta el número de protones la línea se va curvando, lo cual
indica que en átomos con masas nucleares grandes los núcleos estables tienen
muchos más neutrones que protones. Sin embargo, hay un límite para la estabilidad
de los núcleos, ya que todos los que tienen 84 protones o más son radiactivos.
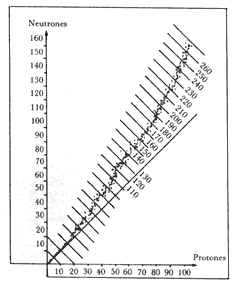
Figura 8. Respresentación del número de neutrones en función del número de protones
de los diferentes núcleos. A lo largo de la línea oblicua se encuentran aquellos
núcleos ligeros con igual número de protones y neutrones. (Referencia: Fernández-Valverde,
M., Ciencia y Desarrollo 23, p. 880, 1978.)
LOS ISÓTOPOS RADIACTIVOS Y LAS RADIACIONES QUE EMITEN
Se ha comentado antes que algunos isótopos de elementos que se encuentran en
la naturaleza son inestables. Esto significa que sus núcleos emiten radiaciones
o partículas, o ambas, y se descomponen espontáneamente, formando átomos del
mismo o de otros elementos. A estos isótopos inestables se les llama isótopos
radiactivos. Mientras que el hidrógeno-l y el hidrógeno-2, o deuterio, son isótopos
estables del elemento hidrógeno, el tritio es radiactivo y se desintegra emitiendo
radiación beta. Asimismo, el carbono-12, isótopo estable, tiene 6 neutrones
y 6 protones, mientras que el carbono-14, con 6 protones y 8 neutrones, es radiactivo.
Estos isótopos radiactivos se encuentran fuera de la línea de estabilidad ya
discutida anteriormente. La radiación alfa, beta y gamma provienen del núcleo
atómico (Fig. 9).
Figura 9. Las radiaciones alfa (a), beta (b)
y gamma (g) provienen del núcleo atómico. (Referencia:
Segovia, Naturaleza 5, p. 107, 1974.)
Soddy describió el modo en que un átomo cambia al emitir una partícula alfa, la cual está constituida por un núcleo de helio, formado por cuatro nucleones: dos protones y dos neutrones (véase, adelante, la Fig. 31).
Cuando un núcleo decae por la emisión de una partícula alfa su masa atómica disminuye en cuatro unidades, ya que pierde dos neutrones y dos protones, y su número atómico en dos unidades, pues pierde dos cargas positivas del núcleo. Como ejemplo de este decaimiento se tiene el caso de los átomos de radio-226 que tienen número atómico 88.
En un gramo de radio cada segundo se transforman 37 000 000 000 de átomos en
átomos de otro elemento, el radón, que es un elemento gaseoso. A su vez, el
número de masa del radón es 222 y su número atómico es 86. Difiere del radio
por cuatro unidades de masa y dos unidades en su número atómico (Fig. 10). Estas
4 unidades de masa y dos unidades de número atómico no pueden desaparecer: se
eliminan en forma de la partícula alfa. Si un átomo pierde una partícula alfa,
con una carga +2, la carga total de su núcleo disminuye en dos. Si se grafica
el número de neutrones en función del número de protones en una tabla como la
del ajedrez, se puede observar cómo se transforma el núcleo del radio-226 en
radón-222 durante la emisión de la partícula alfa (Fig. 11).
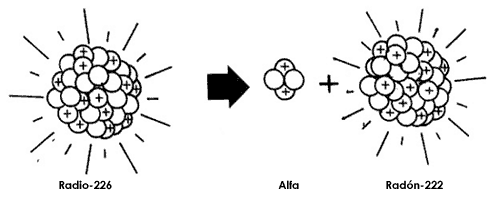
Figura 10. Decaimiento alfa del radio-226.
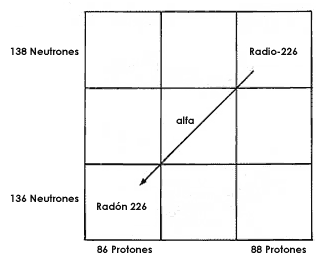
Figura 11. Decaimiento alfa del radio-226.
Existe otro tipo de decaimiento radiactivo, por emisión de las partículas beta. Las partículas beta emitidas por los núcleos son electrones. Las radiaciones emitidas por el uranio, torio y otros elementos naturales incluyen electrones de carga negativa; pero ahora se sabe que también existen núcleos inestables que emiten electrones positivos: a los primeros también se les llama negatrones; a los segundos se les denomina positrones. Estos electrones no deben confundirse con los electrones que se mueven a grandes velocidades alrededor del núcleo del átomo.
Ya que la masa del electrón es sólo una pequeñísima parte de la masa del átomo, la emisión de una partícula beta prácticamente no altera el número de masa de un núcleo radiactivo. Sin embargo, la emisión de una partícula beta negativa se lleva una unidad de carga negativa del núcleo. Como consecuencia, éste se carga positivamente y el número atómico del átomo aumenta en una unidad. La emisión de una partícula beta positiva tiene precisamente el efecto opuesto, el núcleo pierde una carga positiva y el número atómico disminuye en una unidad.
Cuando el yodo-131 decae el emitir una partícula beta negativa nace un núcleo
de xenón-131, que es un gas noble. En la figura 12 se grafica en forma de tablero
de ajedrez este decaimiento; ahí se indica cómo se transforma el yodo en xenón,
cuyo núcleo tiene un protón más que el yodo.
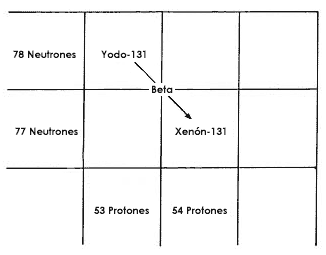
Figura 12. Decaimiento beta negativo.
Por otra parte, cuando el cobre-64 decae al emitir una partícula beta positiva
nace también un núcleo nuevo, en esta ocasión el níquel-64. La gráfica de la
figura 13 muestra este decaimiento e indica cómo se transforma el cobre en níquel,
cuyo núcleo tiene un protón menos que el cobre.
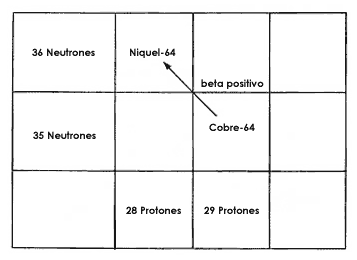
Figura 13. Decaimiento beta positivo.
Finalmente, los rayos gamma, en la mayoría de los casos, acompañan a la emisión de partículas alfa o beta y acarrean el exceso de energía que tiene el núcleo después de su decaimiento. Cuando un átomo emite un rayo gamma (sin carga), se altera su contenido energético pero no cambia el número de partículas, de modo que continúa siendo el mismo elemento y no cambia su posición en el tablero de ajedrez utilizado anteriormente.
Existen algunos isótopos radiactivos que tienen masas y cargas idénticas, es decir, que tienen el mismo número de protones y de neutrones, pero diferentes propiedades radiactivas, como son sus vidas medias y las energías de las radiaciones emitidas. Estos núcleos reciben el nombre de isómeros nucleares. El isómero que presenta el estado de mayor energía, el más excitado, recibe el nombre de isómero en estado metaestable, y al de menor energía, se le llama isómero en estado base. Un núcleo metaestable puede decaer, por emisión de rayos gamma, a su isómero en el estado base. La transición de un estado a otro se llama transición isomérica. Por ejemplo, el selenio 81 m emite radiación electromagnética y pasa a selenio 81 en el estado base. A menudo, estos isómeros nucleares en el estado base también son radiactivos.
LA PENETRACIÓN DE LAS RADIACIONES NUCLEARES EN LA MATERIA Y LOS EFECTOS QUE PRODUCEN
Cada una de las radiaciones nucleares alfa, beta y gamma se caracteriza por
su diferente poder de penetración en la materia. Las partículas alfa son frenadas
por una hoja de papel, que no les permite continuar su trayectoria, mientras
que esta misma hoja sí permite pasar a las partículas beta y a la radiación
gamma; una hoja delgada de aluminio como de 1 mm de espesor sólo deja pasar
una pequeña fracción de la radiación beta y casi la totalidad de la radiación
gamma; una placa de plomo intercepta la radiación gamma, dejando pasar solamente
una fracción de ella (Fig. 14).
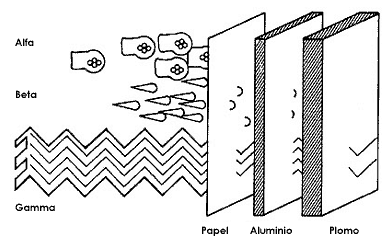
Figura 14. Las partículas alfa son frenadas por una hoja de papel, pero las
partículas beta sí la atraviesan. Una hoja delgada de aluminio sólo deja pasar
una fracción de las partículas beta y casi la totalidad de la radiación gamma.
La placa de plomo es la única que intercepta la radiación gamma.
La poca penetración que tienen en la materia las radiaciones alfa y beta se
debe principalmente a que son partículas cargadas eléctricamente y a que, por
esto mismo, interaccionan con la materia. Existen dos tipos de interacción de
las partículas cargadas con la materia: la ionización y la excitación. La ionización
es el fenómeno en el que las partículas alfa y beta al recorrer el material
le ceden parte de su energía arrancándole electrones de sus átomos y dejándolos
cargados positivamente; a estas especies se les llama iones (Fig. 15). En este
proceso también se liberan electrones, que, como sabemos, tienen cargas negativas.
La excitación, por otra parte, consiste en que cuando las partículas cargadas,
alfa o beta, atraviesan el material dejan a los electrones periféricos de sus
átomos con mayor energía que la que tenían antes (Fig. 16). El átomo queda así
con un exceso de energía, y puede volver a su estado original básico emitiendo
en forma de luz la energía sobrante.
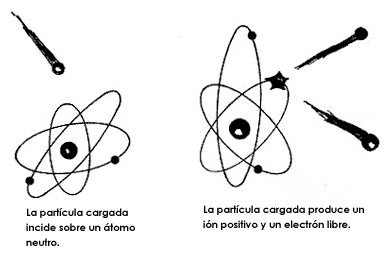
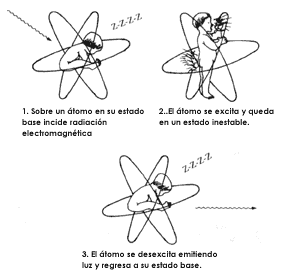
Figura 16. Fenómeno de excitación. (Referencia: Segovia, Naturaleza 5, p. 107, 1974.)
El número de iones liberados y el tipo de luz emitida en un material por el
paso de la radiación dependen, entre otras cosas, de la energía que pierden
las partículas cargadas alfa y beta al atravesarla. Pero ¿y la radiación gamma?
No tiene carga ni masa y su poder de penetración en la materia es muy grande;
sin embargo, esta radiación puede producir otros tres fenómenos, denominados
efecto Compton, efecto fotoeléctrico y creación de pares (Fig. 17). Lo más importante
de estos tres efectos es que en todos ellos aparecen partículas cargadas eléctricamente;
las que producen a su vez, como fenómenos secundarios, la ionización y la excitación.
Así pues, se puede generalizar diciendo que la radiación nuclear interacciona
con la materia que atraviesa y produce de manera directa o indirecta ionización
o excitación de los átomos y por este efecto se pueden medir.
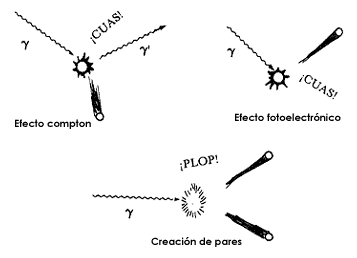
Figura 17. Tres fenómenos provocados por la radiacion gamma. (Referencia: Segovia, Naturaleza 5, p. 107, 1974.)
¿CÓMO SE MIDE LA RADIACTIVIDAD?
La radiactividad es un fenómeno que tardó mucho en descubrirse, pues el ser humano no puede ver ni oler ni oír las radiaciones emitidas por los elementos radiactivos: por lo general, sus sentidos no pueden percibirla. Pero en cuanto se descubrió que el uranio emitía radiaciones se empezaron a fabricar instrumentos que ayudaran a los sentidos a detectar lo imperceptible. Las radiaciones nucleares sólo se pueden observar indirectamente a través de los efectos que producen al atravesar la materia, y los aparatos diseñados para medir su energía e intensidad están basados en estos efectos: 1) La producción de iones cargados eléctricamente, 2) la producción de excitación que se emite en forma de luz.
El primer método para medir la radiactividad precisamente fue el que le permitió a Becquerel descubrirla. En efecto, la placa fotográfica es un detector de radiactividad que se ennegrece en menor o mayor grado cuando la radiación nuclear incide en ella. Mayor ennegrecimiento indica presencia de mayor cantidad de radiaciones nucleares. Becquerel se dio cuenta del carácter ionizante de las emanaciones del uranio y utilizó para medirlas un aparato ya conocido en su época, el electroscopio, que se utilizaba para medir corriente eléctrica.
El fenómeno de ionización puede observarse gracias a que los iones cargados positivamente y los electrones cargados negativamente pueden ser acelerados por un campo eléctrico, pasar por un filamento y generar así una corriente eléctrica que se mide con un aparato apropiado. Mayor corriente eléctrica indica la presencia de fuentes radiactivas de mayor intensidad. La respuesta del equipo detector puede observarse en otro dispositivo que registre las radiaciones detectadas: un escalador, una bocina o una bombilla eléctrica (foco).
El fenómeno de excitación electrónica puede observarse gracias a los destellos luminosos que se producen al desexcitarse los átomos excitados. Estos destellos luminosos se pueden observar en ocasiones directamente y en otras ocasiones requieren de ayuda de dispositivos que puedan analizar la luz de esos destellos.
Para detectar partículas alfa se requieren ventanas extremadamente delgadas, pues de otra forma estas partículas se frenan en la ventana y no la pueden penetrar. También se utilizan ventanas especiales para detectar partículas beta, cuando no se requiere que sean tan delgadas como las utilizadas para detectar las partículas alfa.
La radiación gamma es mucho más penetrante. Puede pasar a través de las paredes de un contador ordinario, por lo que no requiere de ventanas especiales. La facilidad o dificultad con que una radiación pasa a través de una pared o una ventana de un detector ayuda para identificarla. Por ejemplo, la partícula alfa no atraviesa las ventanas que se emplean para detectar partículas beta. Una lámina delgada de metal colocada sobre la ventana para medir partículas beta excluirá a estas partículas beta, pero no detendrá a la radiación gamma.
Como ejemplo de detectores, mencionaremos el inventado por Geiger y que por ello lleva su nombre; se basa en el fenómeno de la ionización. Se puede construir en muchas diferentes formas y tamaños; la forma cilíndrica es generalmente la más sencilla de construir.
El material que se usa para fabricar un detector de este tipo es un gas confinado
en un recipiente cubierto con una capa metálica en el interior. Al aplicarse
una diferencia de potencial en los electrodos se pueden medir tanto los electrones
como los iones positivos producidos durante el proceso de ionización al pasar
la radiación nuclear por el gas confinado. La figura 18 muestra un cilindro
lleno de un gas; el electrodo negativo es el alambre central, y el positivo
la capa metálica del tubo mismo. Al conectarse el sistema a una fuente de voltaje
se crea una diferencia de potencial. Cuando el voltaje aumenta, también aumenta
la cantidad de electrones que pasan por el alambre (Fig. 18).
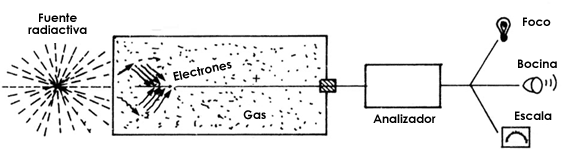
Figura 18. El detector Geiger mide la radiactividad. (Referencia:
Segovia,
Naturaleza 5, p. 109, 1974.)
Cada isótopo radiactivo emite radiación de energía característica; y gracias
a que esta radiación es siempre la misma, se pueden identificar los átomos que
las emiten. En la actualidad se utiliza un detector apropiado acoplado a un
equipo que se conoce con el nombre de analizador multicanal, el cual, además
de detectar la radiación emitida por cada isótopo radiactivo, puede determinar
la energía de ésta. Cuando la radiación incide en el detector se produce una
señal o pulso eléctrico, y el tamaño de este pulso depende de la energía absorbida
por el detector. El analizador multicanal tiene una serie de pequeñas ventanas,
denominadas canales; cada una de ellas acepta sólo los pulsos que poseen una
altura determinada y los acumula. La información que se obtiene después de un
cierto tiempo se traduce en un espectro de energías, que se construye haciendo
una gráfica del número de cuentas acumulado en cada canal en función del número
de éste, es decir, de la energía (Fig. 19).
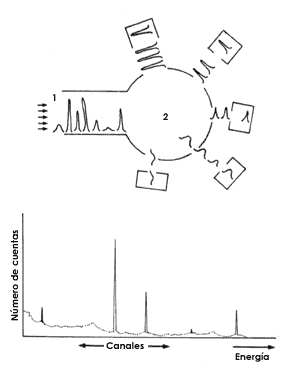
Figura 19. Arriba: Esquema de una analizador multicanal. 1)
Llegan todos los pulsos. 2) Los pulsos se acumulan en los canales después
de ser clasificados en función de su altura, es decir, de la enregía. Abajo:
Espectro gamma característico del sodio de masa 24. Este espectro fue obtenido
con un detector de germanio-litio acoplado a un analizador de 4 000 canales.
(Referencia: Jiménez Reyes, Ciencia y Desarrollo 23, p. 67, 1978.)