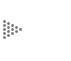II. LAS MARAVILLAS DE LA LUZ
LOS astrónomos se pueden considerar como los mejores detectives del mundo, pues para estudiar el Universo cuentan con una sola pista: la luz. Un astrónomo no puede realizar experimentos mediante los cuales manipule a sus objetos de estudio. Todo lo que sabemos de los cuerpos celestes, su masa, temperatura, tamaño, composición química, distancia, etc., lo deducimos a partir de la luz que recibimos de ellos. En este capítulo trataremos de dar respuesta a las preguntas: ¿qué es la luz?, y ¿cómo podemos descifrar su mensaje?
Cuando recibimos la luz de una estrella distante, por ejemplo Vega, el ojo responde a una señal que empezó su viaje hace 26 años (Vega está a 26 años luz de distancia). Cuando esa señal llega al ojo, produce cambios químicos en la retina, que son transmitidos por el nervio óptico al cerebro como sensación de luz. La fisiología nos explica el viaje de la luz desde la retina al cerebro; queda el problema de explicar el viaje de la luz a través de los espacios interestelares e intergalácticos. Durante cientos, miles y billones de años las ondas de luz pueden viajar por un vacío casi perfecto. Pero, si no hay materia, ¿cómo puede existir una onda? Usualmente se piensa en una onda como el resultado de la vibración de partículas materiales; como ejemplo tenemos las olas en el agua o las ondas sonoras, que se transmiten por la vibración de las partículas del aire; en el vacío no es posible transmitir sonido ni ninguna onda material. ¿Qué clase de ondas es entonces la luz? ¿Qué clase de vibración se propaga a través del vacío?
La respuesta a estas preguntas fue descubierta hace más de un siglo por James Maxwell, un físico escocés. Las vibraciones de una fuerza eléctrica pueden atravesar el vacío sin partículas que las transporten. La luz es un tipo de vibración eléctrica. Para comprender esta idea, consideremos una partícula eléctricamente cargada, un electrón. Éste se halla rodeado de un campo de fuerza eléctrica, que ejerce en todas direcciones. Si el electrón vibra, dicha vibración será transmitida a otras partículas cargadas a través del campo (que es un concepto físico de un medio inmaterial). En 1865, Maxwell realizaba estudios sobre la electricidad, y, de una formulación matemática, logró deducir que la velocidad con que se transmiten las ondas eléctricas es de trescientos mil kilómetros por segundo. Maxwell no pensaba en absoluto en la luz al hacer sus cálculos; sin embargo, se dio cuenta de que esta velocidad coincidía con la velocidad de propagación de la luz medida varios años antes. Algunos pensaron que era una casualidad, pero Maxwell concluyó que las ondas de luz estaban directamente relacionadas con vibraciones de la fuerza eléctrica.
Existe una ley fundamental del magnetismo, que dice: una corriente eléctrica produce un campo magnético. La oscilación de una carga eléctrica induce entonces una onda eléctrica y una onda magnética que se mueven juntas. Estas ondas son inseparables, y a la combinación de ambas se le denomina una onda electromagnética. La luz es una onda electromagnética. Hay otros tipos de radiación que asimismo son ondas electromagnéticas: los rayos g, rayos X, rayos ultravioleta e infrarrojos, el radar, las señales de TV y de radio. Todas estas radiaciones se transmiten con la misma velocidad (la velocidad de la luz, c = 300 000 km/seg), y conforman el espectro electromagnético. La diferencia entre las distintas partes del espectro electromagnético es la longitud (o frecuencia) de las ondas. (Figura 13.)
La retina del ojo humano es sensible a frecuencias entre 4.3 x l014 vibraciones por segundo (usualmente se usan las unidades de ciclos por segundo, cps o Hertz, Hz) y 7.5 x 1014 Hz. Por ello, a esta banda de frecuencias se le llama región visible del espectro electromagnético. Los límites de esta banda corresponden a los colores límites del arco iris: una señal de frecuencia 7.5 x 1014 Hz se registra en el cerebro como color azul-violeta y una señal de frecuencia 4.2 x 1014 Hz como color rojo. El ojo no responde a frecuencias mayores (luz ultravioleta, rayos X, rayos g) ni a frecuencias menores (luz infrarroja, ondas de radio). Esto se debe a que, de toda la radiación electromagnética emitida por el Sol, la única parte que no es absorbida por la atmósfera y llega hasta la superficie de la Tierra, es la banda comprendida entre esas frecuencias limite.1 El ojo humano ha evolucionado para responder a la necesidad de ver objetos sobre la superficie de la Tierra por medio de la luz solar. En otro planeta, con una atmósfera cuya composición fuese tal que absorbiese, por ejemplo, la banda visible y fuese transparente a la banda infrarroja, la evolución podría generar criaturas con ojos sensibles a la luz infrarroja. En estas páginas se muestra (Figura 13) el espectro electromagnético y las características de transparencia de la atmósfera terrestre a las diversas frecuencias.

Figura 13. El espectro electromagnético se extiende desde las ondas de radio
a grandes longitudes de onda (baja frecuencia) hasta los rayos gamma a bajas
longitudes de onda (alta frecuencia). En la figura se muestra la transparencia
de la atmósfera terrestre a los diferentes tipos de radiación. Como se ve, sólo
las ondas de radio y la luz visible llegan a la superficie terrestre.
Hasta hace menos de cincuenta años, a los astrónomos les resultaba inaccesible el estudio de la radiación de los cuerpos celestes fuera de la banda visible. Sin embargo, con el desarrollo de la radioastronomía y de la astronomía desde el espacio exterior, ha comenzado el estudio de la radiación de los cuerpos celestes en casi todo el espectro electromagnético. De esto nos ocuparemos en los capítulos III y V del presente libro.
Una estrella, o cualquier otro objeto suficientemente caliente, radia ondas electromagnéticas de todas las frecuencias, desde infinitamente pequeñas hasta infinitamente grandes. Sin embargo, no todas estas ondas tienen la misma intensidad. La intensidad es siempre baja para muy altas o bajas frecuencias y es máxima a una cierta frecuencia intermedia. ¿Qué es lo que determina esta frecuencia? Para responder esta pregunta pensemos en una barra de hierro que se calienta en un horno de alta temperatura. Al principio, el hierro se calienta pero no emite un resplandor visible debido a que el máximo de la radiación se encuentra en la región infrarroja. Conforme aumenta su temperatura, el hierro empieza a emitir luz, tomándose sucesivamente de rojo intenso a color naranja, amarillo y finalmente blanco.
Este experimento muestra que es la temperatura del objeto lo que determina a qué longitud de onda (frecuencia) se radia la mayor par¡e de la energía. Al aumentar la temperatura, la energía se radia a mayores frecuencias.
La radiación emitida por un objeto debido a su temperatura —y en equilibrio termodinámico— se denomina radiación térmica. Este objeto puede ser un sólido, como la barra de hierro del ejemplo anterior, un líquido, como el metal fundido o la lava, o un gas, como el de los focos de neón, las estrellas o el gas interestelar. En lo que sigue nos ocuparemos de la radiación de los gases incandescentes que constituye uno de los objetos fundamentales de estudio de la astrofísica moderna.
La técnica más importante usada por los astrónomos para descifrar el mensaje de la luz, es la espectroscopia. Esta técnica nos permite descomponer la luz blanca en sus componentes de diversas frecuencias (o colores). Una manera sencilla de hacer esto es mediante un prisma. Cuando en el aire hay suspendidas gotitas de agua, éstas hacen las veces de prisma y observamos el espectro de la luz solar en forma muy hermosa: el arco iris.
Del análisis espectroscópico de la luz de las estrellas y las galaxias podemos extraer una gran cantidad de información; para poder comprender cómo, debemos hacer un paréntesis y profundizar un poco más en nuestro conocimiento de la luz, esta vez a través de la estructura atómica de la materia.
Un profesor alemán de física, llamado Kirchhoff, fue el primero en darse cuenta de que un gas incandescente, al emitir luz, envía un código que depende de los átomos que lo componen. Así, la luz emitida por cada tipo de átomos es diferente y del análisis de la luz se puede determinar la composición química del gas.
Los electrones en un átomo giran alrededor del núcleo, atraídos por una fuerza eléctrica, de manera parecida a como los satélites giran alrededor de la Tierra atraídos por la fuerza de gravedad. Sin embargo, las órbitas de los electrones son diferentes a las de los satélites. Cuando lanzamos un satélite, la órbita puede estar a cualquier distancia de la Tierra que escojamos, dependiendo sólo de la potencia del cohete Sin embargo, las leyes comunes que gobiernan el movimiento de los cuerpos macroscópicos no explican al mundo atómico. De acuerdo con las leyes del mundo atómico, un electrón puede girar alrededor del núcleo atómico únicamente en órbitas a determinadas distancias del núcleo atómico. En el átomo de hidrógeno, por ejemplo, la menor órbita posible para el electrón tiene un radio de 0.53 Å (el angstrom es una unidad de longitud usada en la física atómica, su símbolo es Å y es igual a una cienmillonésima parte de un cm). La siguiente órbita permitida por las leyes atómicas tiene un radio de 2.12 Å. En ningún átomo de hidrógeno del Universo existe un electrón con una órbita intermedia entre estas dos. Estas leyes fueron formuladas por el físico danés Niels Bohr en 1910 y sentaron el fundamento de la mecánica cuántica y con ella la comprensión de la estructura atómica. Asimismo existen leyes que restringen el número de electrones que puede haber en cada órbita (a las órbitas se les llama también capas o niveles). Así, el hidrógeno, el átomo más sencillo, tiene un electrón en la primera capa. Le siguen el helio con dos electrones en la primera capa, el litio con dos en la primera y uno en la segunda, etcétera (Figura 14).
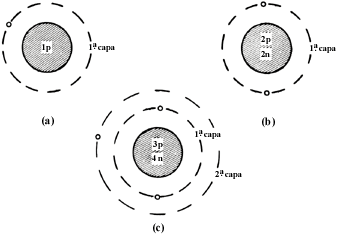
Figura 14. Esquema orbital de los átomos de (a) hidrógeno, (b) helio y
(c) litio.
Esta es la estructura de un átomo no excitado. Al estado no excitado se le denomina estado base. Pero si una partícula choca con el átomo (en un gas los átomos chocan unos con otros continuamente) un electrón puede absorber energía de esta colisión, liberarse de su órbita y brincar a otra órbita (siempre de un radio permitido por las leyes). Este electrón será un electrón excitado, y del átomo se dice que pasa del estado base a un estado excitado. Si la fuerza de la colisión es suficientemente grande, el electrón puede desprenderse por completo del átomo. Un átomo que ha perdido un electrón se denomina un átomo ionizado (o un ion), si ha perdido dos electrones estará doblemente ionizado y así sucesivamente. Al perder todos sus electrones estará totalmente ionizado. Usualmente los electrones más perturbables por las colisiones son los de las capas más externas; los de las internas están más fuertemente atados al núcleo y, además, los electrones de las capas exteriores actúan como una pantalla eléctrica contra las perturbaciones de electrones sueltos.
Cuando un electrón ha brincado a una órbita más alta, no se queda ahí indefinidamente. Después de un cierto tiempo —característico de cada órbita de cada tipo de átomo— tiene una tendencia natural a regresar a su estado base, lo cual hace mediante una transición repentina. Los tiempos típicos para estas transiciones de regreso al estado base son de una cienmilésima de segundo. Lo fundamental de este proceso es que la energía excedente que tenía ese electrón —energía de excitación que había absorbido de la colisión efectuada— es emitida en forma de luz al regresar el electrón a su estado base. El electrón emite un cuanto de luz o un fotón, y así se desexcita.
Un fotón es una partícula luminosa. La vieja discusión que se había dado entre Huygens y Newton sobre si la luz son ondas o partículas, fue resuelta por la mecánica ondulatoria: la luz es una dualidad: onda y partícula al mismo tiempo. Este concepto se extiende a todos los objetos del Universo y su formulación le valió el premio Nobel a Luis de Broglie. El concepto de dualidad es extraño a nuestra manera de pensar; sin embargo, es natural en otras filosofías como, por ejemplo, las que emanan de las religiones hindú y budista.
La energía del fotón emitido, que es directamente proporcional a la frecuencia de la luz emitida,2 tiene un valor preciso y determinado por la diferencia de la energía del electrón antes y después de la transición. Puede también suceder que un electrón pase de un estado excitado a otro menos excitado —de una órbita externa a una más interna, que pueden ser sucesivas o no— antes de llegar a su estado (órbita) base. En cada transición se emitirá un fotón con una frecuencia única proporcional a la diferencia de energía del electrón antes y después de la transición. (Figura 15.)
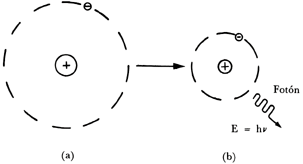
Figura 15. Emisión de un fotón de mayor (a) a menor (b) excitación (o al
estado base). La energía del fotón emitido será igual a la diferencia de las
energías de los dos niveles.
Los átomos pueden ser excitados y ionizados no sólo por colisiones. Un electrón puede también absorber la energía de un fotón. Si el fotón ha sido emitido en la transición de un electrón de la tercera a la segunda órbita, este fotón, al ser absorbido por otro electrón en otro átomo, le proporcionará la energía precisa para pasar de la segunda a la tercera órbita.
Cuando un átomo recaptura un electrón libre que le hacía falta, se dice que se produce una recombinación. Los fotones emitidos por recombinación, al ser absorbidos producen ionización. (Figura 16.)
Figura 16. Cuando un electrón libre se reincorpora a un átomo con un electrón
faltante, se dice que se produce una recombinación (a). Un fotón emitido
por recombinación (b), al ser absorbido por otro átomo (c), produce ionización
(d).
Cuando la temperatura de un gas es moderadamente alta, las colisiones entre partículas llevarán a los electrones al primer nivel excitado (llamado nivel dos, siendo el nivel uno el base). En tal caso, la luz emitida por el gas será de un solo color. Este color corresponde a la longitud de onda (o frecuencia) de los fotones emitidos por la transición de desexcitación de los electrones del segundo al primer nivel. Al examinar esta luz con un espectrógrafo, se verá una sola línea brillante a esa longitud de onda específica. Al aumentar la temperatura del gas, las colisiones se vuelven más violentas y pueden llevar a los electrones a diversos niveles de excitación. Estos electrones, al desexcitarse emitirán fotones de otras longitudes de onda y así se irán agregando líneas a la luz que pasa por el espectrógrafo.3 Este conjunto de líneas luminosas se llama espectro atómico. Las longitudes de onda de las líneas espectrales, producidas por los átomos de un cierto elemento químico, representan una característica fundamental y única de ese tipo de átomos. Así, mediante un análisis espectroscópico, podemos obtener la firma inconfundible de cada elemento químico. En el laboratorio se han determinado con toda precisión las longitudes de onda de las principales líneas espectrales de los distintos elementos químicos.
Ilustraremos lo anterior mediante un ejemplo, el del espectro del átomo más sencillo: el átomo de hidrógeno.
Las transiciones desde cualquier nivel excitado al nivel base, dan lugar a una serie de líneas llamada serie de Lyman. La primera de estas líneas se produce por fotones emitidos en el paso de los electrones del segundo al primer nivel. La longitud de onda de esta línea es a = 1216 Å y se denomina línea Lyman a (a = alfa, primera letra del alfabeto griego) o L y a. La segunda línea es L y b (b = beta, segunda letra del alfabeto griego) y corresponde a la transición del tercero al primer nivel, y así, sucesivamente. El límite de esta serie corresponde a la captura de un electrón libre, es decir a la recombinación al nivel base, y la longitud de onda es l = 912 Å. Toda esta serie de líneas tienen frecuencias correspondientes a la región ultravioleta del espectro. En la región visible, el átomo de hidrógeno emite otra serie de líneas llamada serie de Balmer, que corresponde a todas las transiciones que terminan en el segundo nivel. Se designan estas líneas con una H: Ha (transición del tercer al segundo nivel), Hb (del cuarto al segundo nivel), etc. Las transiciones que terminan en el tercer nivel —o niveles superiores— producen líneas en el infrarrojo. Aquí (Figura 17) se muestran las transiciones que dan lugar a las series de líneas del hidrógeno.
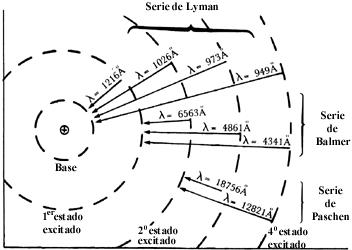
Figura 17. Transiciones que producen el espectro del átomo de hidrógeno.
Como ya habíamos dicho, la excitación y ionización de un gas puede producirse por colisiones o por la absorción de radiación (de fotones). Cuando un átomo emite fotones por las transiciones de sus electrones de un nivd superior a un nivel inferior, como en el anterior ejemplo, se produce el llamado espectro de emisión. Este es un espectro de líneas brillantes a frecuencias específicas y es típicamente emitido por un gas incandescente muy tenue—a baja densidad y presión.
El espectro emitido por sólidos, líquidos o gases densos y a muy altas temperaturas es el llamado espectro continuo. En este caso, los electrones, aquellos que emiten, están libres —no en órbitas atómicas— y esos electrones libres, al chocar entre sí, pueden emitir luz de cualquier frecuencia. En el espectro continuo se mezclan todas las longitudes de onda entre sí de forma continua. El arco iris es un ejemplo.
En ciertas condiciones, un gas puede producir un espectro de absorción. Este es el caso de un gas relativamente frío colocado delante de una fuente luminosa (que puede ser un gas más caliente en emisión). Los átomos del gas más frío absorberán fotones, y aunque éstos sean eventualmente reemitidos, pocos de ellos saldrán en la dirección original. Lo que se observará en el espectrógrafo son series de líneas oscuras, que corresponden a la supresión de luz en determinadas frecuencias (las frecuencias de absorción). Estas líneas oscuras son una especie de negativo de la firma de los átomos que componen el gas que absorbe fotones. Este tipo de espectro fue descubierto por vez primera en el Sol por Wollaston y Fraunhofer a principios del siglo XIX, aunque en aquella época no fue posible explicarlo, por no conocerse las leyes del comportamiento atómico.
En las estrellas, el gas del interior se encuentra a varios millones de grados y es de alta densidad. Los átomos están totalmente ionizados y los electrones libres emiten un espectro continuo. La densidad del gas y su temperatura van disminuyendo desde el centro hacia el exterior. La llamada atmósfera de las estrellas es el gas más externo y aunque se encuentra a miles de grados, es relativamente más frío que el interior. Los átomos de la atmósfera absorben selectivamente ciertos fotones. El resultado es un espectro de absorción superpuesto al continuo de emisión (Figura 18). En cambio el gas interestelar, que es extraordinariamente tenue, produce un espectro de líneas de emisión cuando es iluminado por la radiación estelar.
Aunque el detalle físico es bastante más complicado, hemos visto de manera cualitativa que el espectro nos puede dar información acerca de la composición química, temperatura y densidad del gas. En realidad nos puede dar mucha más información. Esta se obtiene de un análisis fino de la forma y estructura de las líneas espectrales.
Hasta aquí, hemos hablado de la emisión de luz por el calentamiento —o
absorción de energía— de los átomos.
Existen además otros procesos en la naturaleza que producen radiación de fotones de distintas frecuencias. Todos los procesos que no están ligados a la radiación de objetos calientes se denominan procesos de radiación no térmica. Por ahora describiremos sólo uno de ellos, la radiación sincrotrónica. El sincrotrón es un aparato que sirve para acelerar partículas subatómicas y es empleado por los físicos nucleares para hacer experimentos que permitan comprender mejor la estructura del mundo subatómico (el núcleo atómico y las llamadas partículas elementales). En un sincrotrón se aceleran protones y electrones hasta alcanzar velocidades cercanas a la de la luz. Un aparato similar, pero con el que se alcanzan velocidades menores es el ciclotrón. En el sincrotrón se usan imanes para confinar el movimiento de las partículas, valiéndose de que una partícula cargada describe siempre trayectorias espirales alrededor de las líneas del campo magnético, producidas por un imán (Figura 19).
Uno de los descubrimientos fundamentales realizados por Maxwell y otros en su estudio del electromagnetismo, es que toda partícula cargada radia al estar acelerada, es decir produce ondas electromagnéticas. Existe una sola excepción a esta regla que de hecho ya hemos visto, aunque sin mencionarla explícitamente: los electrones de los átomos, al moverse en sus órbitas, no radian, sólo lo hacen cuando cambian de órbita (de un nivel superior a uno inferior). Los electrones en un sincrotrón están libres y, al moverse alrededor de las líneas del campo magnético, radian. Esta radiación se llama radiación sincrotrónica.
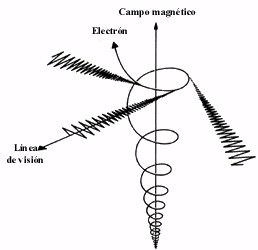
Figura 19. La radiación sincrotrónica es emitida por electrones relativistas
que se mueven en campos magnéticos. La trayectoria que describen los electrones
es helicoidal, alrededor de las líneas de campo.
Mientras más alta sea la energía de las partículas, de mayor intensidad tendrá que ser el campo magnético para confinarlas y más energética será la radiación emitida. Mayor energía significa mayor frecuencia o menor longitud de onda, así que los electrones de energía extremadamente alta —llamados electrones ultrarrelativistas, que se mueven casi a la velocidad de la luz— emitirán rayos X, los de menor energía emitirán luz visible y los de energía aún menor emitirán en radiofrecuencias. Recordemos que, de cualquier modo, todos estos electrones se mueven a velocidades cercanas a la de la luz, de modo que aun los electrones de "baja energía" son muy rápidos. En el espacio no hay físicos nucleares ni aceleradores experimentales y, sin embargo, la naturaleza provee ejemplos de este mismo mecanismo de radiación en diversos procesos astrofísicos que involucran altas energías.
La radiación sincrotrónica puede distinguirse de otros tipos de radiación por hallarse polarizada. Para comprender esto, pensemos en los electrones, que son siempre acelerados alrededor de las líneas de campo magnético (nunca paralelamente a ellas), y recordemos que la radiación es una onda electromagnética, producida por las vibraciones eléctricas y magnéticas. En la radiación polarizada, estas vibraciones se dan en una sola dirección. La aceleración de los electrones causa una vibración del campo cercano a ellos en la dirección del movimiento (Figura 20). Así, cuando se ve al electrón moverse horizontalmente, el campo vibrará horizontalmente. Cuando se investiga la radiación sincrotrónica proveniente del espacio con dos antenas de radio, una orientada horizontalmente y la otra verticalmente, sólo la antena orientada horizontalmente captará la radiación. Las antenas pueden considerarse como pedazos de alambre con electrones libres para moverse en su interior, y sólo los electrones de la antena horizontal podrán moverse en la misma dirección que las vibraciones del campo electromagnético. La antena vertical no recibirá radiación porque sus electrones no pueden moverse horizontalmente. La polarización de la radiación sincrotrónica es la clave para identificar su origen. En el siguiente capítulo, hablaremos de la radiación sincrotrónica proveniente del espacio.

Figura 20. La radiación sincrotrónica está polarizada. Las vibraciones
del campo son en la dirección del movimiento de los electrones.
NOTAS
1 Asimismo atraviesan la amósfera las ondas largas de radio, pero son mucho menos intensas.
2 Están relacionados por la constante de Plank, "h", mediante la expresión E = hv (donde E es la energía y v la frecuencia).
3 Un espectrógrafo es un aparato que puede separar las diversas frecuencias que integran la luz incidente. Esto se logra mediante un prisma o mediante una rejilla de difracción.