III. LA LITOSFERA. METALES Y METALURGIA
LA HISTORIA de los metales y su conocimiento por el hombre es la historia misma del desarrollo de la humanidad. En el primer capítulo hemos visto que el elemento más abundante en la Tierra es el hierro, un metal. Desgraciadamente, en la corteza terrestre la abundancia de hierro no es tan grande, aunque sí considerable: asciende a un 4.7%. Sin embargo, como la mayoría de los metales, el hierro no existe de forma nativa en la superficie de la Tierra (salvo como constituyente de meteoritos).
Para lograr obtenerlos en forma elemental, los compuestos que constituyen los metales requieren ser tratados químicamente. El procesamiento a gran escala de los minerales metálicos para obtener los metales libres recibe el nombre de metalurgia. Amable lector, mire a su alrededor y seguramente encontrará metales. Tal vez en su pluma o lápiz, en la mesa o silla en que trabaja, en las ventanas, en un automóvil, en un poste, en las varillas del edificio que habita, en su reloj, sus pantalones o sus bolsillos. Todos ellos han sido elaborados por el hombre gracias a la química metalúrgica.
La litosfera conforma la parte sólida de la corteza terrestre. Como hemos visto, los elementos que en ella predominan son oxígeno (O), azufre (S), aluminio (Al), hierro (Fe), calcio (Ca), sodio (Na), potasio (k) y magnesio (Mg), de ahí que los compuestos más comunes están formados en primer lugar por oxígeno, como los óxidos. Además de este elemento, otros contienen silicio, formando silicatos, y otros más incorporan también aluminio en los alumino-silicatos.
Una de las clasificaciones más útiles de los elementos los agrupa en tres grandes sistemas.
1. Elementos siderófilos. Se encuentran en forma metálica como el oro (Au), el platino (Pt) y la plata (Ag).
2. Elementos calcófilos. Se encuentran en forma de sulfuros, como el hierro (Fe), el cobre (Cu), el plomo (Pb) y el mercurio (Hg).
3. Elementos litófilos. Se encuentran formando silicatos, como el aluminio (Al), el calcio (Ca) y el magnesio (Mg).
|
Esta clasificación indica la forma más común en
la que se encuentran los elementos en la Tierra
|
El estudio de los compuestos químicos en la litosfera correspondería principalmente al área de los silicatos, ya que ellos representan 95% de todos los minerales en esta capa (rocas, arenas, arcillas, etc.). Sin embargo, preferimos abordar el estudio de los metales, porque han sido más importantes para el desarrollo de la humanidad.
Son pocos los metales que no forman parte de un compuesto y existen en forma de "pepitas", como el oro y la plata, metales nativos, siderófilos.
Aun así, estos metales libres son muy raros; baste decir que la propia palabra "metal" se deriva de un vocablo griego que significa "buscar, procurar".
Desde luego, los metales nativos fueron los primeros que el hombre encontró.
Se cree que el oro empezó a trabajarse hacia el año 4500 a. C. Fue y es altamente estimado a causa de su belleza y rareza. Constituye la recompensa universal en todos los países, las culturas y las épocas. Amarillo, brillante, maleable, inalterable, ha sido para muchos el símbolo de la perfección. Los egipcios decían que "el oro poseía los extremos poderes del Sol encerrados en su cuerpo".
Paradójicamente, si algún alquimista hubiera encontrado la "piedra filosofal",5![[Nota 5]](../imgs/mcommnt.gif) que pudiera convertir otros metales en oro, éste hubiera perdido todo su valor,
sería como chatarra.
que pudiera convertir otros metales en oro, éste hubiera perdido todo su valor,
sería como chatarra.
Para que los metales se popularizaran fue necesario idear un método para obtenerlos
a partir de los minerales que los contienen, y no depender del hallazgo de pepitas
aquí y allá. Este paso en la metalurgia debió ocurrir alrededor del año 4000
a. C., en el Medio Oriente. Entonces pudo obtenerse el cobre a partir de su
mena.
|
Mena= mineral metálico
|
Hacia 3000 a C., se descubrieron algunos minerales con cobre y arsénico (As),
que al transformarse en metales generaban una aleación más dura y resistente
que el cobre solo. Este fue el primer metal que se utilizó para algo más que
adorno, con él se fabricaron herramientas que suplieron a las de piedra.
|
Aleación= disolución de dos metales
|
El trabajo con arsénico es sumamente peligroso, de manera que resultó muy afortunado
descubrir que mezclando minerales de cobre y estaño (Sn) podía obtenerse otra
aleación (el bronce) tan eficaz como el Cu-As, pero más segura.
|
Bronce= Cu-Sn
|
Alrededor de 200 a. C., el bronce se empleó sobre todo para la fabricación de herramientas, armas y armaduras. Un ejército sin armas de este metal se encontraba indefenso ante sus posibles atacantes, de ahí que los forjadores de aquella época gozaran de un enorme prestigio.
Sin embargo, los minerales de estaño son menos abundantes que los de cobre, y las minas conocidas pronto quedaron exhaustas: la humanidad se enfrentó por primera vez al agotamiento de un recurso natural.
Mientras tanto, para 1300 a. C., en Asia Menor se había desarrollado un procedimiento para extraer hierro de sus minerales. Para llevarlo a cabo se requería una alta temperatura, así que no todas las culturas disfrutaron de este avance por carecer de la técnica necesaria. Sin embargo, el hierro que se obtenía era muy quebradizo y no fue sino hasta 900 a. C., cuando, al mezclar carbón de leña con el mineral, se obtuvo el hierro endurecido, o acero.
Durante el siglo pasado se descubrieron nuevos procedimientos para la fabricación
de acero. Se emplearon algunos metales desconocidos para los antiguos, como
cobalto (Co), níquel (Ni), vanadio (V), niobio (Nb), wolframio (W), los cuales
proporcionan al acero más resistencia y otras propiedades sorprendentes. Asimismo,
se desarrollaron procedimientos para obtener aluminio, magnesio, titanio (Ti)
y muchos otros metales, como los de las tierras raras. (véase el Cuadro III.3)
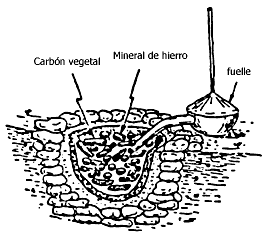
Figura III.1. Crisol primitivo para la reducción del mineral de hierro
En México, las culturas prehispánicas emplearon el oro, la plata y el cobre nativos, e inclusive conocieron el mercurio, el estaño y el plomo.
El oro fue trabajado principalmente por los toltecas, mixtecos, zapotecas y mexicas. También se han descubierto piezas de oro en el centro ceremonial de Chichén Itzá, así como en las tumbas tarascas de Tzin-Tzuntzán.
El hierro que los aztecas, mayas e incas del Perú utilizaban para sus cuchillos, se obtenía de meteoritos que caían del cielo, de ahí que le asignaran un valor superior al oro.
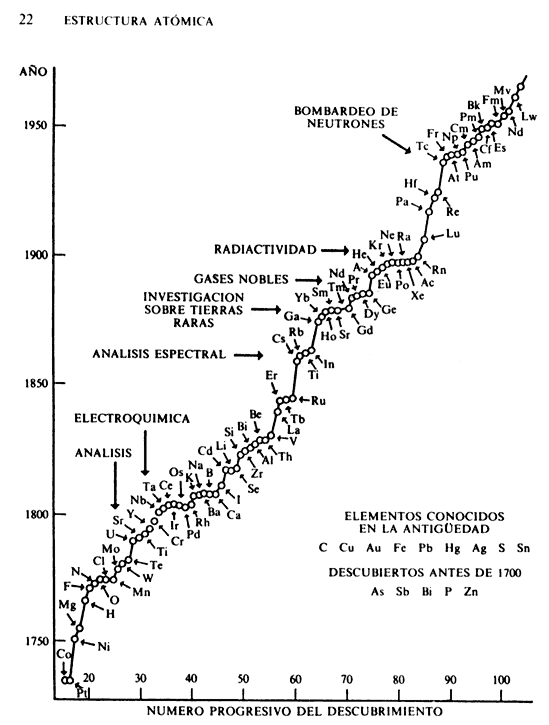
Figura III.2. Diagrama cronológico del descubrimiento de los elementos (Tomado
de Cruz, Chamizo y Garritz, Estructura atómica, Addison Wesley, Wilmimgton,
1986).
LOS RECURSOS NATURALES SE AGOTAN
Nuestro mundo es hoy inconcebible sin metales. No obstante, muchos de ellos
tienden a agotarse (Cuadro III.1). Peligran el platino, la plata, el oro, el
estaño, el mercurio, el zinc (Zn), el plomo, el cobre y el wolframio. Y no es
que estos átomos metálicos estén "esfumándose". Simplemente, al haber sido extraídos
de las minas donde existían en altas concentraciones, se han desparramado por
toda la Tierra o se encuentran en lugares donde su extracción no es rentable,
al menos por el momento. Es decir, los átomos metálicos continúan presentes,
pero esparcidos y combinados con otros materiales en las enormes pilas de desechos
de la humanidad, de donde no son fácilmente recuperables.
|
CUADRO III.1 Años en los que se agotarán las reservas
conocidas de metales si se continúan explotando al mismo ritmo que ahora.
|
|
|
|
|
|
Símbolo
|
Año
|
|
|
|
|
Ag
|
1990
|
|
Al
|
2145
|
|
Au
|
2550
|
|
Crt
|
2125
|
|
Co
|
2010
|
|
Cu
|
1990
|
|
Fe
|
2400
|
|
Hg
|
1985
|
|
Mn
|
2150
|
|
Mo
|
2070
|
|
Ni
|
2110
|
|
Pb
|
1990
|
|
Pt
|
1995
|
|
Sn
|
1995
|
|
W
|
2015
|
|
Zn
|
1990
|
|
|
|
El hombre debe estar atento a todas estas llamadas de atención de la naturaleza respecto al agotamiento de los recursos terrestres. Es necesario refinar los metales inservibles para que vuelvan a ser utilizables.
PROPIEDADES GENERALES DE LOS METALES
|
CUADRO III.2 Generalidades sobre los metales
|
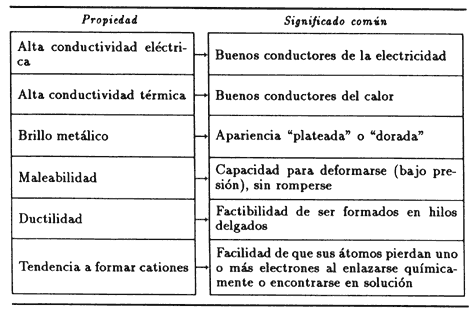 |
Aunque cada metal tiene características propias, hay un conjunto de propiedades que los definen, como se muestra en el cuadro III.2.
La mayoría de los metales son sólidos, con relativamente alta densidad y altas temperaturas de fusión y ebullición. Sin embargo, la variedad de estas propiedades es enorme. Sabemos, por ejemplo, que el mercurio y el galio son líquidos (en condiciones ambientales).
De los sólidos, dos metales tienen la menor y mayor densidad: el litio y el
osmio, respectivamente.
|
¿Por qué los cables conductores de corriente eléctrica
se hacen de cobre?
|
Los mejores metales conductores de electricidad son los de la familia 11: plata, cobre y oro, en ese orden, seguidos por el aluminio y el magnesio. En general, la conducción del calor es mayor en los metales que conducen mejor la corriente eléctrica.
En las figuras III.3 y III.4 se grafican la densidad y los puntos de fusión
de algunos metales; en estas propiedades se observa un comportamiento periódico.
Los metales menos densos resultan también, en general, los que se funden a menor
temperatura.
|
densidad= masa / volumen
|
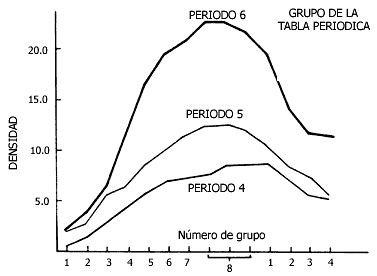
Figura III.3. Densidades de los metales de los periodos cuarto, quinto y sexto.
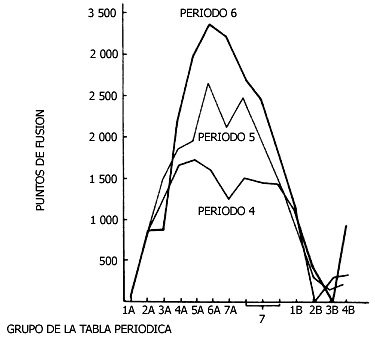
Figura III.4. Puntos de fusión de los metales de los periodos cuarto, quinto
y sexto.
Como hemos visto, es raro encontrar metales libres en la corteza terrestre. Más bien se encuentran en forma de óxidos, sulfuros, cloruros, fosfatos, carbonatos, etcétera.
Es tarea de la química obtener los metales a partir de los minerales en los que se encuentran; esta labor, así como la de preparar los metales para su uso, se conoce como metalurgia.
Durante la Colonia, la metalurgia en la Nueva España fue importante. Bartolomé
de Medina desarrolló en 1555, en Padierna, el proceso de recuperación de la
plata por amalgamación con mercurio, lo que ha sido llamado por Bargalló como
"el mejor legado de Hispanoamérica a la metalurgia universal". En México, y
también en esta disciplina, Manuel Andrés del Río descubre en 1801 el eritronio,
un nuevo elemento metálico, que fue redescubierto en 1830 por Stefenson y bautizado
como vanadio.
|
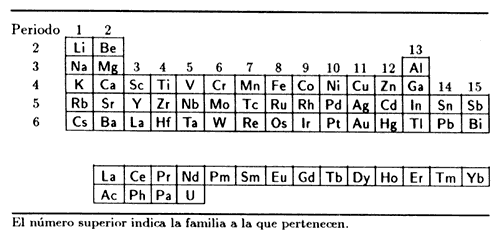
CUADRO III.3. Ubicación de los metales en la tabla periódica,
incluyendo las tierras raras (de lantano, La, a yterbio,Yb) y los actínidos
naturales ( de actinio, Ac, a uranio, U)
|
 |
En sus minerales, los metales se encuentran oxidados. Este término no se refiere
exclusivamente a la presencia de oxígeno en las menas, aquí se emplea en su
acepción más general. Nos referimos a que los átomos metálicos han perdido electrones
al combinarse con otros átomos. Así, por ejemplo, en el óxido de hierro, FeO,
el hierro existe como Fe2+, es decir, como un átomo de hierro que
ha perdido dos electrones, como un catión (Cuadro III.4).
|
CUADRO III.4 Algunos tipos de mena
|
|
|
|
|
|
Tipo de mena
|
Algunos ejemplos
|
|
|
|
|
Nativos
|
Cu,Ag, Au, Pt
|
|
Óxidos
|
FeO, Fe2O3, Al2O3,
SnO2, ZnO
|
|
Carbonatos
|
MgCO3, PbCO3, ZnCO3
|
|
Sulfuros
|
Ag2S, Cu2S, HgS, NiS, ZnS
|
|
Halogenuros
|
NaCl, KCl, MgCl2
|
|
Sulfatos
|
CuSO4, CaSO4, PbSO4
|
|
Fosfatos
|
LaPO4
|
|
|
|
Para extraer el hierro como metal es necesario reintegrarle los electrones que ha perdido al estar combinado con oxígeno, azufre u otro anión.
Este es el paso crucial de la metalurgia, llamado reducción del metal.
La reducción es el proceso inverso a la oxidación. Al oxidarse, un metal pierde
electrones, al reducirse, vuelve a ganarlos.
| México es el primer productor de plata en el mundo |
| CUADRO III.5 Valor de la producción
minero-metalúrgica de México (metálicos en 1980. SEPARFÍN) |
||
| |
||
| Producto |
Millones de pesos |
( % ) |
| |
||
| Plata |
22 498 |
48.18 |
| Cobre |
8 670 |
18.57 |
| Zinc |
4 242 |
9.09 |
| Plomo |
3 231 |
6.92 |
| Hierro |
3 159 |
6.77 |
| Oro |
2 826 |
6.05 |
| Otros |
2 063 |
4.42 |
| Total |
46 693 |
100.00 |
| |
||
|
CUADRO III.6 Valor de la exportación minero-metalúrgica de México
en 1980 (Instituto Mexicano de Comercio Exterior) |
||
| |
||
| Producto |
Millones de pesos |
( % ) |
| |
||
| Plata |
15 477 |
61.66 |
| Cobre |
4 844 |
19.30 |
| Zinc |
2 462 |
9.81 |
| Plomo |
1 475 |
5.88 |
| Otros |
841 |
3.35 |
| Total |
25 100 |
100.00 |
| |
||
|
Municipios "superproductores": Guanajuato, Gto.;
Cananea, Son.; Taxco, Gro.; Fresnillo, Gro.; Fresnillo, Zac.; Saucillo,
Chih.; Pachica, Hgo.
|
Existen otros procesos metalúrgicos cuyo carácter no es químico sino más bien físico. Podríamos mencionar tres operaciones metalúrgicas bien definidas:
1. Tratamiento preliminar, donde se desea concentrar algún componente de la mena, se excluyen impurezas y se prepara el mineral para su tratamiento posterior.
2. Reducción, en el que el compuesto metálico se reduce para obtener el metal libre.
3. Refinado, donde el metal es purificado. En algunos casos, en esta fase se añaden ciertas sustancias para dar al metal propiedades específicas.
En los siguientes apartados ejemplificaremos estos procesos representativos.
Sodio: un metal de la familia 1
Los metales del grupo 1, llamados metales alcalinos, constituyen la familia más reactiva. Por tal motivo no existen libres en la naturaleza. Sus propiedades más notables son:
· Tienen una enorme tendencia a perder un electrón (oxidarse) cuando se combinan químicamente. Por ello, existen generalmente como iones unipositivos:
· Desarrollan una fuerte reacción con el agua, formando hidróxidos:
· Son ligeros y maleables, pueden cortarse con un cuchillo.
· Sus sales son casi siempre solubles en agua y conducen la corriente eléctrica.
· Se obtienen por electrólisis de sus sales fundidas. Pero ¿qué es la electrólisis? En este caso, es la forma en que logra reducirse el Na+ a Na elemental: el paso de corriente eléctrica a través del cloruro de sodio, NaCI, fundido, logra que se reponga el electrón que el sodio había perdido al combinarse con el cloro.
Aun en la sal fundida, el cloro existe como anión, CI-, y el sodio como catión, Na+. El electrodo negativo (cátodo), rico en electrones, aporta uno a cada ion sodio
En tanto, en el electrodo positivo (ánodo), los cloruros pierden sus electrones, transformándose en cloro elemental:
Así, gracias a la electrólisis pueden elaborarse dos elementos mediante un
mismo proceso (véase Figura III.5).
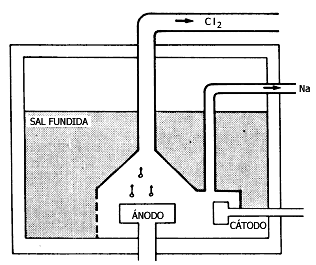
Figura III.5. Diafragma de una celda de producción de sodio y cloro.
El sodio se emplea fundamentalmente como componente de la sosa cáustica o hidróxido de sodio, NaOH, cuyos usos más importantes son:
· Manufactura de productos químicos
· Tratamiento de alúmina (Al2O3)
La industria que utiliza el proceso electrolítico mencionado se denomina industria
cloro-álcali. La más importante en México es "Cloro de Tehuantepec", que experimenta
un rápido crecimiento, como se advierte en las gráficas de la figura III.6.
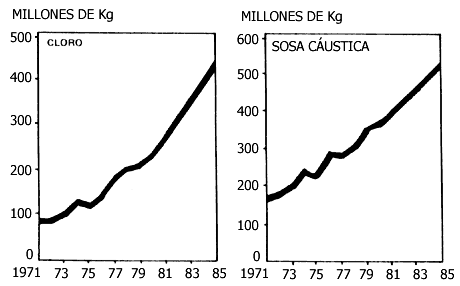
Figura III.6. Producción y tendencia de la industria cloro-álcali
mexicana.
· Son muy reactivos, pero no tanto como los alcalinos.
· Al igual que el sodio, se obtienen por electrólisis de sus sales fundidas.
· Son divalentes y existen, más o menos bien definidos, como iones bipositivos en sus compuestos:
· Reaccionan también con agua formando hidróxidos:
· Sus sales son menos solubles en agua que las de los metales alcalinos, aunque también conducen la corriente eléctrica. Son responsables de la "dureza" del agua, que deteriora las calderas y hace que el jabón no espume.
Usos y origen del calcio
· Se le emplea en metalurgia para desoxidar, descarbonizar y eliminar el nitrógeno de la fundición.
· Para el tratamiento de agua potable.
· Para el control de contaminación.
· Para preparar aleaciones (con el cerio, para piedras de encendedor, y con plomo, para placas de acumuladores).
Se presenta en la naturaleza como:
1) Piedra caliza (CaCO3 con impurezas), ampliamente empleada en la elaboración de productos químicos. Al calentarse se descompone:
Esta reacción es una importante fuente industrial de bióxido de carbono. Los yacimientos más importantes en México son los de Huescalapa, Jal., Tolteca, Hgo. y Apasco, México.
2) Calcita o espato de Islandia (CaCO3 cristalino y puro). Se obtiene de yacimientos en los estados de Chihuahua, Sonora, Sinaloa y Durango.
3) Yeso (principalmente sulfato de calcio, CaSO4), de amplio uso en la industria de la construcción.
Metales de transición
Los metales de transición forman las familias 3 a 12 de la tabla periódica. Comparten un gran conjunto de propiedades físicas y químicas, y por ello se les agrupa bajo la misma denominación.
El hierro y el cobre son, seguramente, los más conocidos. La mayoría son densos y con altos puntos de ebullición y fusión. Su química es de un enorme interés teórico-práctico, y es tan extensa que lo que aquí diremos puede considerarse como "la primera palabra de una enciclopedia de diez tomos".
En general, en sus compuestos se presentan como cationes con cargas +2 y +3, aunque en la familia 11 existen también como iones monocargados:
Al igual que los metales alcalinos y alcalinotérreos, muchos metales de transición liberan el hidrógeno del agua, pero no lo hacen con tanta facilidad. Hay dos grupos que no lo logran: los metales de la familia 11 (Cu, Ag, Au) y los llamados metales nobles (Ru, Rh, Pd, Os, Ir, Pt), que en general presentan poca reactividad.
Veamos cómo se obtiene uno de los metales de transición más conocidos, el hierro. A partir del año 1300 el hierro se obtiene en los llamados "altos hornos". Ello significa que antes de que la química naciera como ciencia, el hombre ya sabía reducir (con carbón) el hierro de sus minerales para convertirlo en hierro metálico. Y también sabía que el mismo carbón que actuaba como elemento reductor le confería al hierro una gran dureza (acero).
Ante todo el mineral se concentra en óxido de hierro (tratamiento preliminar), aprovechando sus propiedades magnéticas. Para ello se utiliza un imán, que atrae el óxido de hierro y no a otros compuestos que lo acompañan.
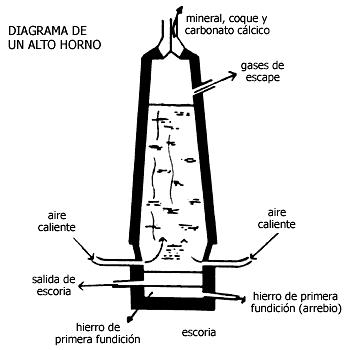
Figura III.7. Diagrama de una alto horno
Dentro de los altos hornos se producen dos reacciones fundamentales:
En esta última reacción, el óxido de hierro se reduce (pues pierde oxígeno) y el monóxido de carbono se oxida (ya que lo gana).
Como el mineral contiene muchas impurezas arenosas de sílica (dióxido de silicio, SiO2), que se funden a temperaturas muy elevadas, se acostumbra añadir piedra caliza (CaCO3) al mineral de entrada. Con ello se logra convertir la sílica en un silicato, al cual se le llama escoria, que en el horno se licua, con facilidad:
El hierro que sale del alto horno aún contiene 4% de carbón.
Como los mejores aceros son aquellos que poseen entre 0.15 y 0.85% de carbón,
el hierro debe recibir un tratamiento posterior (refinado) por medio del cual
se reduce su contenido de carbón al quemarlo en presencia de oxígeno.
|
||||||||
Adicionando al hierro otros metales como níquel, cromo o cobalto, se obtiene una aleación muy resistente a la corrosión, llamada acero inoxidable.
Tal vez la tecnología mexicana mas conocida en el extranjero sea la que desarrolló la compañía "Hojalata y Lámina" (HYLSA), de Monterrey, respecto al llamado "hierro esponja". En 1957, un efecto de la guerra de Corea fue la elevación de los precios de la chatarra. HYLSA, que producía acero plano a partir de chatarra, hubo de iniciar un programa de investigación cuyo resultado fue el proceso de reducción directa del mineral de hierro; una tecnología tercermundista de primera línea.
Treinta años más tarde, cuando la producción mundial de hierro alcanza los 1 000 millones de toneladas, la tecnología de HYLSA es líder en la obtención de hierro por reducción directa.
La industria del hierro es de gran importancia en México. En 1976 arrancó la primera etapa de la Siderúrgica Lázaro Cárdenas, en Michoacán, que actualmente produce más de un millón de toneladas de acero al año. Su construcción concluirá hacia el año 2000, con una capacidad para procesar anualmente unos 10 millones de toneladas de acero.

Figura III.8. Proceso H y L 1, planta con capacidad de 2.1 millones de toneladas
anuales en la siderúrgica de Orinoco (Sydor 2). Puerto Ordaz, Venezuela.
El aluminio: metal del futuro
La mena principal del aluminio es la bauxita, un óxido hidratado de aluminio:
AI2O3 x H2O.
|
El aluminio es el metal más abundante en la corteza
terrestre
|
La bauxita recibe un tratamiento previo para eliminar impurezas de hierro y se reduce electrometalúrgicamente, como los metales alcalinotérreos.
Aunque no es tan buen conductor como el cobre, el aluminio compite actualmente
con él en la industria eléctrica, debido a su menor costo. También ha desplazado
a otros metales en la fabricación de utensilios de cocina y en las industrias
de la construcción y del transporte.
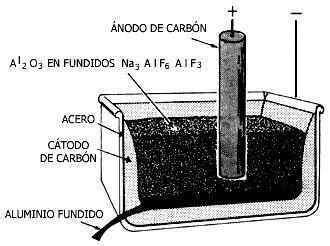
Figura III.9. Celda para obtener aluminio
Recientemente se ha descubierto que puede ser un temible tóxico. El aluminio penetra en el cuerpo humano de diferentes formas, pero particularmente por vía pulmonar, ya que el aire que respiramos está cargado de polvillo microscópico. Normalmente se excreta por vía urinaria. En caso de absorción importante y prolongada, el aluminio se concentra en diversos órganos: hígado, corazón, cerebro y médula ósea. Su acumulación puede dar lugar a diversos trastornos.
El plomo, Pb, es un metal de la familia 14. Este grupo de metales está poco extendido en la naturaleza, de ahí que resulte importante no malgastarlos, pues están en peligro de dejar de ser aprovechables. El plomo se encuentra principalmente como sulfuro, en un mineral llamado galena.
El tratamiento preliminar que recibe la galena para concentrarla en plomo se conoce como flotación. En este procedimiento, el mineral, finamente molido, se mezcla con ciertos aceites y agua. El mineral de plomo se moja por el aceite, y las impurezas (conocidas con el nombre de ganga), por el agua. La agitación con aire produce un sobrenadante que flota y que contiene, en su mayoría, el mineral de plomo mojado en aceite. Parte del mineral concentrado se somete a tostación con aire. Como resultado, ocurren las reacciones:
El óxido de plomo y el sulfato vuelven a mezclarse con la galena y se reducen con carbón en un horno, en el que se producen otras reacciones:
El plomo obtenido se somete entonces a refinado.
Los usos del plomo son varios: en baterías eléctricas, en cañerías y soldaduras,
como protector de radiaciones, y se agrega a las gasolinas, como antidetonante,
en forma de tetraetilo de plomo.6![[Nota 6]](../imgs/mcommnt.gif) Su inhalación prolongada provoca una enfermedad llamada saturnismo y contribuye
a la contaminación ambiental.
Su inhalación prolongada provoca una enfermedad llamada saturnismo y contribuye
a la contaminación ambiental.
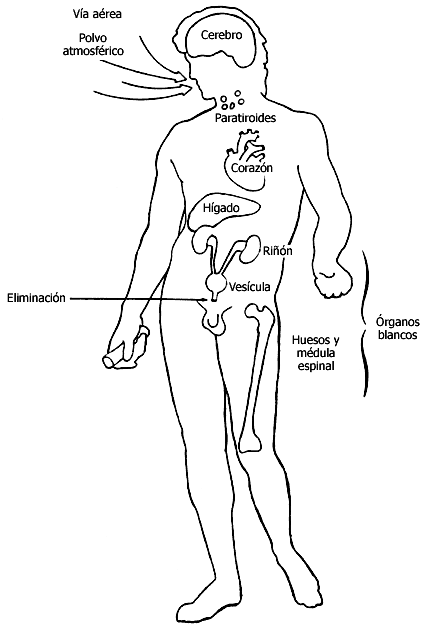
Figura III.10. Órganos en los que se concentra el aluminio.
Los metales conforman la mayoría de los elementos químicos. Aquí hemos dado una breve reseña de sus procesos de obtención y propiedades, pero creemos que basta para entender su enorme importancia industrial y tecnológica. Por ello es que la química y la ingeniería metalúrgicas constituyen profesiones de gran trascendencia y futuro. Con esto termina nuestro paseo por la litosfera.
Aguilar, G., El hombre y los materiales, colección "La Ciencia para todos ", 69, FCE, México, 1988.
"Alto horno o reducción directa", Investigación científica y Tecnológica 35 y 36, 28 (diciembre de 1980).
Bargalló, M., Tratado de química inorgánica, Porrúa, México, 1962.
Celada, J., "La fusión del fierro esponja", Ciencia y Desarrollo 27, 110 (julio-agosto de 1979).
Consejo de Recursos Minerales, Anuario estadístico de la minería mexicana, 1980, México, 1981.
Consejo de Recursos Naturales no Renovables, Los recursos minerales de México. vol. 1. Metálicos, México, 1969.
Choppin, G. R., y B. Jaffé, Química, ciencia de la materia, la energía y el cambio, Publicaciones Culturales, México, 1967.
"El aluminio reduce costos de fabricación en el sector eléctrico", Investigación Científica y Tecnológica 32, 18 (octubre de 1980).
"Ferroducto, otra posibilidad", Investigación Científica y Tecnológica 43,12 (abril de 1981).
Galle, P., "La toxicidad del aluminio", Mundo Científico 6, 856 (1986).
"Integración del sector siderúrgico paraestatal", Investigación Científica y Tecnológica 28,12 (agosto de 1980).
"Investigación metalúrgica vinculada a necesidades industriales", Investigación Científica y Tecnológica 17, 15 (marzo de 1980).
Lugo, J., La superficie de la Tierra. Un vistazo a un mundo cambiante, colección "La Ciencia para todos", 54, FCE, México, 1988.
Petrucci, R. H., Química general, Fondo Educativo Interamericano, Bogotá, 1977.
Rangel, C. E., Los materiales de la civilización, colección "La Ciencia para todos", 29, FCE, México, 1987.
"La siderurgia en México", Información Científica y Tecnológica 8 (1986).