II. LA ESTRUCTURA DEL ÁTOMO
EL ATOMISMO
DESDE hace muchos siglos el hombre sospechó que el
mundo físico se hallaba formado por partículas invisibles al ojo humano y, según
consideraron algunos pensadores de la antigua Grecia, indivisibles. Debido a
esta última cualidad esas partículas recibieron el nombre de átomos, término
griego que significa "lo que no se puede dividir".
Atomismo, en sentido amplio, es cualquiera doctrina que explique los fenómenos naturales tomando como base la existencia de partículas indivisibles. Por el contrario, las teorías denominadas holísticas explican las partes por referencia al todo.
La teoría atomista fue desarrollada en el siglo V por Leucipo de
Mileto y su discípulo Demócrito de Abdera. Demócrito aseguraba
que todo se compone exclusivamente de átomos y vacío.
El filósofo ateniense Epicuro (siglos IV-III a. C.) y el poeta latino
Lucrecio, dos siglos después, asignaron a los átomos la propiedad
del peso y postularon la división del átomo en partes mínimas.
La doctrina atomista tuvo escasa repercusión en la Edad Media debido a la preminencia de las ideas holísticas de Platón y Aristóteles.
Ya en el siglo XIX, el químico inglés John Dalton estableció la denominadas leyes estequiométricas (relativas a las proporciones y relaciones cuantitativas que rigen las reacciones químicas) y aseguró que estas incluían la relación de números enteros simples en las reacciones químicas. También en esa época Robert Boyle y Edmé Mariotte habían enunciado las leyes de los gases referentes a las relaciones entre el volumen y la presión. El hecho de que los gases pudieran comprimirse hasta límites máximos al aumentar la presión indicaba que sus constituyentes se hallaban separados por grandes distancias y dejaban huecos entre ellos. Es decir que la materia, aun siendo sometida a grandes presiones, no era continua. Todos estos fenómenos sólo hallaban explicación en la teoría atómica.
A fines del siglo XIX las condiciones estaban ya dispuestas y se
empezaron a abrir las puertas para escudriñar la estructura del
átomo. Y fue el corpúsculo ahora denominado electrón el primero
de los constituyentes atómicos que pudo ser identificado por J.J.
Thomson en 1897.
Joseph John Thomson nació el 18 de diciembre de 1856 en Cheetam Hiel, cerca de Manchester, Inglaterra. Hijo de un vendedor de libros, fue de niño lector insaciable y magnífico estudiante. A los 20 anos, el joven ingeniero Thomson obtuvo una beca para estudiar física y matemáticas en la Universidad de Cambridge y, acogido por el Trinity College, se inició cómo estudiante y llegó a ser, años más tarde, el director. Lord Raleigh (1842-1919), que era director de los famosos laboratorios Cavendish de la Universidad de Cambridge, designó como su sucesor, en 1884, a Thomson, quien demostraría con creces y a lo largo de 35 años lo atinado de la elección, pues contribuyó a desarrollar uno de los mayores laboratorios de investigación que atrajo a científicos de todo el mundo. Allí conocería a quien fue desde 1890, su esposa: Rose Elizabeth Paget, hija de sir George y lady Paget. Rose y Joseph serían a su vez padres del laureado Nobel de 1937 en física: Georges Paget Thomson.
En la década de los años ochenta del siglo XIX, la teoría atómica
aseguraba que los átomos eran torbellinos de éter, una
substancia sin peso que se consideraba difundida por todo el
espacio.
Ya se ha mencionado en el capítulo I que el inglés Crookes descubrió los rayos catódicos en 1869 y que desde entonces muchos investigadores se dieron a la tarea de hallar las propiedades de esos rayos. En el año de 1895 Jean Perrin, en París, descubrió que los rayos catódicos eran partículas cargadas negativamente y los experimentos que realizó enseguida. J. J. Thomson permitieron determinar su velocidad y medir el cociente de su carga y su masa.
J.J., como le decían cariñosamente sus amigos, realizó sus experimentos con un tubo de descarga al que le habían eliminado el aire del interior, tal como el que se describe en seguida (véase la figura II.1). Los rayos catódicos originados en el electrodo de la izquierda y limitados a un fino haz por los agujeros de los diafragmas D, atraviesan dos placas paralelas de metal y el campo magnético de dos solenoides exteriores hasta llegar a una pantalla fluorescente. Si las placas y los solenoides están descargados, el haz pasa recto y choca en el punto S de la pantalla.
Cuando las placas metálicas están conectadas a una fuente de alto voltaje, el haz de partículas negativas se desvía hacia abajo debido a la carga positiva de la placa inferior (véase la figura II.1) y entonces el haz incide en el punto N, siguiendo una trayectoria parabólica (véase la figura II.2(a)). Por el contrario, cuando se aplica solamente el campo magnético de manera que las líneas magnéticas sean perpendiculares al plano de la página, el haz se curva hacia arriba y llega al punto M. Esto se debe a que en un campo magnético uniforme los electrones siguen una trayectoria circular (véase la figura 11.2(b)) J.J. se dio cuenta de que al aplicar el campo magnético y el eléctrico al mismo tiempo las reflexiones podían compensarse y, al cumplirse esa condición, midió el campo eléctrico y la inducción magnética aplicados. El cociente de esos valores resultó ser la velocidad del haz de los rayos catódicos, que es de varios miles de kilómetros por segundo. Este valor depende del voltaje aplicado entre el ánodo y el cátodo.
Thomson se apoyó en esos resultados para continuar sus investigaciones y encontró
que el cociente carga/masa (e/m) de los corpúsculos que integraban los rayos
catódicos, ahora denominados electrones, era directamente proporcional a la
velocidad e inversamente proporcional a la intensidad del campo magnético aplicado
y a la distancia r (véase la figura II.2(b)), teniendo en cuenta que sólo se
aplique ese campo magnético y el haz se desvíe hacia arriba.
Figura II.1. Diagrama de un tubo de descarga empleado por J.J. para medir la velocidad de los rayos catódicos.
El valor de e/m es de ¡175 000 000 000 de culombios por kilogramo! Un valor tan grande significa que la masa de una partícula de rayos catódicos es muy pequeña comparada con la carga en culombios que lleva.
Algunos años después, en 1906, el físico norteamericano Robert Andrews Millikan (1868-1953) encontró el valor de la carga de un electrón. Para escribir esa cifra es necesario colocar 18 ceros a la derecha del punto decimal y luego el número 16, culombios. La masa del electrón pudo calcularse entonces con los resultados de Thomson y Millikan, y para escribir la cifra de su valor se requieren treinta ceros a la derecha del punto decimal y luego el número 9, kilogramo. Estamos hablando de partículas realmente pequeñísimas.
El primer modelo que trató de explicar la constitución del átomo fue el de J. J. Thomson, quien propuso la existencia de una esfera de carga positiva, distribuida en el volumen del átomo, cuyo diámetro es de aproximadamente una diezmillonésima de micra y supuso que partículas con cargas negativas, los electrones, estaban dispersas de alguna forma ordenada en esta esfera.
Thomson fue galardonado con el premio Nobel en 1906 y Millikan en 1923. Cabe aquí señalar que de entre los estudiantes e investigadores de la Universidad de Cambridge varios fueron galardonados con el Nobel además de J. J. Thomson: lord Rayleigh en 1904, Rutherford en 1908, Bragg padre e hijo en 1915, Bohr en 1922, A. H. Compton y C. T. R. Wilson en 1927, P. A. M. Dirac en 1933, J. Chadwick en 1935, G. P. Thomson en 1937, P. M. Blakett en 1948, J. D. Cockcroft y E. T. S. Walton en 1951, y M. Born en 1954.
J.J. Thomson murió el 30 de agosto de 1940 y fue sepultado en la abadía de Westminster, cerca de los restos de Newton, Kelvin, Darwin y Rutherford.
Pero vamos a regresar a la época de fines del siglo XIX y principios
del XX en Cambridge, donde tuvieron lugar otros muchos
descubrimientos de gran importancia.
![[FNT 8]](../img/pio042a.gif)
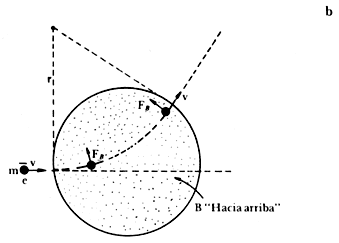
Figura II.2. Comportamiento de los electrones. (a). En un campo eléctrico uniforme describen una trayectoria parabólica. (b). En un campo magnético uniforme, su trayectoria es circular.
La soberanía de la Corona británica sobre Nueva Zelanda se inició en 1840. El archipiélago, situado al sureste de Australia, vivía en esa época momentos de gran inestabilidad y quizá por eso el gobierno inglés apoyó el ingreso de sus colonos en aquel país. El escocés George Rutherford y su familia se trasladaron allá en 1842 y se establecieron en la Isla del Sur; que brindaba entonces un desarrollo económico favorable. James, hijo de George creció ya en Nueva Zelanda y casó con Caroline Thompson. La pareja se estableció en un pueblo de Nelson. James era campesino y Caroline maestra de escuela. Ernest, el segundo de sus doce hijos, nació en el 30 de agosto de 1871,y desde pequeño se distinguió por su inteligencia excepcional, lo que impulsó a su familia a sostener sus estudios aun a costa de grandes sacrificios.
Cuando Ernest tenía 15 años ganó una beca al lograr 580 aciertos de un total de 600 preguntas y el premio le permitió asistir al Colegio Nelson, donde fue siempre el primero, no sólo en matemáticas, física y química, si no también en latín, literatura inglesa, francés e historia. En 1889 ganó otra beca para el Colegio Canterbury que en ese tiempo era una institución pequeña con aproximadamente siete profesores y 150 estudiantes.
Rutherford asistió al Colegio Canterbury de 1890 a 1894, se graduó a los 21 años y al siguiente año obtuvo el grado de Master in Arts, First class honours en matemáticas y en física; este doble éxito había ocurrido solamente una vez en la historia de la Universidad. Sus profesores fueron: de matemáticas, C. H. Cook y de física, A. Bickerton.
En 1894, Rutherford inició su sorprendente carrera experimental en la Universidad de Canterbury. Fabricó su primer detector magnético a control remoto y pudo mandar y recibir señales a lo largo de su laboratorio. Igual que muchos científicos, fabricaba sus propios aparatos, sencillos pero ingeniosos, pues aseguraba que se invertía más tiempo en el mantenimiento de equipos complicados que en la obtención de resultados. Decía también que siendo una persona sencilla, sus ideas básicas en física serían simples.
Rutherford obtuvo una beca como estudiante universitario distinguido de la Comunidad Británica de Naciones y así logró ser el primer becario de ultramar que se matriculó en la Universidad de Cambridge, Inglaterra, en 1895. Desde entonces fue miembro del Trinity College. Ernest casó en 1900 con Mary Newton, de Cristchurch. Al año siguiente, nació su única hija, Eileen.
En el Laboratorio Cavendish de la Universidad de Cambridge, Rutherford continuó su trabajo sobre la detección de ondas electromagnéticas de radio. Aumentó gradualmente el límite de la transmisión, y en 1896 pudo mandar señales a media milla de distancia. Nadie había podido mandar señales tan lejos. En ese mismo año publicó un artículo titulado "Un detector magnético de ondas eléctricas." Posteriormente J.J. Thomson lo invitó a unírsele para estudiar el efecto de los rayos X sobre los gases.
La vida profesional de Rutherford puede ubicarse en cuatro periodos: el primero, de 1895 a 1898 en el Laboratorio Cavendish de Cambridge: el segundo, de 1898 a 1907 en la Universidad de McGill en Montreal: el tercero, de 1907 a 1919, en la Universidad de Manchester y el cuarto, de 1919 a 1937, en Cambridge, cuando fue llamado a sustituir a Thomson en el Laboratorio Cavendish como profesor de física experimental. En cada una de estas etapas Rutherford participó decisivamente en el desarrollo del conocimiento: estuvo siempre en el candelero de la ciencia tal como el mismo aseguraba, en el candelero que el había construido. Era un profesor que sabía transmitir a sus discípulos su entusiasmo por la investigación científica. Disfruto de muchas preseas bien merecidas, sean mencionadas el premio Nobel de química en 1908 por sus investigaciones sobre "La desintegración de los elementos y la radiactiva" , y el título de barón que le fue otorgado en 1931. Él mismo escogió el título de lord Rutherford de Nelson, por el cariño que le tenía a su tierra natal.
En el número de agosto de 1937 de la revista Nature, Rutherford publicó su último artículo que versó sobre el tritio. Utilizando el método de electrólisis trató de enriquecer agua con los átomos pesados del hidrógeno e intentó detectarlos mediante la técnica de la espectrometría de las masas. Ahora sabemos que para haber detectado tritio de esa manera Rutherford tenía que haber enriquecido el agua un millón de veces con tritio, porque se trata de un isótopo muy poco abundante. El tritio se conocía desde 1934, había sido descubierto por M. L. E. Oliphant, P. Harteck y el mismo Rutherford.
Rutherford murió en Londres el 19 de Octubre de 1937. Algunas de sus últimas palabras sirvieron para indicar a su esposa que deseaba heredar 100 libras esterlinas al Colegio Nelson.
LAS RADIACIONES ALFA, BETA Y GAMMA
En 1900 Rutherford estudió las propiedades de un gas emitido por el torio, al que llamó emanación del torio; además descubrió que las sustancias radiactivas se estaban desintegrando continuamente. En enero de 1900, en la revista Philosophical Magazine, Rutherford publicó una comunicación acerca de una sustancia radiactiva emitida por compuestos de torio. Uno de los experimentos que describía consistía en lo siguiente (véase la figura II.3):
Se pasó una corriente de aire sobre una capa gruesa
de óxido de torio encerrado en un recipiente de papel A, dentro de un
tubo largo de metal B. A, continuación el aire pasó a un gran recipiente
cilíndrico aislado, C, del cual fluyo finalmente, al través de una placa
con agujeros finos. El electrodo de metal aislado, D, está conectado
a un par de cuadrantes de un electrómetro Kelvin [un electrómetro
es un instrumento electrónico para medir bajas diferencias de potencial
y corrientes, extrayendo muy poca corriente del circuito]. Después
de dejar fluir el aire cierto tiempo, se interrumpió su paso y se midió
la corriente de ionización entre C y E, durante 10 minutos. |
Los resultados se ilustran en la curva A de la figura II.4. Posteriormente Rutherford colocó el óxido de torio en una caja de papel, entre dos cilindros de metal aislados y concéntricos, a lo largo de los cuales pasó una corriente de aire a fin de separar la emanación a medida que se formara (figura II.3). Al cesar el flujo de aire y medir la corriente de ionización entre los dos cilindros se obtuvieron los resultados representados en la curva B de la figura II.4. se puede observar que la suma de A + B en la figura II.4 es constante en todo tiempo, t. Esto indica que, en equilibrio, la emanación se produce con la misma rapidez con que desaparece.
Figura II.3. aparato de Rutherford para demostrar la desintegración de la emanación torón. A: óxido de torio. B: tubo metálico. C: recipiente para captar el torón. D: electrodo metálico. K: electrómetro Kelvin.
Figura II.4. Curvas de desintegración (A) y crecimiento (B) del torón.
Ernest Rutherford y Frederick Soddy (1877-1956), este último merecedor del Nobel de química en 1921, establecieron las relaciones mutuas de muchos elementos radiactivos naturales y también que la ley de disminución de la radiactividad es exponencial, es decir, que durante un intervalo de tiempo la variación promedio de radiactividad es proporcional a la actividad inicial (véase la gráfica de la vida media en la figura I.3 del capítulo I).
Aunque a Becquerel y a los esposos Curie se debe el mérito del descubrimiento de la radiactividad y de los elementos polonio y radio, en las cuatro décadas siguientes este campo estuvo dominado por Rutherford y sus colaboradores. Hacia 1904 se habían descubierto unos 20 elementos radiactivos, gracias a una serie de investigaciones brillantes e ingeniosas de Rutherford, a menudo en colaboración con Soddy. También fue una accidente feliz, en este aspecto, que P. Curie descubriera una emanación del torio, y que estos investigadores pudieran llegar a la conclusión de que tales emanaciones eran gases nobles, a saber, radón y torón, este último identificado posteriormente como un isótopo del radón.
Rutherford y Soddy publicaron algunos artículos sobre la causa y la naturaleza de la radiactividad y el cambio radiactivo. En el número de noviembre de 1902 de la revista Philosophical Magazine dijeron:
La interpretación de los experimentos arriba mencionados tiene que ser, por consiguiente, que la emanación es un gas químicamente inerte, de naturaleza análoga a los miembros de la familia del argón. En la misma comunicación hacen especulaciones acerca de la asociación del helio con la radiactividad, y en su conclusión dicen que la ley de la declinación con el tiempo aparece como la expresión de la ley simple del cambio químico, en la cual una sustancia solo se altera a velocidad proporcional a la cantidad de ella.
Rutherford encontró que el uranio emitía dos tipos de radiación diferentes por su poder de penetración. Estos eran los rayos alfa, que podían ser detenidos fácilmente por una hoja papel o en una trayectoria por el aire de unos cuantos centímetros y los rayos beta, que eran mucho más penetrantes y podían atravesar una capa de varios milímetros de aluminio. Ahora se sabe que el uranio mismo no emite radiación beta, sino la radiación alfa y que la radiación beta observada entonces provenía de algunos hijos radiactivos. En 1900; el francés Paul Urich Villard (1860-1934) halló que el radio emitía un tercer tipo de radiación mucho más penetrante, y los rayos de este tipo fueron llamados rayos gamma.
La identidad de los rayos alfa y gama eludió ser determinada durante varios años. Inicialmente se creyó que un campo electromagnético no ejercía influencia sobre los rayos alfa, pero en 1902 Rutherford mostró que estos rayos sí eran desviados por campos eléctricos y magnéticos poderosos, y que para un campo dado su desviación era mucho menor que la de los rayos beta y en dirección opuesta, lo que indicaba que esos rayos eran partículas cargadas positivamente. También en 1902, por la medición de la desviación de los rayos alfa del radio en campos eléctricos y magnéticos, Rutherford llegó a la conclusión de que esos rayos viajaba a la velocidad de 2 500 000 000 cm/seg y que su razón carga/masa era aproximadamente de 6 000 unidades atómicas de masa por gramo.
Quedó entonces establecido que las partículas alfa son idénticas al núcleo del elemento helio, que las beta son similares a los electrones extranucleares y que la radiación gamma la constituyen ondas electromagnéticas de la misma frecuencia o ligeramente mayor que la de los rayos X. Es importante, sin embargo, hacer notar aquí que tanto las radiaciones alfa como las beta y las gamma provienen de los núcleos atómicos.
En nuestro tiempo se conoce ya la naturaleza de los esquemas de desintegración gracias al esfuerzo notable de todos aquellos investigadores. Ahora, con los modernos detectores de radiactividad y los equipos electrónicos disponibles, entre ellos las computadoras, es muy fácil reproducir sus resultados.
En 1903 Rutherford calculó la enorme cantidad de energía que se libera en el decaimiento del radio. Mostró que la energía que interviene en la transformación de los átomos es mucho mayor que la que lo hace en la reacción química de los mismos átomos. En ese mismo año fue electo presidente de la Royal Society, el mismo puesto que ocupó Newton de 1703 a 1727.
En 1908, Rutherford y el físico alemán Geiger (1882-1945) encontraron un método para detectar las partículas subatómicas individuales y construyeron el primer contador de partículas, más tarde mejorado por Geiger. Este fue el famoso contador Geiger que aún se emplea.
Rutherford y Geiger detectaron y contaron las partículas por medio de su acción ionizante. Aunque este efecto era demasiado pequeño para medirlo directamente con los medios de que se disponía, era posible multiplicar el número de iones formado por cada partícula mediante la ionización por colisión. El dispositivo está representado en la figura II.5. La presión en el interior del tubo es de unos cuantos centímetros de mercurio. Si la partícula alfa atraviesa la ventana V se produce una pulsación de corriente y el electrómetro E indica una desviación, que desaparece rápidamente, porque la carga eléctrica se disipa a través de la resistencia R. La duración de la descarga es de aproximadamente 10-4s, pero la inercia del electrómetro de cuadrantes impedía poder contar más de tres a cinco partículas por minuto. Actualmente este método es uno de los más rápidos y con él se puede contar un millón de partículas por segundo.
En 1913 Geiger describió el contador puntiforme (figura II.6). El extremo de un alambre delgado termina en una punta fina P, en el interior del tubo hay aire seco a la presión atmosférica, y las partículas penetran al través de V. Geiger aplicó al tubo un voltaje de 1 000 a 2 000 volts y observó que si una partícula pasa al través de V se produce una descarga momentánea desde la punta, y el electrómetro registra una pulsación. El motivo de la inmediata interrupción de la descarga es el efecto de la carga espacial.
El contador Geiger-Müller fue ideado en 1928 (figura II.7). Está formado por un alambre delgado montado en el eje de un cilindro que contiene un gas a presión de 2 a 10 mm de mercurio. El funcionamiento de este tubo es análogo al del anterior, pero en lugar de una descarga puntiforme se obtiene una descarga de corona.
El funcionamiento de estos detectores de radiación se basa en que cuando un gas se encuentra encerrado en un recipiente y se le aplica una diferencia de potencial, se pueden recolectar en los electrodos correspondientes los electrones y los iones producidos por la radiación que lo atraviesa. Ambos electrodos deben estar separados por un material aislante y conectados a una fuente de voltaje que crea una diferencia de potencial.
En la figura II.8 puede observarse que las curvas que forman la gráfica del número de iones recolectados como una función del voltaje aplicado en los electrodos, dependen de la naturaleza de la radiación incidente: así, la curva de las partículas alfa se sitúa por encima de la que se obtiene con las beta. Esto se debe a que las partículas alfa son más ionizantes que las beta y provocan un mayor número de iones por unidad de longitud en su recorrido.
Figura II.5. Contador proporcional. V: ventana. E: electrómetro. R: resistencia.
Figura II.6. contador puntiforme. V: ventana.
Figura II.7. Contador Geiger-Müller.
Figura II.8. Variación del número de iones colectados en función del voltaje aplicado a un sistema de electrodos (1). Recombinación (2). Cámara de ionización (3). Contador proporcional (4). Región de proporcionalidad limitada (5). Geiger (6). Región de descarga continua.
El número de iones recolectados no es proporcional al voltaje aplicado, debido a que los iones creados por la radiación se comportan de manera diferente al aumentar el voltaje; esto origina la existencia de varias regiones en las curvas.
Cuando el voltaje que se aplica es muy bajo, la atracción que ejercen los electrodos sobre los iones formados es pequeña, por lo que una fracción de esos pares de iones tiende a recombinarse entre sí, sin permitir que se lleguen a recolectar. A medida que el voltaje aumenta, la fuerza de atracción crece hasta que se recolectan todos los iones formados en el detector. Esto es lo que sucede en la región conocida como de saturación, representada con el número 2 de la figura II.8. El dispositivo utilizado se denomina cámara de ionización, de allí que la región de saturación se denomine también región de la cámara de ionización. En esa región de voltaje se recolectan los llamados iones primarios, formados directamente por la interacción de la radiación con el gas.
Cuando el voltaje aumenta, esos iones primarios se aceleran de tal manera que pueden a su vez provocar ionizaciones. Los nuevos iones formados se denominan iones secundarios y al efecto se le denomina amplificación por el gas. En la región 3 de la figura II.8, el número de iones recolectados crece proporcionalmente según el voltaje aplicado, por lo que al detector que utiliza esa región de voltaje se le conoce como detector proporcional. En la misma región puede observarse que la inclinación de la curva para las partículas alfa es idéntica a las de las beta.
Parecería que el efecto de amplificación continuaría indefinidamente al aumentar el voltaje; sin embargo, se llega a un valor de voltaje tal que la atracción ejercida por los electrodos en los iones y electrones es tan fuerte que éstos son rápidamente absorbidos por el electrodo central, mientras que los iones positivos que se desplazan a velocidades menores permanecen aún en el detector y dan la impresión de que engrosan el diámetro del electrodo central. Con esto disminuye la intensidad de la fuerza de atracción y cambia la proporcionalidad entre el número de iones recolectados y el voltaje.
Cuando el voltaje se incrementa más todavía, el número de iones recolectados es independiente del tipo de radiación y del número de iones primarios formados, porque la atracción que crea el voltaje hace que los electrones se aceleren y por cada ionización se crean más iones secundarios, formándose así una reacción en cadena. Esta región, la número 5 de la figura II.8, la estudió Geiger con el tubo detector que lleva su nombre. Con voltajes todavía más altos, el tubo comienza a producir un gran numero de señales, aun cuando ninguna radiación lo atraviese, hasta llegar a hacerlo de manera continua; a esto se le llama "región de descarga continua del tubo" (región numero 6 de la figura II.8) y parece como si el detector estuviera contando las partículas cargadas.
En la práctica, un mismo tubo no puede utilizarse con cualquier voltaje, porque para cada región existen condiciones específicas. Desde el punto de vista del alambre central, los detectores Geiger y proporcional utilizan alambres más delgados que la cámara de ionización, para lograr voltajes más altos. En lo referente al gas de llenado, las cámaras de ionización pueden llenarse con aire, los contadores proporcionales, con metano, bióxido de carbono o una mezcla de argón y metano, y los Geiger, con una mezcla de gases tales como el argón o el neón y un compuesto orgánico (etanol) o un gas halógeno (cloro o bromo).
EL MODELO NUCLEAR DE RUTHERFORD
De 1909 a 1911 Rutherford, Geiger y Marsden hicieron experimentos sobre la dispersión de las partículas alfa en la materia. Esos experimentos proporcionaron información sobre la radiactividad natural de los elementos y se comprobó que el elemento radio emitía partículas en forma espontánea.
El aparato con el cual realizaron sus experimentos estaba integrado por una cámara al vacío que contenía en su interior una fuente del elemento radio, el cual emitía partículas alfa en todas direcciones. Dentro de la cámara se encontraba un bloque de plomo con un orificio central para colmar al haz de partículas alfa. El haz llegaba hasta una lámina de oro de media micra de espesor y al final de la cámara colocaron una pantalla de sulfuro de cinc (véase la figura II.9).
Rutherford y sus colaboradores observaron que la mayoría de las partículas
atravesaban la delgada lámina de oro y producían centellas en la pantalla de
sulfuro de cinc; pero también que algunas eran desviadas y otras, muy pocas,
eran repelidas totalmente por la lámina de oro.
Figura II.9. Aparato usado por E.Rutherford y sus colaboradores para estudiar la estructura del átomo.
Las observaciones anteriores y las consideraciones de que el oro no puede ser comprimido (lo cual hace suponer que sus átomos están acomodados regularmente) y de que las partículas alfa son cuatro veces más pesadas que el hidrógeno y manifiestan una carga de 2+, condujeron a Rutherford a las siguientes conclusiones: a) El núcleo es una parte pequeña central del átomo de oro y tiene carga positiva. b) El núcleo es tan pequeño que es muy poco frecuente que una partícula alfa choque con él o pase cerca y sea desviada. c) El núcleo tiene una masa mayor que las partículas alfa y es de carga positiva porque cuando una partícula alfa choca con él, ésta es repelida y entonces rebota. d) El átomo está casi vacío y los electrones están muy alejados del núcleo, ya que la mayoría de las partículas alfa atraviesan la lámina de oro y son pocas las que rebotan o se desvían. e) Los electrones son 1 836 veces menos pesados que el protón y las partículas alfa son núcleos de helio cuya masa es cuatro unidades mayor que la del protón, por lo tanto las partículas alfa no son desviadas por los electrones. f) La masa del átomo es la suma de sus constituyentes nucleares, ya que casi la totalidad de la masa de los átomos se encuentra en el núcleo.
Rutherford calculó que el tamaño del núcleo es aproximadamente 10-13 a 10-15 cm, por lo que es un millón de veces más pequeño que el átomo y la distancia que separa un núcleo de otro es del orden de 10-8 cm. Ésa es la razón por la que la mayoría de las partículas alfa podían atravesar la lámina de oro. Rutherford preparó una imagen nueva de la estructura del átomo. Sus cálculos matemáticos basados en esos experimentos revelaron al mundo científico una idea del tamaño del núcleo central y del espacio a su alrededor. En 1911, Rutherford propuso su modelo nuclear del átomo, que fue publicado en el Philosophical Magazine. Posteriormente Moseley y Bohr completaron las observaciones y trabajos de Rutherford y establecieron otros modelos tendientes a explicar la estructura del átomo.
En junio de 1920 Rutherford, en una conferencia ante la Royal Society, hizo una de sus más importantes predicciones: dijo que podría existir, en alguna parte del átomo, una partícula neutra, la cual, si se encontrara, sería mucho más útil como proyectil que las partículas alfa.
En 1930, W. Bothe y H. Becker observaron que algunos de los elementos más ligeros, como el litio y el berilio, emitían una radiación muy penetrante cuando eran bombardeados con partículas alfa procedentes de los elementos radiactivos naturales.
La publicación del 18 de enero de 1932 de Irène Curie y Frederic Joliot, en las Actas de la Academia de Ciencias (véase el capítulo III), interesó profundamente a James Chadwick, quien en 1919 había ingresado al Laboratorio Cavendish de Cambridge, donde Rutherford era el director. Rutherford, interesado en el tema al igual que Chadwick, pidió a éste que verificara las medidas de los Joliot, lo que realizó de inmediato gracias a las fuentes intensas de polonio que el mismo Chadwick acababa de preparar. La idea de la existencia de una partícula neutra, de masa igual a la del protón, flotaba en el ambiente del Laboratorio Cavendish desde que Rutherford había sugerido que una partícula así podía existir.
Después de algunos días de intenso trabajo Chadwick, al estudiar las características de las colisiones de la radiación desconocida con los protones y con otros núcleos ligeros, comprobó que se trataba de neutrones. Esto fue posible gracias a su sistema de detección, que consistía en una cámara de ionización conectada a un amplificador proporcional de válvulas, con el cual podía medir la energía de las radiaciones observadas. Este descubrimiento permitió a James Chadwick recibir el premio Nobel de física en 1935. El equipo utilizado en estos experimentos, muy moderno en esos días, no existía en el Instituto del Radio en Francia, razón por la cual los Joliot no se dieron cuenta de la existencia del neutrón. Sin embargo, puede decirse que el hallazgo del neutrón se dio como el fruto de las investigaciones llevadas a cabo sucesivamente en tres países diferentes: Alemania, Francia y Gran Bretaña y gracias a la comunicación existente entre los científicos de esa época. El descubrimiento del neutrón fue el inicio de la era nuclear.
Posteriormente, el interés se enfocó hacia la posibilidad de producir partículas
rápidas para bombardear núcleos y esto dio como resultado la fabricación de
los aceleradores de partículas. Entre los primeros se puede mencionar la máquina
de Bothe y Becquer en Alemania, la de Cockcroft-Walton en el Laboratorio Cavendish
de Cambridge, y el ciclotrón del norteamericano Lawrence.
Los experimentos realizados con esas máquinas fueron decisivos para la física nuclear. Aunque al principio la energía de los haces de protones obtenidos fue solamente de 400 000 a 500 000 volts, se pudo comprobar, por ejemplo, que los protones penetran en los átomos de litio, cuyo peso atómico es 7, para formar una sustancia de peso atómico 8, la cual se desintegra rápidamente en 2 átomos de helio, cada uno de peso atómico 4.
Todos los datos reunidos acerca de los estados fundamentales de los diferentes núcleos y de sus estados excitados, obtenido tanto mediante el estudio de los isótopos radiactivos como por las investigaciones acerca de las reacciones nucleares, han servido para la elaboración de los modelos nucleares. Estos generalmente tratan de explicar el máximo número de hechos con el mínimo de hipótesis acerca de la estructura nuclear y la interacción entre nucleones en el núcleo.
Prosigue en la actualidad el estudio de la estructura nuclear, gracias a los aceleradores de partículas de cada vez mayor rendimiento construidos en los últimos años, con el propósito de comprender mejor la interacción entre nucleones en el interior del núcleo y los fenómenos que suceden en la materia nuclear excitada por colisiones con iones pesados de diferentes energías. En fin, la estructura íntima del átomo sigue siendo un campo fértil para el estudio y un reto difícil de vencer.
M. Jiménez Reyes, "La medición de la radiación nuclear", Ciencia y Desarrollo, núm. 23, 67, 1978.
J. Paredes y L. A. Huerta, El núcleo y su desarrollo 1a. ed., Editorial Edicol, México, 1975.
Accolade Books, Enciclopedia Biográfica Universal, volumen III, Promociones Editoriales Mexicanas, México, 1982.
W. B. Mann y S. B. Garfinkel, Radiactividad y su medida, 1a. ed. en español, Editorial Reverté Mexicana, 1968.
P. Radvanyl y M. Bordry, La radiactividad artificial, Salvat Editores, España, 1987.
M. Villaronga Maicas, Atlas del átomo, 4a. ed., Ediciones Jover, Barcelona. 1974.
H. E. White, Introducción a la física atómica y nuclear, 1a. ed., Editorial Alhambra, España, 1970.
Diccionario de física, Colección Llave de la Ciencia, director, J. Daintith, Edinorma, Bogotá, 1984.
J. E. Greene, 100 grandes científicos, 10a. ed., Editorial Diana, México, 1981.
![[Inicio]](../img/begin.gif)
![[Anterior]](../img/prevsec.gif)

![[Siguiente]](../img/nextsec.gif)
![[FNT 7]](../img/pio040.gif)
![[FNT 9]](../img/pio046.gif)
![[FNT 10]](../img/pio047.gif)
![[FNT 11]](../img/pio051.gif)
![[FNT 12]](../img/pio052.gif)
![[FNT 13]](../img/pio053.gif)
![[FNT 14]](../img/pio054.gif)
![[FNT 15]](../img/pio057.gif)