II. RECONSTRUYENDO LA NATURALEZA: LA INGENIERÍA MOLECULAR
EL INTERÉS científico que despiertan los materiales laminares, como las arcillas, se debe principalmente a sus propiedades físico-químicas, las cuales son únicas entre los minerales naturales. Asimismo, sus aplicaciones, tan diversas, provienen de ese mismo conjunto de propiedades, las cuales convierten a la arcilla natural en un material muy versátil.
Entre las características principales podemos citar las siguientes: a) las arcillas están formadas por cristales muy pequeños, b) tienen la capacidad de intercambiar iones, c) son capaces de variar su composición química interna, d) pueden alojar moléculas en el interior de su espacio interlaminar, e) la superficie de las láminas presenta una actividad química considerable y f) los cambios físicos de la estructura laminar, por ejemplo el hinchamiento, son reversibles.
Numerosas son las bondades de estos sólidos, producto de las modificaciones que sufre el edificio laminar al ponerse en contacto con otras especies químicas o al someterse a condiciones termodinámicas específicas, lo que constituirá el tema de este capítulo. El lector posee ya una descripción de la arquitectura de los edificios laminares típicos de las arcillas, así como de las especies o "muebles" que intervienen en los fenómenos relacionados con ellas, por lo que ahora lo invitamos a hacer un cambio en la decoración.
Desde la antigüedad, el hombre ha practicado actividades diversas de las que
desconocía, por supuesto, los fundamentos científicos que se relacionan con
aquellas. De hecho, hoy en día no tenemos una descripción satisfactoria de todos
ellos, sin embargo, esto no fue impedimento para que, empíricamente, se haya
llegado a realizar una serie de desarrollos, que pueden calificarse de fantásticos,
propios de un conocimiento avanzado a escala molecular. Las espadas de Damasco
y las porcelanas chinas del periodo Sung son buenos ejemplos. Baste mencionar
que los chinos, en los siglos IX al XII, obtuvieron
materiales cerámicos de gran dureza al mezclar las arcillas con sustancias orgánicas.
Esta operación permitió fabricar la porcelana de finísimo grosor que asombró
a los europeos de épocas posteriores.
Sin embargo, con propósitos más prácticos y menos estéticos hoy en día millones de toneladas de arcilla, de la familia de las esmectitas, se utilizan durante la perforación de los pozos petroleros con el fin de impartir la viscosidad apropiada a los lodos de perforación. En estas aplicaciones tan disímbolas existe un factor común que es la modificación de la estructura laminar de la arcilla al ponerse en contacto con especies químicas, por ejemplo el agua y las moléculas orgánicas. Esta situación puede simularse si, con imaginarios obuses químicos, nos disponemos a bombardear el edificio laminar de las arcillas provocando cambios que pueden o no ser permanentes. En nuestro arsenal contamos con tres tipos de obuses: el agua, las moléculas orgánicas y los polímeros inorgánicos de tamaño variable.
Imaginemos que lanzamos un proyectil sobre el edificio laminar de una arcilla, por ejemplo de agua, de modo que al chocar se produzca una interacción explosiva, en donde la carga estaría representada por la fuerza electrostática. Esta fuerza es resultado del carácter dipolar de la molécula de agua, es decir, que ésta se comporta como un pequeño imán, ya que se halla compuesta por un átomo de oxígeno (O2-) y dos de hidrógeno (H+); como los hidrógenos se localizan en un extremo de la molécula, aparece a un lado una concentración de carga positiva, mientras que en el otro es más negativa.
Por eso los proyectiles se asocian de inmediato a la superficie de las láminas de arcilla, las cuales también presentan una carga neta negativa. En particular, a cierta temperatura, por ejemplo 0ºC, las moléculas de agua se asocian fácilmente a las superficies y también unas con otras, logrando una densidad y una viscosidad aún mayores que la densidad del agua en estado natural, a semejanza del hielo, y extendiéndose en varias capas.
También por estas razones, al añadir una pequeña proporción de arcilla al agua ésta permanece flotando sobre el líquido indefinidamente, alcanzando el estado coloidal. Sin embargo, si se añade aún más, el líquido se torna viscoso y se resiste a fluir; en cambio, si se agita vigorosamente la suspensión, el líquido recupera su fluidez, perdiéndola nuevamente al cesar la agitación. A esta propiedad se le llama tixotropía, y es típica de muchas de las arcillas comunes. Tiene su asiento en la afinidad por el agua, así como en la capacidad de hinchamiento del espacio interlaminar, el cual puede alcanzar hasta quince veces el volumen original.
Veamos ahora en forma secuencial lo que ocurre cuando el agua se aproxima al edificio laminar de la arcilla con ayuda de la figura 18.
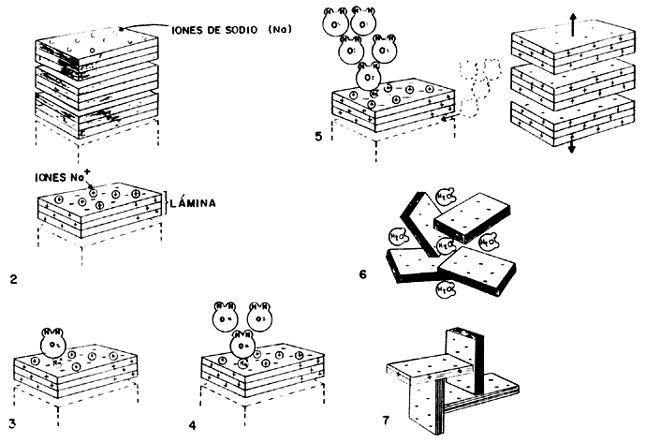
Figura 18. Etapas secuenciales en la interacción del agua en la arcilla.
Etapa 1: en el principio la arcilla se encuentra en un estado deshidratado, son algunos iones de sodio (Na+), potasio (K+) o tal vez calcio (Ca2+) adsorbidos en el espacio interlaminar.
Etapa 2: desde el punto de vista electrostático, las cargas negativas en la arcilla se acumulan en las superficies planas de las laminillas, mientras que los bordes acumulan cargas positivas. Luego los iones de sodio tienden a concentrarse sobre las caras planas.
Etapa 3: al ponerse en contacto con la arcilla, las moléculas de agua son atraídas fuertemente hacia las superficies planas debido a la presencia de los iones sodio cargados positivamente. Hay que recordar que, a la escala molecular, las fuerzas electrostáticas son las más importantes.
Etapa 4: en este estado, las moléculas de agua se hacen más dipolares, atrayendo a otras de su especie.
Etapa 5: la carga negativa en la superficie de las laminillas se incrementa conforme las moléculas de agua se enlazan unas con otras al aumentar su polarización. Llega un momento en que la carga superficial es tal, que las láminas se repelen entre sí separándose unas de otras por lo que el espacio interlaminar se expande, originando el hinchamiento característico de las arcillas.
Etapa 6: las moléculas de agua continúan llenando el espacio interlaminar, neutralizando parcialmente las superficies expuestas y manteniendo las láminas apartadas unas de otras, hasta que el agua es eliminada mediante algún procedimiento de secado, lo cual origina una contracción del volumen de la hojuela.
Etapa 7: el equilibrio de la hidratación es alcanzado cuando termina la mezcla de la arcilla con el agua, dando como resultado una estructura interna hidratada que hace coincidir los bordes cargados positivamente con las caras planas cargadas negativamente, de modo que se forma una estructura de castillo de naipes, por lo que las moléculas de agua entran y salen libremente. Este castillo puede derrumbarse mediante una agitación vigorosa de la suspensión, pero tiende a formarse de nuevo si la agitación termina, esto es, si el medio queda libre de esfuerzos mecánicos. Este último efecto se debe a que las hojas mantienen la fuerte carga electrostática que las atrae.
Conociendo el lector estos mecanismos de interacción arcilla-agua, seguramente viene la pregunta: ¿qué provecho práctico se puede obtener de ello?, por lo que mencionaremos un par de ejemplos a fin de mostrar su valor.
Se puede decir que casi todos los suelos contienen arcilla en mayor o menor proporción. Hoy en día se sigue estudiando la correlación que existe entre la cantidad y la clase de arcilla en los terrenos y su relación con la fertilidad. Los científicos en este campo, como sucede a menudo en otras ramas de la ciencia, se quejan de que en la actualidad no se conoce en su totalidad el proceso y proponen la necesidad de estudiar in situ las propiedades de las arcillas, el efecto de las mezclas y las modificaciones que éstas provocan. Es necesario decir que los modelos de laboratorio muchas veces no reflejan las observaciones realizadas en el terreno, por lo que deben llevarse a cabo en condiciones más próximas al fenómeno natural.
Como se ha mencionado, la presencia de arcillas y un conjunto de factores como la acidez, el tipo de cationes, la humedad, etc., producen efectos benéficos y dañinos en los suelos agrícolas. Se ha llegado a determinar que la composición óptima de arcilla oscila entre un 15 y 25% en peso de componentes finos, con diámetros de partícula menores a 2 micras, y una proporción mayor de componentes gruesos con un diámetro de partícula mayor a 60 micras. Esto se debe a que una de las principales funciones de las arcillas es su contribución a la estabilidad y cohesión de los suelos para resistir los efectos mecánicos nocivos como la lluvia y el viento. La habilidad de las arcillas para hincharse o contraerse en respuesta al grado de humedad es vital en la generación de la estructura granular de los suelos agrícolas, los cuales requieren de permeabilidad adecuada del aire y del agua, y también que no dificulten la penetración a las raíces de las plantas.
Estudios recientes realizados mediante la microscopía electrónica, revelaron que a nivel submicroscópico existen en los suelos partículas con una configuración y jerarquía particulares, las cuales varían en un intervalo muy amplio, comenzando con las fisuras comunes de 10 a 100 milímetros de tamaño y terminando con los microporos de 10 a 100 angstroms (1 angstrom = 0.0000000001 m).
Sumando a lo anterior la capacidad de intercambio iónico típica de las arcillas, la cual ejerce un efecto directo sobre el almacenamiento y la cualidad de ceder nutrientes minerales como magnesio, sodio, potasio, calcio y los compuestos nitrogenados y fosfatados, llegamos a un punto realmente vital en el papel tan importante que desarrollan las arcillas en el crecimiento de las plantas y de los animales que se alimentan de ellas. También es un hecho experimental que, bajo condiciones de acidez adecuadas, los iones de hidrógeno (H+) reaccionan con las láminas de arcilla, disolviendo el magnesio, el hierro y el aluminio asociados comúnmente a la hoja octaédrica de las arcillas. Pero, en los terrenos que poseen altas concentraciones de aluminio intercambiable, la extracción de aluminio realizada por la vía ácida suele ser nociva para el crecimiento de las plantas. En cualquier caso, la interacción de la arcilla con el agua y el medio mineral circundante es determinante para el desarrollo de los suelos agrícolas.
La gran capacidad que para hincharse tienen las arcillas puede utilizarse positivamente. En efecto, al hincharse las hojuelas por efecto de la hidratación se producen esfuerzos considerables que vencen la atracción electrostática entre las láminas, y el concurso de todas estas fuerzas sobre una masa de arcilla que equivale apenas a unos cuantos miligramos es tal que fácilmente pueden desintegrar un aglomerado, o bien ¡una pastilla! Así tenernos, pues, una aplicación concreta aprovechada frecuentemente en la fórmula de numerosas pastillas de uso farmacéutico y veterinario. Debido a que las fuerzas que se generan durante la expansión del material son importantes a escala microscópica, éstas conducen a la desintegración de las pastillas, que contienen arcilla en su composición, al contacto con los jugos gástricos, liberando los componentes activos en el organismo del paciente. ¡Cuántas aspirinas habremos tomado sin enterarnos de que el agente aglutinante de la pastilla era una arcilla mineral!
También el uso de estas fórmulas se ha extendido al campo de la preparación de insecticidas y herbicidas que pueden liberarse en los suelos de manera controlada al ser humedecidos.
De toda esta historia del obús de agua vale la pena retener algunos puntos importantes: las arcillas que no presentan carga residual negativa carecen de las propiedades de hinchamiento descritas anteriormente, tal es el caso del talco y la pirofilita. Por otra parte, los minerales, como la mica muscovita, sí presentan carga residual negativa, pero ésta es muy elevada, de modo que tampoco expanden su estructura laminar al ponerse en contacto con el agua. La explicación de unas y otras está, pues, en el valor de su carga negativa: si es nula (E = 0) o muy elevada (E = 1.0) no se produce el fenómeno de hinchamiento. En el caso de las micas, la carga laminar asociada a cada unidad estructural es tan fuerte que las láminas atrapan los cationes positivos como el potasio, de manera que el agua, a pesar de su dipolo, no puede romper ese enlace.
En el caso intermedio se encuentran las arcillas tipo montmorillonita y algunas tipo vermiculita, las cuales se expanden rápidamente en presencia de un gran volumen de agua. Más aún, si hacemos un experimento cuidadoso, como el que se muestra en la figura 19, en la que observamos la separación laminar que sufre una bentonita sódica al ponerse en contacto con concentraciones crecientes de agua, veremos que se presenta una serie de escalones, cada uno de los cuales indica la formación de una primera capa de moléculas de agua en el espacio interlaminar, una segunda capa y una tercera, respectivamente, señalando que el edificio laminar se expande ordenadamente al ser bombardeado por el obús de agua.
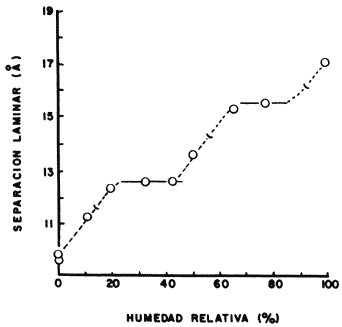
Figura 19. Expansión de la arcilla con el contenido de agua.
Al igual que las moléculas de agua, las especies orgánicas también penetran en el espacio interlaminar de las arcillas. El arsenal en este caso es más abundante ya que las especies orgánicas forman un grupo muy prolijo, variando tanto su tamaño como sus grupos funcionales, hasta llegar a las moléculas complejas características de las proteínas y los aminoácidos. Los cambios de propiedades que pueden producirse por la intercalación de especies orgánicas en el espacio interlaminar son muchos y muy variados, de ahí que despierten gran interés, desde el punto de vista científico y el de sus aplicaciones. Por ejemplo, las propiedades tixotrópicas mejoran al tratar la arcilla con compuestos orgánicos, que dan origen a fórmulas diversas de pinturas o de cosméticos. La intercalación de especies orgánicas como los alcoholes, las proteínas y los hidrocarburos en el espacio interlaminar se realiza de manera muy fácil, expandiendo la estructura laminar y creando así una porosidad interna en el material, con lo cual la arcilla se convierte en una verdadera esponja molecular.
Enseguida veremos cómo el estudio de estos fenómenos nos puede conducir al control de la porosidad y otras propiedades a escala molecular, de modo que puedan lograrse aplicaciones interesantes. Tal vez uno de los sistemas más estudiados es el compuesto por la arcilla y los derivados orgánicos del amonio, fenómeno descubierto en 1934. A partir de entonces se inició una búsqueda febril en varios laboratorios del mundo con el fin de identificar nuevos compuestos de ese tipo y las propiedades logradas mediante la intercalación de una gama de compuestos arcilla-orgánicos. Treinta años después se había informado de ¡más de 9 000 compuestos!
Se ha descubierto que las moléculas orgánicas se acomodan entre las láminas de la arcilla produciendo un efecto de expansión que varía según dos factores principales:
— el tamaño de la cadena orgánica, o el número de átomos de carbono.
— la carga eléctrica de las láminas.
Por ejemplo, a partir de una estructura como la esmectita sódica, cuyo espacio interlaminar se encuentra colapsado en el estado anhidro (sin humedad). Es decir, que si la separación inicial entre los centros de las dos láminas contiguas es de 9.5 Angstroms aproximadamente, entonces habrá una modificación de la distancia interlaminar al intercalar moléculas orgánicas de la siguiente manera:
|
|
|
|
Molécula
|
Separación interlaminar
|
|
(en Angstroms)
|
|
|
|
|
|
(CH)3 NH3+
|
12.0
|
|
(CH3)2 NH2+
|
12.2
|
|
(CH3) NH+
|
13.0
|
|
(CH3)4 N+
|
13.5
|
|
|
|
El efecto de la otra variable, es decir la carga eléctrica de las láminas, se ilustra en la figura 20, la cual muestra la expansión del edificio laminar de una arcilla al intercalarse una molécula orgánica que contiene doce átomos de carbono. La posición de la molécula varía según la carga laminar de la arcilla. Así, cuando la carga es baja la molécula orgánica se acomoda con sus partes planas dispuestas paralelamente a las láminas de la estructura, mientras que si se incrementa la densidad de carga entonces la cadena comienza a levantarse hasta llegar al caso extremo en que se coloca perpendicularmente a las láminas. Esta última situación es idónea en lo que a estabilidad se refiere, ya que en esa posición erecta la molécula forma enlaces por los dos extremos mediante los átomos de hidrógeno del grupo NH y los átomos de oxígeno que se encuentran en los anillos de seis miembros de la capa tetraédrica de la arcilla.
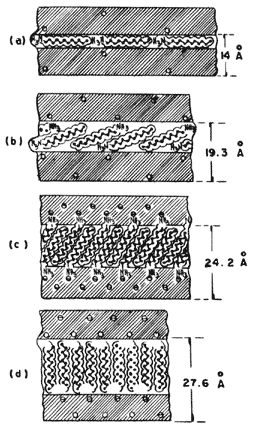
Figura 20. Orientación de las moléculas orgánicas en función de la carga eléctrica creciente.
Luego, estos mecanismos permiten explicar cómo la intercalación de algunas proteínas de gran tamaño induce sólo una pequeña variación de la distancia interlaminar, mientras que otras provocan variaciones importantes que no siempre corresponden a su tamaño y configuración. Se ha encontrado que algunos de los complejos orgánicos adquieren gran estabilidad al ser intercalados en el espacio interlaminar así, por ejemplo, se tiene que la guanidina, uno de los principales ácidos nucleicos, se mantiene íntegra en la montmorillonita, aun a temperaturas superiores a los 600 grados centígrados.
Otras propiedades de los complejos orgánicos intercalados es su resistencia a la descomposición causada por microbios. Es decir, que las proteínas, enzimas y antibióticos muestran mayor resistencia cuando se encuentran adsorbidos en el espacio interlaminar de una arcilla, que cuando se hallan solos. Una de las explicaciones probables de este fenómeno se relaciona con la orientación de las moléculas adsorbidas en la arcilla, ya que en su interior los grupos activos de las moléculas orgánicas son inaccesibles a los agentes externos y, además, al adsorberse sobre las láminas de las arcillas esos mismos grupos se desactivan. Numerosos experimentos han demostrado que los antibióticos adsorbidos pierden su actividad característica al adsorberse en las paredes laminares de las arcillas.
Asimismo, ciertas reacciones químicas que no ocurren en el estado normal de los compuestos orgánicos toman lugar al ponerse en contacto con las arcillas, indicando que estas últimas actúan como catalizadores, tema que será tratado más adelante.
El efecto de las arcillas sobre algunas moléculas orgánicas es claro y evidente en algunos casos. Tomemos por ejemplo las anilinas, las cuales cambian su color al contacto con las arcillas, pasando al color rojo cuando la carga es baja (p. ej. E = 0.33 en las montmorillonitas), al azul púrpura cuando la carga es ligeramente mayor (E = 0.55 en las vermiculitas y algunas montmorillonitas) y al negro cuando la carga es alta (E = 1.0 o mayor, como en las micas).
EL MISTERIO DE LA PORCELANA CHINA
La porcelana se ha fabricado en China probablemente desde el siglo VI de nuestra
era; ya que en el siglo IX se hacían grandes exportaciones a Japón,
Corea y los países árabes. El jesuita D'Entrecolles vivió en China de 1711 a
1722, y menciona en sus cartas que en el centro de fabricación de porcelana
más importante, unas 180 000 familias trabajaban en la producción, en la que
se empleaban 3 000 hornos que trabajaban día y noche. Entre los siglos XVI
y XVII la porcelana china se introdujo a Europa creando una verdadera
pasión, que asumió proporciones de enfermedad, por la posesión de una de sus
piezas tan valiosas. En particular, las porcelanas del periodo Sung (siglos
IX al XIII) destacan por su belleza y resistencia,
además de su grosor increíble ya que hay piezas de sólo 0.4 mm. de espesor.
El secreto de la fabricación de la porcelana Sung se perdió debido, principalmente,
a la invasión mongólica (1286-1386 d.c.); los manuscritos originales
del periodo Sung se perdieron y aquellos escritos posteriormente mencionan sólo
de manera vaga los detalles químicos de la preparación o de la técnica de producción.
No obstante, los chinos recuperaron parte de la experiencia previa durante el
periodo Ming (siglo XVIII), cuando volvieron a fabricar porcelana
de gran delicadeza la cual recibió el nombre de Ling-Lung, es decir, "trabajo
del diablo", para indicar que iba más allá de la habilidad humana. Estas porcelanas
sólo podían fabricarse por orden directa del emperador, y eran tales sus características
de dureza y resistencia que, una vez secadas al horno, se les disminuía el espesor
mediante buriles de acero.
Investigaciones realizadas en la época y, más recientemente, en nuestro siglo, mostraron que durante el periodo Ming se empleaba un caolín muy cristalino pero de plasticidad muy pobre y que por sí solo no produce materiales de alta calidad en cerámica, ni ofrece resistencia a la ruptura. Los análisis químicos indican que la porcelana china no se ha modificado en su composición a lo largo de 200 años, por lo tanto se deduce que la calidad del material de base dependía de la sensibilidad del tacto del artesano. Por ello mismo, se deduce nuevamente que el secreto no estaba en los materiales de base, sino que ¡debía ser la técnica! Una de las operaciones esenciales de la fabricación es la molienda del material, que debía hacerse mediante muelas o piedras en la época Sung, a diferencia de los métodos actuales mediante molinos de bolas. Otro aspecto clave del proceso de fabricación era sin duda el añejamiento, ya que los artesanos chinos sometían el material de base a un proceso de añejamiento que consistía en enterrarlo y mojarlo subsecuentemente con orina (sí, leyó bien ¡con orina!) durante periodos que variaban de unos meses a centenares de años. La explicación científica de estos procedimientos, que se aplicaban empíricamente, viene a levantar el velo de misterio que cubría a la porcelana Sung.
Recordemos del capítulo I que la estructura molecular de los caolines consiste en una lámina formada por la unión de una hoja de tetraedros de sílice con otra de octaedros de alúmina y oxhidrilos. Esta estructura es químicamente muy estable y muy resistente al ataque de ácidos o bases. Esto nos conduce a pensar que los procesos de añejamiento mencionados debían tener, principalmente, incidencia sobre la superficie de los cristales, más aún siendo los reactivos una serie de productos derivados de la descomposición de la orina: iones de amonio, urea e iones de OH. Ahora bien, puesto que la estructura molecular de los caolines es semejante a una gran molécula bidimensional enlazada por puentes de hidrógeno, por ejemplo Al-OH__O-Si, éstos pueden romperse por la acción de ciertos compuestos que tienen la facilidad de penetrar al espacio interlaminar, tal y como ocurre con la urea, la cual penetra en la estructura expandiéndola de 7.2 hasta 10.7 Angstroms; nuestro conocido obús. Otro derivado de la fermentación de la orina es el acetato de amonio, que se forma en cantidades copiosas y, al igual que la urea, tiene gran facilidad para penetrar el espacio interlaminar de las arcillas, expandiendo la estructura laminar de los caolines hasta 14.2 Angstroms. Estos procesos de intercalación no requieren de condiciones especiales sino que se llevan a cabo a temperaturas moderadas, entre 20 y 30 grados centígrados, condiciones que seguramente prevalecen durante el proceso de añejamiento mencionado.
Ahora bien, si ya se ha demostrado que tanto la urea como el acetato de amonio tienen la facilidad de penetrar la estructura de la caolinita y expanderla, ¿qué sucede con las propiedades físicas del material cerámico derivado de esa pasta añejada? La respuesta a esta pregunta es favorable: como lo hemos visto a lo largo de este libro, las propiedades plásticas y la resistencia a la ruptura se incrementan cuanto menos apiladas y más pequeñas sean las hojuelas de la arcilla de base. La intercalación de la urea y los otros compuestos de amonio tiene por efecto cambiar drásticamente la forma de los cristales, sin necesidad de tratamientos mecánicos, ya que las láminas de caolinita se separan unas de otras por efecto de la expansión inducida por la urea, dado que los puentes de hidrógeno son sustituidos por enlaces con la urea. Los cambios de forma vienen asociados a esta separación, ya que al deslaminarse las hojuelas, las láminas individuales tienden a enrollarse a fin de aliviar la tensión creada por la unión de las hojas tetraédrica y octaédrica, pues éstas tienen distintas dimensiones. El resultado es un material extremadamente plástico, fácil de modelar y con una resistencia mecánica superior. Una vez revelado el secreto de la porcelana china dejo en manos del lector la decisión de iniciar su fabricación.
Hasta este momento hemos descubierto las interacciones que tienen lugar entre las arcillas, el agua y las moléculas orgánicas, todas ellas interacciones reversibles. Es decir, que si sometemos al sólido intercalado a un tratamiento térmico o físico-químico, el material recuperará su forma original cuantas veces se repita el ciclo, tal y como ocurre con un acordeón que se expande y se contrae según la fuerza que se aplica sobre sus fuelles. En este aspecto las arcillas son semejantes, precisamente, a ¡un acordeón!
Las arcillas podrían desempeñar un papel importante en múltiples campos a condición de que las dimensiones de su espacio interlaminar fuesen perdurables, es decir, que la separación interlaminar se diera en forma constante, sin importar los tratamientos a que fuese sometido el material. Como veremos enseguida, las arcillas son capaces de actuar como verdaderos catalizadores en un sinnúmero de reacciones de interés industrial, por lo que los científicos idearon la manera de hacerlas estables mediante la fijación de la distancia interlaminar. La estrategia que permitiría realizar este propósito fue fijada en 1974 durante una reunión de especialistas en catálisis. Después de varias discusiones se estableció lo siguiente: para impedir que el edificio laminar de la arcilla recupere su forma inicial es necesario apuntalar el espacio entre los pisos. ¿Cómo?, fue la pregunta colectiva. ¡Mediante pilares!, fue la respuesta lógica, ¡tal y como ocurre con el piso y el techo de un edificio! De esta forma caemos en el mundo de la ingeniería molecular pues utilizando conceptos macroscópicos, como apuntalar el piso y el techo de un edificio, descubrimos la posibilidad de efectuarlos a escala molecular.
Se trata de desarrollar especies químicas de tamaño adecuado para que penetren en el espacio interlaminar de las hojuelas de arcilla, expandan su estructura y, posteriormente, se transformen en otra fase estable que resista convenientemente la desintegración. En forma gráfica este proceso se ilustra en la figura 21.
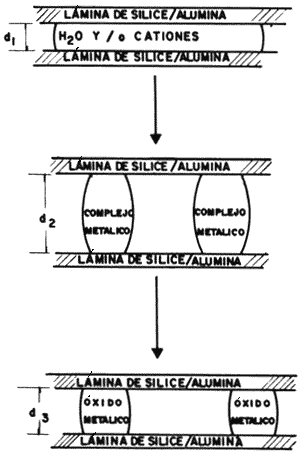
Figura 21. Etapas sucesivas de la intercalación.
En resumen veamos qué características deben tener las especies químicas a fin de poder ser candidatos al "pilareo" de las arcillas:
1) Tener longitudes variables.
2) Ser solubles (en agua o en otro solvente de uso común).
3) Poseer una carga eléctrica positiva.
4) Ser susceptibles de descomponerse en otra especie más estable cuando se les trata térmicamente o mediante otro procedimiento.
5) Tener propiedades catalíticas.
LOS MATERIALES PARA LAS COLUMNAS
Con las premisas anteriores, los investigadores científicos se armaron de "picos y palas" e iniciaron la búsqueda de especies que cumplieran los requerimientos. Los materiales idóneos resultaron ser los inorgánicos, dado que los orgánicos son inestables al efecto de la temperatura. Una de las primeras familias de compuestos inorgánicos fue la de los complejos del aluminio, que se obtienen mediante hidrólisis. En este punto es necesario recordar que cuando el agua se combina con otra sustancia, sin que ninguno de sus enlaces se rompa, se tiene un fenómeno de hidratación. Un ejemplo de este fenómeno es el cloruro de aluminio, el cual se forma con cristalización y que contiene seis moléculas de agua: AlCl3 · 6H2O. La tenacidad con la que un ion metálico retiene a las moléculas acuosas varía considerablemente de un elemento químico a otro. Si, por el contrario, el agua reacciona químicamente con una sal, produciéndose una ruptura de enlaces O-H, entonces se tiene una reacción de hidrólisis, en la cual se producen especies iónicas hidratadas que imparten una cierta acidez. Es común que los hidratos sufran reacciones de hidrólisis las que, en forma simple, podemos representar de la manera siguiente:
No obstante, resulta que cuando una sal de aluminio se hidroliza bajo condiciones controladas se genera una serie de reacciones complejas de hidrólisis y polimerización, las cuales conducen a la formación de especies solubles cuya identidad no está del todo esclarecida. En fin, los científicos buscaron en los catálogos de los productos hidrolizados del aluminio y, para su sorpresa, encontraron que las especies más prometedoras se empleaban con éxito desde hacía muchos años en ¡los desodorantes! Desde el punto de vista fundamental, sin embargo, investigaciones recientes han demostrado que esas especies tienen como constituyente principal al ion Al13, cuya fórmula química es lo suficientemente compleja como para espantar a un principiante:
La figura 22 (a) ilustra la estructura molecular de este compuesto, el cual está formado por un átomo central de aluminio de valencia 4 (tetraédrico) rodeado por 12 átomos de aluminio de valencia 6 (octaédricos) que forman una cadena, o sea un polímero inorgánico. Este ion tiene asociada una fuerte carga positiva, por lo que es capaz de interaccionar con las cargas negativas presentes en las láminas de la arcilla. Es necesario mencionar en este punto que las reacciones de hidrólisis controlada permiten el acoplamiento del Al con otras especies más pequeñas: Al6, o bien Al13 con Al13 para formar Al26, con lo cual la ingeniería molecular adquiere su valor real, al permitir la obtención de especies precursoras de tamaño variable.
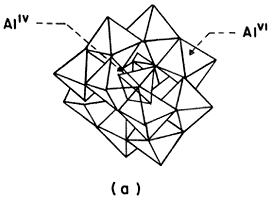
Figura 22 (a). Complejos acuosos de aluminio.
Además del aluminio, también se ha utilizado el circonio, el cual forma iones complejos en solución, por ejemplo el Zr(OH)2 4H2O48+, que compone unidades tetraméricas del tipo Zr semejantes a las mostradas en la figura 22 (b) con la posibilidad de penetrar el espacio interlaminar y formar especies estables en el interior. Otros complejos menos comunes se pueden obtener a partir de las sales de titanio, cromo, galio, hierro y zinc, principalmente.
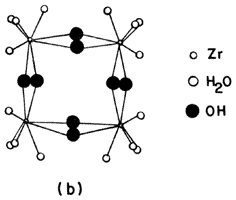
Figura 22 (b). Complejos acuosos de circonio.
Recapitulando, vemos que las especies descritas pueden presentarse en longitudes variables, según la longitud de la cadena polimérica, con lo cual se puede variar el tamaño del pilar formado en el interior del espacio interlaminar. También esos complejos son solubles en el agua y portan una carga positiva que, como si fuera un imán, se dirige hacia las zonas de la arcilla con carga negativa, ocupando naturalmente esos espacios mediante un proceso de carácter electrostático. Si hubiera ya otro catión en ese lugar, la especie polimérica tomará su lugar, debido a un proceso de intercambio iónico en el que la fuerte carga positiva de este último determina la posición final.
Finalmente, una vez intercambiados los iones dentro del espacio interlaminar de la arcilla, se procede a transformar al precursor del pilar en una especie más estable, lo que abordaremos a continuación.
La transformación en un pilar más estable de la especie intercalada se logra mediante un tratamiento térmico, a temperaturas elevadas, que provoca la descomposición del precursor y la transición hacia una nueva fase inorgánica. Esta secuencia, considerando al complejo Al13, se ilustra en la figura 23. Como puede observarse, la expansión de las láminas aumenta por efecto de la intercalación, pasando de 9.4 Angstroms en el estado deshidratado hasta 18.8 Angstroms una vez que el material se ha estabilizado. Un método complementario de expandir la estructura laminar a distancias mayores se logra mediante la intercalación de especies formadas por cationes metálicos distintos, como se indica en la figura 24.
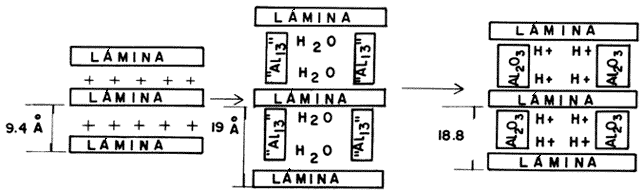
Figura 23. Intercalación y formación de pilares de aluminio en una arcilla.
|
|
|
|
Complejo metálico
|
Espacio interlaminar
|
|
( en Angstroms )
|
|
|
|
|
|
Al
|
18.8
|
|
Zr
|
22.0
|
|
Cr
|
27.6
|
|
Fe
|
13.9
|
|
Ti
|
29.5
|
|
|
|
|
Figura 24. Relación entre el tipo de metal y la expansión alcanzada. |
|
El dominio de la ingeniería molecular no se considera todavía muy completo y aún no estamos en posibilidad de responder todas las preguntas generadas en el proceso de modificación de las estructuras. Por ejemplo, ¿cuál es la naturaleza química del pilar?, o bien ¿qué tipo de anclaje físico se tiene entre la base del pilar y la lámina de arcilla?; ¿cuál es la distribución de los pilares en el espacio interlaminar? Así, aunque todas estas preguntas son de carácter fundamental, tienen interés práctico enorme, cosa que sucede muy a menudo en la investigación científica. Es decir, que las propiedades necesarias para el uso industrial de las arcillas pilareadas están relacionadas con parámetros tales como la estabilidad estructural y el diámetro de los poros, que a su vez dependen de la estabilidad del pilar y de la firmeza de su anclaje a escala microscópica, así como de la distnbución de los pilares entre las láminas, siendo todos ellos importantes para llegar al diseño de un tamiz molecular de propiedades adecuadas.
La naturaleza del pilar ha sido estudiada extensivamente en años recientes y, aunque su estructura se asemeja a la de un óxido metálico, lo cierto es que no se cuenta aún con evidencias claras al respecto.
En cuanto a la distribución de los pilares, se presentan dos casos. En el primero se tendría una distribución no uniforme e irregular de los pilares dentro del espacio interlaminar, como se observa en la figura 25 (a), mientras que en el segundo se tendría un arreglo ordenado en donde la distancia entre los pilares es constante (Figura 25 (b)).
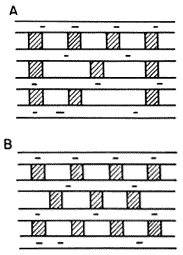
Figura 25. Distribución de pilares en una arcilla A = heterogénea, B = homogénea.
Resulta obvio que esta distancia es de vital importancia si queremos obtener un tamiz molecular que permita la entrada selectiva de moléculas dentro de cierto intervalo de tamaños.
En este punto cabe hacer notar que, a pesar de que las arcillas se utilizan desde hace cientos de años, aún no hemos alcanzado todo el potencial que representan, mediante el diseño inteligente y avanzado de sus propiedades estructurales.
Por último, y a guisa de comparación, fijémonos un momento en la estructura pilareada que se presenta en la figura 26, la cual ha sido estabilizada por muchos siglos más.

Figura 26. Una estructura pilareada muy conocida.