SEGUNDA PARTE


La nieve tan hermosa cuando cubre un paisaje, tal vez más fascinante como ejemplo de simetría natural. Estas fotografías de cristales de hielo muestran claramente simetría trigonal y simetría hexagonal.

En nuestros días, una de las industrias más importantes es la metalúrgica. En ella se requiere de grandes hornos como el de la figura, en donde se funden los metales a fin de darles la forma necesaria para la aplicación deseada. Las temperaturas a las que se consigue fundir los metales son por lo general elevadas, aunque se puede variarlas modificando la presión sobre el material. Las condiciones físicas de las distintas fases de la materia se muestran en diagramas denominados diagramas de fases o en tablas como la que presentamos aquí.
| PFN
|
[EN °C] | PEN
|
|
| |
|||
| helio | — 269.65 |
—268.93 |
|
| hidrógeno | — 259.31 |
— 252.89 |
|
| nitrógeno | — 209.97 |
— 195.81 |
|
| oxígeno | — 218.79 |
— 182.97 |
|
| alcohol etílico | — 114 |
—78 |
|
| mercurio | — 39 |
357 |
|
| agua | 0.000 |
100.00 |
|
| azufre | 119 |
444.60 |
|
| plomo | 327.3 |
1 750 |
|
| antimonio | 630.50 |
1 440 |
|
| plata | 960.80 |
2 193 |
|
| oro | 1 063 |
2 660 |
|
| cobre | 1083 |
1 187 |
|
| |
|||

El punto de fusión normal (PFN) se define como la temperatura a la cual coexisten en equilibrio las fases líquida y sólida del material, a la presión atmosférica, por punto de ebullición normal (PEN) se entiende la temperatura a la cual coexisten en equilibrio las fases líquida y gaseosa del material, mientras la presión es la atmosférica. En la fotografía se muestra un compresor para licuar helio, propiedad del Instituto de Investigaciones en Materiales de la Universidad Nacional Autónoma de México (IIMUNAM).

|

|
Cuando el arte barroco alcanzaba su esplendor —se producían obras como el baldaquino de Bernini en San Pedro y los primeros violines Stradivarius—, mientras en Francia gobernaba el Rey Sol y en la Nueva España don Juan Leyva y de la Cerda, la ciencia experimental comenzaba apenas a definirse. En esos tiempos, Malpighi observó por primera vez al microscopio corpúsculos de sangre y se formularon las leyes de los gases ideales. Robert Boyle (1627-1691), irlandés, descubre el papel del oxígeno en la combustión y la relación entre el volumen y la presión de un gas, resultados que publica en 1660 en su libro A Defense of the Doctrine Touching the Spring and Weight of the Air. Por la misma época, e independientemente, el físico francés Edme Mariotte (1620-1684) presenta resultados semejantes en su Discours de la nature de l' air, que aparece en 1676. Ya que en el siglo XIX, Joseph Louis Gay-Lussac (1778-1850) completa estos estudios.
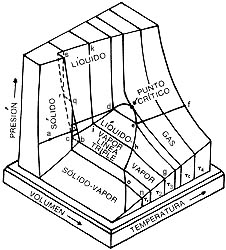
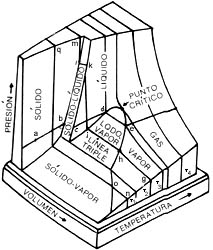
En la imagen superior se muestra el diagrama PVT (presión-volumen-temperatura) de una sustancia que se expande al fundirse, y en la inferior el de otra que se contrae; este último es el caso del agua y la razón por la que los hielos flotan. Se ve que la sustancia puede existir en las fases líquida, sólida o gaseosa, que dos fases pueden coexistir y, en la línea triple, son posibles tres fases a la vez.
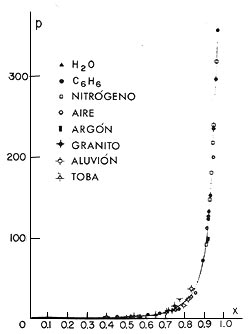
Este diagrama, calculado en el Instituto de Física de la UNAM por Fernando Prieto y Claude Renero en 1975, muestra que bajo grandes presiones —millones de veces mayores que la presión atmosférica— los materiales obedecen leyes que, como la de los gases ideales, son universales. Esto implica que son válidas para muy diversos materiales, y no sólo eso, sino independientes de la fase del material.

El estilo greco-etrusco —287-212 a.c.—, del cual es una muestra El banquete de la muerte, floreció en la época en que Arquímedes, el gran científico griego vivió en Siracusa. Su muerte, a manos de un soldado romano, se ha usado frecuentemente para resaltar las diferencias entre éstos y los griegos. Es famoso su ¡eureka! (¡he hallado!) que gritó al salir de su bañera y recorrer su ciudad totalmente desnudo, porque había descubierto el principio que hoy lleva su nombre, al sentir que era más fácil levantar sus extremidades cuando estaba sumergido en el agua. Al parecer, Arquímedes trabajaba por aquel entonces en una labor detectivesca: averiguar si la corona del rey Hieron era de oro puro, o bien una mezcla con plata. Su descubrimiento le permitió resolver el problema. Las aplicaciones del principio de Arquímedes son innumerables: permite, por ejemplo, determinar en los barcos la llamada línea de Pimsoll, que marca el nivel seguro de carga.
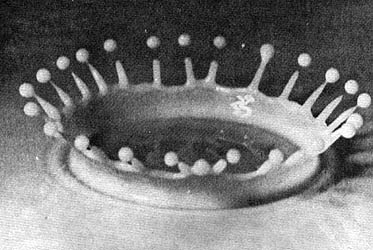
La naturaleza tiende siempre a buscar los extremos, máximos o mínimos. En esta fotografía de una gota de leche que se estrella contra la superficie plana y rígida, se observa que las gotas que se forman son todas esféricas y del mismo tamaño. Bajo la acción de la tensión superficial, la manera de llegar a una energía menor es: buscar para un volumen dado el área menor, ésta es una de tantas posibles definiciones de la esfera. El tamaño de la gota sólo depende de la tensión superficial y ésta es una característica del material. Por eso, cuando se nos receta un medicamento en forma de gotas, nunca se prescribe el tamaño: todas las gotas tienen el mismo.
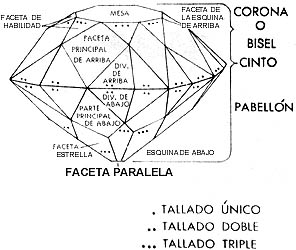

Para que el rayo luminoso se modifique por refracción y por un gran número de reflexiones, dando así la apariencia que el diamante emana luz propia, las gemas se cortan y se tallan. En la fotografía inferior se ve el tallado del diamante brasileño Vargas, uno de los mayores encontrados hasta ahora.

Heracles y los guerreros es una muestra del arte en la Era de Pericles, gran orador y estadista, quien gobernó cuando Demócrito (460-370 a.c.) hizo sus contribuciones fundamentales. Al igual que todos los pensadores de la Antigüedad, Demócrito incursionó por muchas ramas del conocimiento. Además de la constitución atomística de la materia, propuso la división del reino animal en dos grandes grupos: los animales con sangre y los que no la tienen. Esta clasificación fue aceptada por Aristóteles y perduró por muchos siglos.
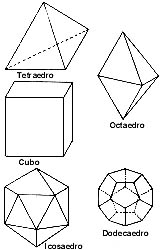
Los cuerpos platónicos o poliedros regulares.


John Dalton (1766-1844) y Joseph Louis Proust (1754-1826), químicos, revivieron la imagen atomística de la materia. Dalton (foto) nació en Inglaterra y se dedicó a la química, la física, la meteorología y a la fisiología: por 15 años recolectó datos meteorológicos y estudió la perversión visual al detectar los colores, defecto que hoy recibe el nombre de daltonismo. En 1803 publicó la tabla de masas atómicas que aquí vemos, y en la cual se usan los antiguos símbolos de la alquimia, que sólo abandonaron los químicos hasta mediados del siglo XIX, a propuesta del sueco Berzelius. Con la ley de las proporciones múltiples, Dalton explicó la relación numérica simple entre las composiciones de los dos óxidos de carbono. El químico francés Proust, por su parte, estableció experimentalmente el principio de la composición constante de los compuestos.

Joseph Louis Proust, luego de ser nombrado boticario en jefe del Hospital de la Salpetriére en París, abandona Francia y va a trabajar en el Laboratorio Real de Madrid, laboratorio notablemente equipado. Fue ahí donde realizó sus descubrimientos. En esa época la química española era importante. Su influencia llegó incluso a la Nueva España, donde en el Palacio de Minería don Andrés María del Río descubrió el elemento químico llamado vanadio. La historia es interesante: Del Río creía haber descubierto un nuevo elemento que llamó eritronio. Cuando Humboldt visitó México, le dio las muestras, para que su descubrimiento fuera comprobado en Europa. Los químicos del Viejo Continente dijeron que Del Río estaba equivocado pues confundía el eritronio con el cromo, ya bien conocido. Del Río, que trabajaba en un ambiente carente de tradición científica, no se mantuvo firme y concedió estar equivocado. Pero no lo estaba, y poco tiempo después el vanadio fue descubierto en Suecia, por lo que ahora lleva un nombre que recuerda la mitología escandinava.


En la Pisa renacentista nace el creador de la ciencia moderna, Galileo Galilei (1564-1642). Hijo de un estudioso de la teoría matemática de la música, compositor e intérprete de laúd, Galileo abandonó en 1589 sus estudios de medicina para dedicarse a enseñar matemáticas durante tres años. Fue entonces que descubrió las leyes de la caída de los cuerpos, que fueron discutidas en una memoria publicada 200 años después. Con un telescopio construido por él, observó las lunas de Júpiter, las irregularidades de la superficie lunar y las fases de Mercurio y Venus. Todo ello le impulsó a apoyar la hipótesis de Copérnico en contra del sistema ptolomeico, con la consecuente ira de la Inquisición. En los últimos años de su vida escribió Dialoghi delle nuove scienze, libro en que resume sus trabajos sobre mecánica.


En 1642, año de la muerte de Galileo, nace en Inglaterra Isaac Newton, uno de los más brillantes talentos de la historia de la humanidad. Con su ley de la gravitación universal y sus conocimientos de la mecánica, puede explicar las leyes que el astrónomo alemán Kepler —resumiendo sus observaciones y las de Tycho Brahe—, había formulado para los planetas: las órbitas son elípticas, en uno de los focos está el Sol, las áreas barridas..., etc. Las contribuciones de Newton son muy variadas: inventa el cálculo de fluxiones, directo antecesor del cálculo diferencial e integral; hace experimentos sobre la descomposición de la luz blanca; formula, en fin, la mecánica. Sin duda alguna, su Principia mathematica philosophiae naturalis, traducido al español por Antonio de Escothado en 1982, llenando así un vacío de tres siglos, es uno de los monumentos más grandes al intelecto humano. A manera de reconocimiento de sus antecesores Kepler y Galileo, Newton mencionó en alguna ocasión: "Es que estoy parado sobre los hombros de gigantes."
El concepto de sistema inercial es, como tantos otros en la física, una abstracción. Se refiere a aquel marco de referencia en que un cuerpo, sin interactuar con los demás, se mueve con velocidad uniforme y, por lo tanto, en línea recta. Esto ocurre en un salón de clase donde se hace una práctica de laboratorio, pero no sí nos hallamos montados en alguno de los diabólicos juegos mecánicos de una feria. Es interesante que podamos generar un sistema inercial muy bueno dentro de una nave espacial que órbita alrededor de la Tierra. Usando la nave como marco de referencia, la fuerza centrífuga cancela el efecto de la fuerza de atracción gravitatoria, y el cepillo de dientes del astronauta flota libremente.
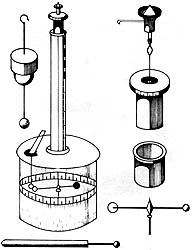
El gran físico francés Charles-Augustin Coulomb (1736-1806) escribió la memoria Théorie des machines simples, por la cual la Academie des sciences le otorgó un premio. En ella describe las leyes de la fricción y de la torsión que hoy llevan su nombre. Este conocimiento de la mecánica le permitió construir su balanza de torsión, con la cual descubrió la fuerza entre dos cargas eléctricas, la ley de Coulomb, básica en la electrostática. Contemporáneos al descubrimiento de Coulomb son el del planeta Urano por sir William Herschel en 1781, el de la vacuna contra la viruela por Edward Jenner en 1796 y la afirmación sobre la conservación de la materia hecha en 1789 por Antoine Lavoisier.
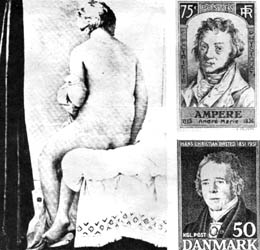
En la primera mitad del siglo XIX Ingres pinta sus famosos desnudos y también se produce la gran explosión electromagnética en la ciencia. En 1820, Hans Christian Oersted (1777-1851) anuncia en su opúsculo Experimenta circa efficaciam conflictus electrici in acum magneticam que a toda corriente eléctrica acompaña siempre un campo magnético. André Marie Ampére (1775-1836) usa estos resultados y experimenta sobre las fuerzas entre corrientes eléctricas, desarrollando al mismo tiempo la teoría matemática que las describe; presentó sus resultados a la Academie de sciences en 1820. Los trabajos del gran experimentador inglés Michael Faraday (1791-1867) sobre la electricidad, se encuentran recopilados en tres volúmenes Experimental Researches in Electricity, que fueron publicados entre 1831 y 1854 y presentados por primera vez a la Royal Society de Londres en 1831. Finalmente, y basándose en las ideas de Faraday sobre la transmisión en un medio de las fuerzas eléctricas y magnéticas, James Clerk Maxwell (1831-1879) sintetiza la teoría matemática en su trabajo Dynamical Theory of the Electromagnetic Field.
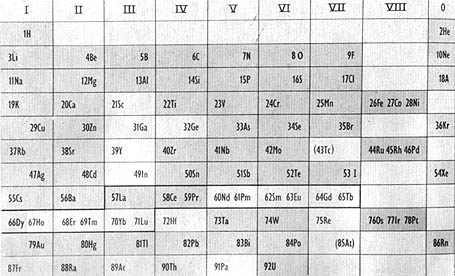

Dimitri Mendeleiev (1834-1907) con su Sistema periódico de los elementos marcó el comienzo de la química moderna. Aquí vemos la tabla periódica original y otra más actual, vigente hasta 1930, en que se marcan en obscuro algunos de los elementos cuya existencia predijo el químico ruso. Muchos dudaban de su clasificación, hasta que algunas de sus predicciones se cumplieron, conmoviendo al mundo científico de la época. Por ejemplo, Mendeleiev predijo un elemento parecido al aluminio, aunque más pesado; más tarde se descubrió el galio, con la densidad y el comportamiento ante los ácidos que había indicado Mendeleiev.
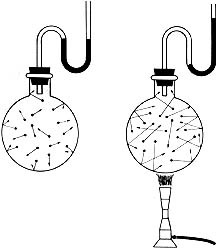
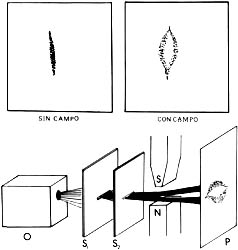
Cuando la temperatura aumenta, crece la energía cinética de las moléculas. También son más frecuentes los choques con las paredes del recipiente, si es que el volumen de éste se mantiene constante. Con un dispositivo experimental como el de la figura, se puede demostrar que la presión aumenta (pues sube la columna de mercurio) cuando se eleva la temperatura (porque el sistema se pone sobre un mechero de Bunsen).

Ludwig Boltzmann (1844-1906) es el gran teórico de la cinética de los gases y por tanto legítimo heredero de Demócrito. Boltzmann vive y trabaja en Viena desde 1902, para suicidarse cuatro años después, decepcionado porque sus ideas no eran aceptadas. En la Viena del siglo XIX floreció la cultura: la renovación musical de Mahler y Schonberg; la música ligera con Johann Strauss, hijo; el psicoanálisis creado por Freud y desarrollado por sus alumnos. Mientras, el impresionismo en la pintura, que tomó su nombre de esta pintura de Claude Monet. Impressions (1872) se asoma a su fin.
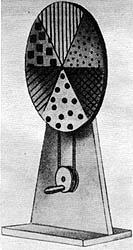

Sir Isaac Newton hizo experimentos de óptica, en los cuales demostró que la luz blanca está formada en realidad por luz de todos colores. Con un prisma la descompuso y con su disco cromático la sintetizó. Un fenómeno de refracción semejante al que ocurre en el prisma, y en el cual la luz violeta se desvía más que la roja, ocurre en las gotas de lluvia y nos explica el porqué del arco iris.

Robert Bunsen (1811-1899), químico alemán, dijo en cierta ocasión: "Un químico que no es físico no vale nada." La historia que estamos relatando sobre la estructura de la materia, claramente indica que Bunsen tenía razón. En las épocas modernas, la frontera entre la física y la química se ha borrado. Bunsen fue un científico notable: estudió los compuestos del arsénico, material venenoso y explosivo que, al detonar, le costó un ojo y por poco la vida; realizó estudios fotoquímicos de elementos terrestre y solares; descubrió el rubidio y el cesio y, junto con G. Kirchhoff (1824-1887), otro notable científico alemán, inventó el espectroscopio óptico. El primero de estos aparatos consistía en un prisma, una cajetilla de cigarros, el extremo de dos viejos telescopios y una fuente de luz que era un mechero de los que hoy llevan su nombre.

Espectros de emisión del hierro y de absorción en el exterior gaseoso del Sol. En esta comparación se puede ver claramente que muchas líneas obscuras del espectro del Sol coinciden con líneas brillantes del espectro de emisión del hierro en el Sol. Gracias a estos estudios se han determinado los elementos que existen en la Tierra, en el Sol y en otras estrellas, para consignar sus abundancias en tablas como la siguiente :

La huella digital del mercurio es su espectro óptico. No hay dos elementos o compuestos que tengan un espectro igual a este, formado por líneas luminosas de colores. En la parte inferior de la figura se muestra la interpretación cuántica del espectro, como transiciones entre diferentes niveles de energía.
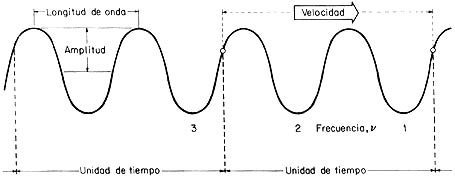
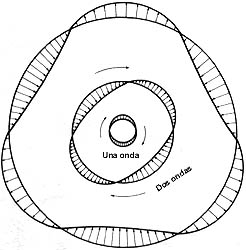
Los elementos principales de una onda. La amplitud está relacionada a la intensidad
mientras que el color lo determina la frecuencia (o la longitud de onda l,
pues se tiene la relación ln


Max Planck nació en Kiel, Schleswig-Holstein, el 23 de abril de 1858. Verdadero precursor de la física del siglo xx, era un muy buen ejecutante al piano. Su afición por la música y su dedicación profesional, se unen en un artículo publicado en 1893, donde indica que el oído humano prefiere las escalas temperadas, introducidas por Bach, a los tonos puros. Su fundamental trabajo sobre la termodinámica comienza con su tesis doctoral y continua con cuatro artículos agrupados bajo un título común: "Sobre el principio del aumento de entropía" y que habían sido publicados entre 1887 y 1891. En ellos describe la ley de acción de masas y las propiedades de las soluciones diluidas y de los electrolitos.

Luego de la confirmación de sus ideas sobre la gravitación, gracias a las pruebas efectuadas durante el eclipse de Sol de 1919, Einstein se convirtió sin duda en el científico más famoso del siglo. Al igual que Planck, Albert Einstein era un gran aficionado a la música, intérprete del piano y del violín. Interesado también en la filosofía y en la política, tenía buen sentido del humor: en una ocasión, al llegar a una reunión en Washington en la que se tratarían asuntos de Palestina, todo mundo aplaudió cuando cruzaba el salón; él le susurró a un amigo, "Creo que deberían esperar hasta oír lo que voy a decir". Y otra vez, cuando se ofrecía una comida en su honor y los oradores lo elogiaban desmesuradamente, dijo a su vecino de mesa: "Le voy a hacer una confesión: yo nunca uso calcetines."

En la misma época en que las estaciones del Metropolilain de París, con sus farolas de hierro adornado, constituyen una de las creaciones más interesantes del Art nouveau, sir William Crookes (l832-l9l9) estudia las descargas en gases rarificados. Además de fundar la revista Chemical News y descubrir el talio, Crookes construyó el tubo de rayos catódicos, hoy día tan importante en los osciloscopios y televisores modernos.
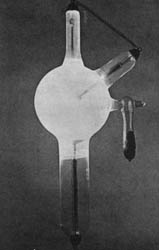
"Trabajaba con un tubo de Crookes cubierto con un blindaje de cartón. Sobre la mesa había un pedazo de papel de cianuro de bario platinado. Cuando hice circular una corriente por el tubo, observé una línea negra en el papel[...] Este efecto se podría producir sólo por el paso de la luz. Ninguna luz provenía del tubo, pues el blindaje era impenetrable a cualquier luz conocida. Supuse que el efecto tenía origen en el tubo. Lo comprobé. En pocos minutos no había duda sobre esto." Este es el relato que Wilhelm Roentgen (1845-1923) hace de su descubrimiento de los rayos X. La aplicación de esta radiación en medicina fue inmediata, tan sólo unas semanas después del descubrimiento. En nuestros días, aparatos de rayos X como el de la figura, son esenciales para investigar la estructura de las moléculas orgánicas y de los sólidos.

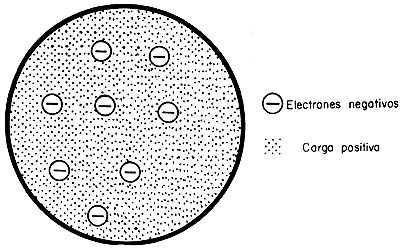
Luego de descubrir el electrón con un tubo de Crookes, sir Joseph John Thomson formuló el modelo atómico del pudín de pasas: la masa del pudín estaría formada por cargas positivas y los electrones serían las pasas. Thomson (1856-1940) nació en las cercanías de Manchester, donde estudió en el Owens College, para luego ir a Cambridge. Ahí fue director del Laboratorio Cavendish, el primero en el mundo planeado expresamente para dedicarse a la física. Aunque Thomson fue un gran físico experimental, era sorprendentemente torpe con las manos.
En 1905 se inicia una revolución en la cultura: el obscuro empleado de la oficina de patentes en Berna [Einstein] altera para siempre nuestras ideas sobre el espacio y el tiempo; Picasso crea Les demoiselles d'Avignon, cuadro precursor del cubismo; y en Rusia los cambios sociales anuncian la gran Revolución de Octubre de 1917.


Pierre Curie (l859-1906) descubrió, con su hermano Jacques, el fenómeno piezoeléctrico, éste consiste en que, cuando se comprimen ciertos materiales (como el cuarzo) se cargan superficialmente y, viceversa, si se les coloca en un campo eléctrico aparecen torsiones mecánicas en ellos. Curie realizó también importantes estudios sobre los materiales magnéticos. Marie Sklodowska (1867-1934) fue su alumna y, posteriormente, se casaron en 1895. El entonces reciente descubrimiento de Henri Becquerel (1852-1908) interesó mucho a Marie Curie, quien inició sus estudios sobre las radiaciones invisibles del uranio en 1898, para, en 1903, recibir el premio Nobel de Física compartido con su esposo y con Becquerel. Luego recibió el premio Nobel de Química en reconocimiento a haber aislado el radio metálico.
Después de estos dos descubrimientos, Rutherford clasificó las radiaciones según su carga. Bajo el efecto de un imán, las partículas alfa y beta se desvían en sentido contrario, ya que unas tienen carga positiva y negativa las otras. Los rayos gamma, que son ondas electromagnéticas formadas por fotones, no se desvían.

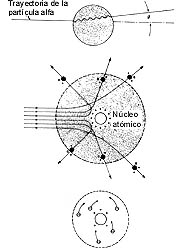
Ernest Rutherford (1871-1937) trabajó tanto en su natal Nueva Zelanda como en Cambridge, en Canadá y, finalmente, en Manchester, donde creó todo un estilo de hacer física. Fue el primer estudiante investigador de Cambridge; Thomson era su tutor. Estudió la transmisión de ondas electromagnéticas, la ionización del aire por rayos X, la acción de la luz ultravioleta sobre el zinc, la conductividad en el aire producida por la cercanía del uranio, las transformaciones radiactivas, la naturaleza de las partículas a, etcétera. Tal vez su contribución fundamental al conocimiento de la materia sea el descubrimiento del núcleo, con la consecuente propuesta del modelo planetario del átomo. En la figura superior se observa lo que espera un buen físico cuando una partícula a choca contra el átomo estilo pudín de pasas. Pero se requiere un centro de carga masivo para explicar lo que Rutherford observó. En lo que toca a la carga nuclear, al principio lord Rutherford mostró algunas dudas. En efecto, en una carta a Bragg le dice: "Comienzo a pensar que el núcleo central está cargado negativamente..." Pronto enviaría otra carta al mismo Bragg con la noticia de que el núcleo era positivo.

Siguiendo la tradición de los grandes físicos teóricos, Niels Bohr (1885-1962) hizo contribuciones importantes en muchas ramas de la física: desde luego con su modelo atómico, un gran paso adelante en la teoría de la materia; sus trabajos sobre las reacciones nucleares y su interpretación del significado de la mecánica cuántica. Bohr estudió en la Universidad de Copenhague, donde enseñaba su padre. Buen futbolista -aunque no tanto como su hermano menor, quien representó a Dinamarca en los Juegos Olímpicos de 1908 y luego fue un matemático de renombre- nos enseñó a entender el porqué de las "huellas digitales" de los elementos. Sin duda alguna el gran maestro de los grandes físicos de la primera mitad de este siglo, Niels Bohr recibió el premio Nobel en 1922 un año después de haber fundado su Instituto con la ayuda de la fábrica de cerveza Carlsberg. El Instituto Niels Bohr fue esencial en la formación de Kramers, Klein, Dirac, Ehrenfest, Heisenberg, Brillouin, Pauli, Gamow, Landau. Sin ellos, la física de hoy seria distinta. Bohr tenía carácter jovial, como se le ve en estas fotografías, dando un paseo en la moto de Gamow y descansando en compañía de su esposa y del matrimonio Rutherford.

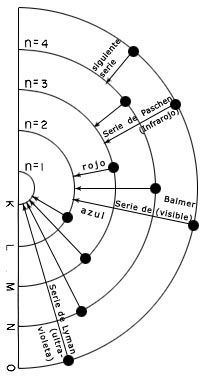
Ya en el siglo pasado se había observado el espectro del átomo de hidrógeno, con líneas en el infrarrojo (Paschen), en el visible (Balmer) y en el ultravioleta (Lyman). Como se ve en el esquema, cada una de estas series corresponde a una transición de un nivel de energía a otro: el electrón pasa de un estado al otro y emite un fotón. Qué tan grande es el brinco en energía, implica qué tan energética es la luz. y en consecuencia qué tan grande es la frecuencia. El brinco para la serie Lyman es mayor que para la serie Balmer. ¡Y todo este misterio espectral lo explica Bohr con sus postulados!
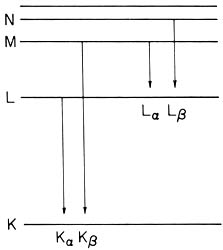
El espectro de los rayos X consta de dos partes: una, continua, que proviene del frenado de electrones rápidos y otra compuesta por líneas discretas de una frecuencia muy bien determinada. Cuando el átomo es muy pesado, los electrones que pueden brincar de uno de los estados de Bohr a los otros, lo hacen con una diferencia de energías apropiada, y con ello se explica el espectro discreto de los rayos X. La pregunta queda entonces: ¿por qué no ocurren estas transiciones en la situación ordinaria en que se encuentra el átomo con muchos electrones? La respuesta, como la veremos luego, la da el principio de Pauli, que postula que donde ya hay un electrón, no cabe ningún otro. Por lo tanto, habrá que sacar alguno de los electrones de los estados con energía más baja, para que otro pueda caer ahí, con la consecuente emisión del rayo X. La expulsión del electrón interno se logra haciendo chocar contra el átomo otros electrones de mucha energía, acelerados en el tubo de rayos catódicos.

El físico norteamericano Arthur Compton (1862-1962) corroboró las ideas cuánticas sobre la naturaleza de la luz. Con los rayos X provenientes de un anticátodo de molibdeno bombardeó los electrones de una placa de grafito y observó los rayos X emergentes en una dirección perpendicular al haz original. De sus resultados concluye: "El apoyo experimental de la teoría indica de manera muy convincente que un cuanto de radiación lleva con él momento y energía." Ganador del premio Nobel en 1927, Compton también efectuó trabajos sobre el origen de los rayos cósmicos, que apasionaban no sólo a los científicos sino también al gran público.

La familia de Louis de Broglie (1892) perteneció a la nobleza desde los tiempos de Luis XIV. Aunque De Broglie inicialmente estudió literatura e historia, su hermano Maurice, quien era físico, le contagió su entusiasmo por la investigación de las leyes naturales. Maurice acababa de regresar del Primer Congreso Solvay (1911), financiado por el "rey de la sosa cáustica", el belga Ernest Solvay y en el que tomaron parte todas las luminarias de la ciencia. Nernst, Poincaré, Langevin, Rutherford, Lorentz, Planck y Marie Curie están en primera fila de la fotografía y no es difícil reconocer a Einstein junto a ellos. Terminado el Congreso, Marie relató a Louis de Broglie los debates sobre el fotón y su naturaleza dual, de onda y partícula. De Broglie, ante los resultados de Compton, se preguntaba en la tesis doctoral que presentó en 1924 si acaso la inversa del efecto Compton sería cierta: si las ondas son partículas ¿no serán ondas las partículas? Al recibir el premio Nobel en 1929, Louis de Broglie diría: "Para ambas, materia y radiación, la luz en especial, es necesario introducir los conceptos de partícula y de onda a la vez. En otras palabras, se tiene que suponer siempre la existencia de partículas acompañadas por ondas."

En la figura de la izquierda se ve el patrón de difracción producido por los rayos X al chocar contra una hoja muy delgada de aluminio. En la foto de la derecha se ven los anillos de difracción que producen los electrones enviados contra la misma hoja de aluminio. La difracción, que es un fenómeno típicamente ondulatorio, se da tanto en las ondas electromagnéticas como en los electrones.

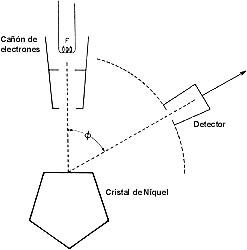
Clinton Davisson (1881-1952) y George Thomson (1892-1975), este último hijo de J. J. Thomson, descubridor del electrón, compartieron en 1937 el premio Nobel de Física por sus estudios de la difracción de electrones. Fue este un caso más en la historia de la ciencia en que se realizaron descubrimientos simultánea e independientemente. Y, también en el caso de Davisson, uno de esos descubrimientos "por accidente". Davisson, a quien vemos en la foto con su colega Lester Germer, estudiaba la reflexión de electrones por un blanco de níquel con el dispositivo que aquí se muestra. El experimento lo realizaban al vacío, dentro de un tubo. El tubo se dañó y el aire penetró en él, oxidando la muestra de níquel. Para limpiar el blanco, los físicos lo recalentaron, recristalizándolo. Poco después obtuvieron no sólo reflexión de electrones, ¡sino también difracción de partículas!

Si se incorporaran las ideas ondulatorias de De Broglie al modelo atómico de Bohr, resultaría natural pensar en aquellos casos en que la onda asociada al electrón se ajusta bien con la órbita, como se muestra en el esquema. De una idea tan simple surge la mecánica ondulatoria del físico austriaco Erwin Schrödinger (1887-1961, foto). La publicación del trabajo básico de Schrödinger, en que explicaba el espectro del átomo de hidrógeno basado en principios más fundamentales que los de Bohr, sufrió un retraso de un año por una causa interesante. La primera versión de la hoy famosa ecuación de Schrödinger, base de la mecánica cuántica, incluía efectos relativistas y los resultados no coincidían con los experimentos más o menos burdos de la época. Sólo al aproximar la teoría y hacerla no relativista, las cosas marcharon bien y se pudo publicar el artículo.
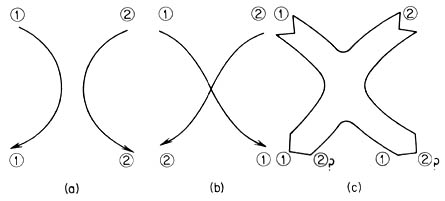

Si el electrón fuera una partícula clásica que siguiera las leyes de Newton como lo hace una pelota de futbol, su trayectoria estaría bien definida. Dos electrones idénticos podrían distinguirse siguiendo su recorrido en el tiempo, como en las partes (a) y (b) de la figura. Pero dos partículas cuánticas idénticas, son indistinguibles, y no sabemos cuál de los dos electrones nos hemos encontrado, como se indica en (c). El principio de incertidumbre, enunciado por el físico alemán Werner Reisenberg (1901-1977), quien aparece en la foto, es uno de los pilares básicos de toda la física moderna, y nos explica, entre otras muchas cosas, la indistinguibilidad de dos partículas idénticas.

En largos paseos y prolongadas desveladas, Bohr y Reisenberg discutían sobre la interpretación de la función de onda y, como se llama a la solución de la ecuación de Schrödinger. Fue realmente Marx Born, a la sazón maestro de Heisenberg, quien estableció el carácter probabilístico de la mecánica cuántica, postulando que el cuadrado de y indica la probabilidad de encontrar a la partícula descrita por esa función de onda. Con Max Born, uno de los grandes científicos del siglo xx, se cometió sin duda una injusticia. Él se queja amargamente de ello en su correspondencia con Einstein. A Born se le reconoce tardíamente, cuando le concedieron el premio Nobel en 1954, un cuarto de siglo después de sus contribuciones más importantes. Aquí vemos a Born (izquierda), a Max Van Laue de pie y a Otto Rahn, en la reunión de ganadores del Nobel, llevada a cabo en Lindau, RFA, en 1959.
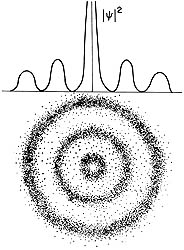
En este esquema se muestra el cuadrado de la función de onda y calculada matemáticamente luego de resolver la ecuación de Shrödinger, y se le compara con lo que se observa experimentalmente. La interpretación probabilística de |y|2 es difícil de evitar.
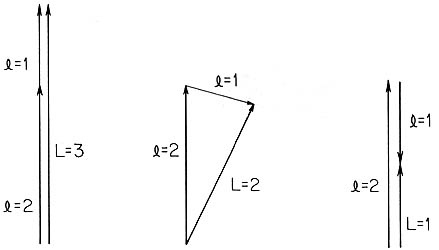
Como la fuerza, la velocidad lineal y muchas otras cantidades en física, el momento angular l es un vector, que nos da idea sobre la rotación de los sistemas físicos. Mientras mayor sea la velocidad con que los cuerpos rotan, mayor será su momento angular. Y la dirección del eje de rotación, que coincide con la de la velocidad angular, es la dirección del vector momento angular en condiciones apropiadas. En los sistemas macroscópicos, el momento angular puede tomar cualquier valor y dirección, pero en los átomos y otros sistemas pequeñitos, la magnitud de l sólo puede ser múltiplo entero de la constante de Planck h dividida entre el número 2p= 6.2832... Esto da origen a las órbitas especiales de Bohr y a lo que se llama el modelo vectorial del átomo, cuando se combinan los momentos angulares de dos o más electrones.
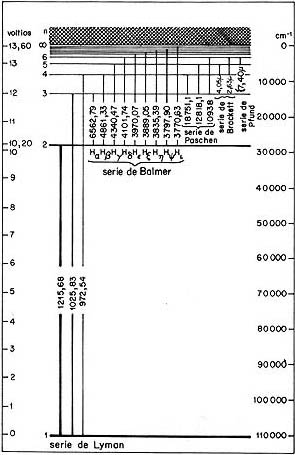
Mostramos nuevamente el diagrama de energías del átomo de hidrógeno, que ya presentamos ligeramente distinto al comienzo de esta sección.. Cuando el sistema pasa de un estado a otro, emite radiación electromagnética, cuya longitud de onda se expresa en angstroms. Nótese que este conjunto de niveles es el resultado de resolver la ecuación de Shödinger para un electrón que es atraído eléctricamente por una carga que no se mueve.
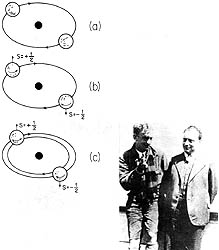
Wolfgang Pauli (1900-1958), crítico devastador de sus colegas, fue un físico precoz: antes de cumplir los veinte años ya escribía sobre la relatividad en forma tal que el mismo Einstein se asombró. Otro de los grandes maestros de físicos del siglo XX, Arnold Sommerfeld, lo educó en Munich; posteriormente, trabajó en el Instituto de Bohr en Copenhague y luego con Born en Gotinga. En 1925 enunció su principio, que permitió entender la estructura electrónica de los átomos complejos. En el esquema se ve la evolución del principio de exclusión de Pauli: en su versión original se postulaba que en cada órbita sólo cabían dos electrones (a); luego, se concluyó que los espines de esos dos electrones serían opuestos (b); y, finalmente, pequeñas interacciones magnéticas causan que las dos órbitas sean ligeramente diferentes. Por tanto, sólo hay un electrón en cada estado. El esquema está tomado del libro Treinta años que conmovieron al mundo, de George Gamow, gran divulgador de la física moderna, y a quien aquí vemos con Pauli alrededor de 1930.
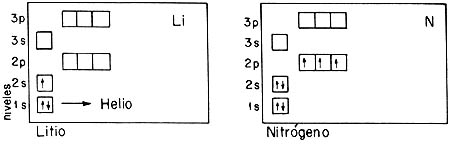
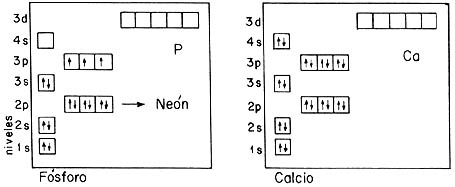
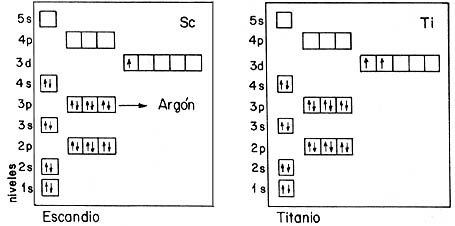
Este diagrama, en el que cada cajita representa uno de los estados orbitales de un electrón en el campo eléctrico de una carga positiva, nos permite entender la estructura electrónica de los átomos con muchos electrones. En cada caja colocamos dos flechas, correspondientes a un electrón con el espín hacia arriba y hacia abajo, respectivamente. Cuando se llena un bloque de cajas, se tiene el número de electrones necesarios para saturar una capa atómica. Se obtiene entonces un sistema inerte: un gas noble. En el diagrama se indica en cada caso lo que llamamos la configuración electrónica del átomo; para ello se usa una notación en la que el exponente asociado a una órbita indica la población en dicho estado orbital. Por ejemplo, el helio corresponde a 1S².
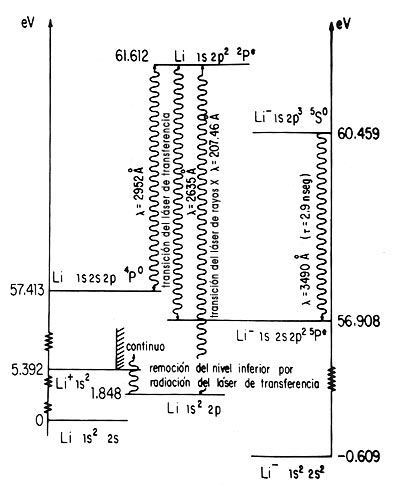
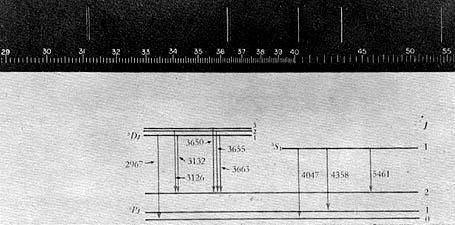
El ión negativo del litio en el estado atómico "A" fue caracterizado experimentalmente hace quince años. A principios de 1980, por medio de cálculos cuánticos, se descubrió en el Instituto de Física la estabilidad de otros dos estados del Li - que se indican como "B" y "C". Hasta entonces, la identificación de iones negativos se llevaba a cabo por medio de espectrómetros de masas, ya que los iones negativos conocidos no poseían espectro electromagnético. El Li (C), sin embargo, decae al Li (B) en 2.9 nanosegundos, emitiendo fotones de longitud de onda de 3 490 A. Revisando docenas de espectros de litio obtenidos durante la última década, Carlos Bunge pudo comprobar la presencia de una línea intensa en 3 490 A correspondiente a una vida de 2.9 nanosegundos, pero asignada a otra transición en el litio neutro. Cálculos similares, llevados a cabo por investigadores de la UNAM, demostraron que esta última transición debía ocurrir a 3 661 A y no a 3 490 A. Con este dato adicional y cálculos ulteriores de longitudes de onda de otras transiciones posibles en la misma región del espectro, pudo así identificarse ¡fuera del laboratorio! la existencia de Li negativo altamente excitado. Esta predicción teórica ( llevada a cabo con papel, lápiz y computadora) fue confirmada mediante una serie de experimentos directos hechos en el verano de 1980 en laboratorios de Suecia, Estados Unidos y Francia. Aquí se muestra el diagrama de niveles de energía de los iones negativos del litio, los que pueden ser importantes, pues dan la posibilidad de construir un láser de rayos X.
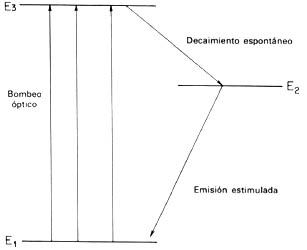
Como ya hemos visto, cuando un electrón en un átomo pasa de un nivel de mayor energía a otro menor, emite un rayo de luz cuya frecuencia es proporcional a la diferencia energética de los niveles. Esto es lo que ocurre, por ejemplo, en los tubos de descarga como los de neón en los que mediante dos electrodos se excita a los átomos haciendo que los electrones suban de nivel y después de un corto tiempo decaigan espontáneamente produciendo el espectro característico del neón. Si el descenso del electrón no ocurre de manera espontánea sino que es provocado o inducido por la incidencia de un fotón de la misma frecuencia, entonces se habla de una emisión estimulada de radiación el fenómeno base del láser (Light Amplification by the Stimulated Emission of Radiation). Desde el punto de vista práctico habrán de resolverse varios problemas para obtener el láser. Así, habrá de lograrse que la emisión estimulada sea mayor que la absorción, lográndose una verdadera amplificación de intensidad. Esto exige que la población de estados en el nivel de energía más alta sea mayor que en el inferior, lo cual se logra mediante el llamado bombeo óptico, que consiste en radiar el sistema de tal manera que la absorción de energía por los electrones del nivel más bajo los lleve hasta un nivel del que espontáneamente caerán, para luego sufrir el descenso láser, según se muestra en el diagrama adjunto.
Con estas ideas se construyó el primer láser de cristal rubí, que es óxido de aluminio con impurezas de cromo. Estas impurezas son justamente las que intervienen en el efecto láser, ya que los átomos del cromo presentan la característica de tener una banda amplia hacia la cual es posible bombear ópticamente, "esperar" la caída espontánea al nivel láser y, mediante la excitación, obtener la emisión de luz monocromática de longitud de onda 649.3 nm (619.3 x 10-9 m).

Posteriormente se han desarrollado otros tipos de rayos láser, como los de
gas, en los que el elemento que produce el efecto láser es un gas o una mezcla
de gases. Actualmente se cuenta con rayos láser de un gran número de longitudes
de onda, desde el ultravioleta hasta el lejano infrarrojo. Una de las posibles
aplicaciones de estudio del Li B, que antes mencionamos, es el diseño de aparatos
de rayos láser en la región de los 200 Å. Hasta ahora, el obstáculo principal
para fabricar un láser de longitud de onda inferior a 1 000 Å, ha sido la
imposibilidad de obtener cantidades apreciables de los estados láser, ya que
en esta región del espectro éstos tienen una vida medía muy corta, inferior
al nanosegundo. El Li B puede utilizarse como reservorio de energía, ya que
si bien posee una apreciable energía de excitación de 56.9 eV, tiene una vida
media relativamente larga, de unos 100 microsegundos. Esto representa un factor
de 5 más favorable que cualquier otro candidato que pudiera existir en la naturaleza.
El estado láser D del litio neutro se podría obtener en cantidades apreciables,
haciendo incidir sobre Li B un láser sintonizado a 2635 Å.

Gracias al principio de exclusión de Pauli es posible entender el lugar que los diversos elementos químicos ocupan en la Tabla Periódica de los Elementos. Átomos con configuraciones electrónicas semejantes tienen propiedades químicas similares. Aquí se muestra una tabla periódica en versión moderna.
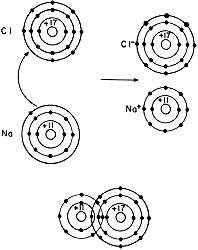
En la formación de una molécula por enlace iónico, un átomo cede un electrón tan gustoso como el otro lo recibe. Hecho el intercambio, la interacción electrostática entre los dos iones resultantes es inevitable. Los dos sentirán una atracción hasta que la repulsión entre los núcleos y nubes electrónicas la compense. Esta figura corresponde al caso del cloruro de sodio.
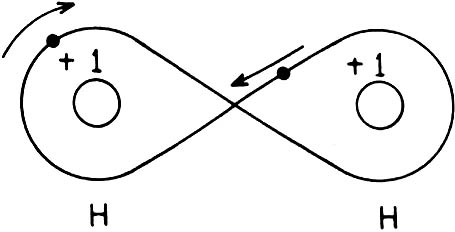
La molécula de hidrógeno es el ejemplo más simple de enlace covalente: los
electrones de sendos átomos son compartidos por ambos núcleos.
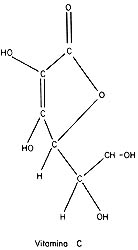
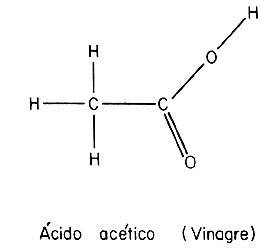
El carbono es uno de los elementos más afines a la formación
de ligaduras covalentes. En combinación con el hidrógeno forma la gran mayoría
de los compuestos que se encuentran en los seres vivos. De allí el nombre de
compuestos orgánicos y de química orgánica a la parte de la ciencia que estudia
dichos compuestos. Las figuras muestran, esquemáticamente, las ligaduras de
la molécula de ácido acético (vinagre) y de la molécula de vitamina C, formadas
por átomos de carbono (C), hidrógeno (H) y oxigeno (O).
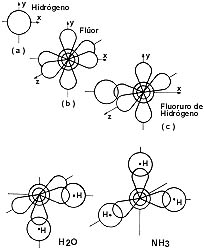
Las propiedades ondulatorias de los electrones y la inherente incertidumbre
en su localización en un punto del espacio, han permitido establecer modelos
que pretenden tomar en cuenta las predicciones de la mecánica cuántica utilizando
la idea de la nube electrónica y modelos aún más complejos en los que se incluye
la idea de la densidad de probabilidad, así como el concepto de ligadura. En
la formación de moléculas, resulta natural describir la nube de carga a partir
de los llamados orbitales atómicos que corresponden, en principio, a las nubes
de carga de los átomos que forman la molécula. Esto se ve así en las figuras
que ilustran el caso del fluoruro de hidrógeno (HF), el agua (H2O)
y el amoniaco (NH3). Las diferentes geometrías son tales que la energía
total es mínima, de modo que los orbitales de los átomos que se combinan se
traslapan lo más posible, es decir, forman una ligadura.
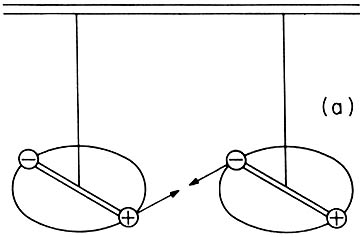
Esquema que pone en evidencia la interacción entre dos dipolos, no obstante que ambos sistemas son eléctricamente neutros.
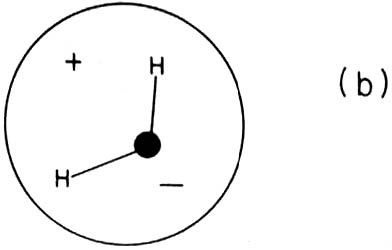
Cuando la distribución de carga electrónica no es simétrica
alrededor de su centro se origina una molécula polar, es decir, una molécula
que se comporta como un dipolo permanente. Un ejemplo típico es la molécula
de agua.
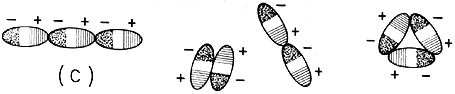
Gracias a esta propiedad, las moléculas de agua tienden a formar agregados
como el que se muestra esquemáticamente en el diagrama, siendo ésta la razón
por la que se forman las nubes y las gotas de lluvia.
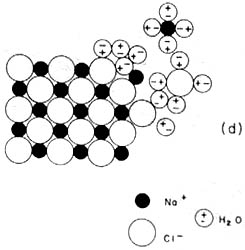
Las moléculas de agua pueden disolver la sal gracias a que son polares.
Atraen a los iones de la superficie del grano de sal, rodeando y separando sus
moléculas.

Johannes van der Waals (1837-1923) recibió el doctorado de la Universidad de Leyden en 1872 con una tesis sobre la naturaleza de las fases líquida y gaseosa, tema que atrajo su atención toda su vida. El problema que se planteó Van der Waals, fue encontrar una ecuación de estado que describiera con precisión el comportamiento de los gases reales. Explicó la desviación con respecto a la ley del gas ideal, tomando en cuenta el tamaño de las moléculas y la interacción entre ellas.

Dentro del área de física teórica en el Instituto de Física de la UNAM, un
grupo de investigadores se ha dedicado al estudio del comportamiento de los
niveles energéticos de los átomos y moléculas de un electrón confinados en cavidades
cuyo tamaño cambia. Este problema tiene relación directa con lo que sucede en
zonas de alta presión en donde existe una gran cantidad de hidrógeno, como por
ejemplo en el interior de las estrellas.

En el estudio de las fuerzas entre átomos y moléculas ha sido
posible establecer el efecto no-aditivo en las interacciones entre átomos
que no forman ligadura. El significado de la no-aditividad es que cuando hay
tres o más átomos próximos entre sí, la interacción
total no siempre es la suma de interacciones entre parejas de ellos. Como ejemplo
suponga que sobre una sábana extendida coloca primero una bola de billar
la sábana se curvará alrededor de la bola. En este caso decimos
que la interacción de las tres bolas no es aditiva. Mediante el análisis
de fuerzas no-aditivas entre átomos, Octavio Novaro demostró que
la formación de agregados o cúmulos se debe en buena parte a efectos
atractivos provenientes de la no-aditividad en la interacción. Este estudio
no solamente ha sido dirigido a los átomos, también se han analizado
efectos no-aditivos en complejos moleculares: trímeros de metano y amoniaco.

El osciloscopio es un tubo de rayos catódicos moderno. Su principio de operación es idéntico al utilizado hacia fines del siglo XIX por Crookes y Roentgen.

Microscopio electrónico propiedad del Instituto de Física de la UNAM. El potencial de aceleración es de 100 000 eV, máximo poder de amplificación de 106, resolución 14 Åy la columna requiere para su operación un vacío de 10-6 torr. Con este microscopio de muy alta resolución, Miguel José Yacamán y otros investigadores han hecho estudios cristalográficos de partículas pequeñas, importantes para entender la función de los catalizadores que aceleran las reacciones químicas.
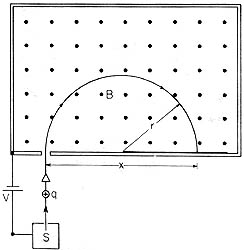
Principio del espectrómetro de masas, inventado en 1919 por el físico y químico británico F. W. Aston, quien fue discípulo de J. J. Thomson. En la cámara S se producen iones de cierta masa y carga. Un voltaje los acelera y hace entrar a un campo magnético de magnitud desconocida. Los iones describen una trayectoria circular y chocan contra una placa fotográfica colocada a cierta distancia de la apertura por la que entraron. Iones con la misma carga y diferentes masas chocarán a distintas distancias.

Espectrómetro de masas para iones pesados. El sistema de deflexión, la cámara
de blancos y toda la línea fueron diseñados y construidos en el IFUNAM.

Acelerador de iones pesados del tipo Colutrón, empleado para el análisis de mecanismos de transferencia de electrones en colisiones entre sistemas atómicos. El estudio de estos procesos es de gran importancia en el diseño de reactores de fusión para aumentar su eficiencia. En buena medida, este acelerador ha sido diseñado y construido en el IFUNAM por Carmen Cisneros e Ignacio Álvarez.

Acelerador de iones pesados tipo Van de Graaff. Con este dispositivo se logra
acelerar iones positivos hasta energías de 700 000 electrón-voltios. Este aparato
es utilizado fundamentalmente en el análisis de interacción de iones con sólidos,
como lo es la penetración de iones en diversos materiales para alterar algunas
propiedades físicas como su conductividad, su resistencia a la corrosión, su
composición estequiométrica, etcétera. Este tipo de experimentos resultan muy
atractivos debido a sus múltiples aplicaciones.
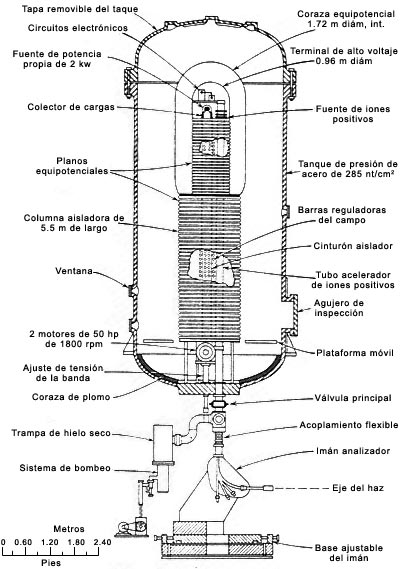
Robert Van de Graaff (1901-1967) diseñó y construyó en 1931 el primer acelerador de alto voltaje que lleva hoy su nombre. La Construcción original la hizo en el Instituto Tecnológico de Massachusetts utilizando latas, un listón de seda y un pequeño motor. En la actualidad, bajo el mismo principio, funcionan aceleradores mucho más complejos, como el que aquí se muestra.

En la época de la depresión y del cine sonoro, inaugurado por la película El cantante de jazz de Al Jolson, ya la mecánica cuántica se encuentra afirmada y empieza a aplicarse en el estudio de muchos sistemas: los sólidos el núcleo, los átomos complejos.

Enrico Fermi (1901-1954). Se doctoró con los máximos honores en la Universidad de Pisa, Italia, en 1922, en el tiempo en que Benito Mussolini tomaba el poder. En su trabajo posdoctoral fue discípulo de Bohr. Su vida siempre estuvo ligada con el estudio de las partículas neutras; él observó por primera vez una reacción en cadena, cuyo principal protagonista es el neutrón y que constituye la base de los reactores nucleares, el 2 de diciembre de 1942 en una cancha de squash de la Universidad de Chicago. Informó al respecto a la comunidad científica mediante un telegrama críptico enviado por Compton y que decía: "El navegante italiano ha entrado al Nuevo Mundo." Fermi fue quien también bautizó como neutrino a la partícula sin carga y sin masa que había predicho Pauli. Recibió el premio Nobel en 1938 por sus trabajos sobre los neutrones térmicos.

Acelerador de tipo Cockroft-Walton construido en el IFUNAM J. D. Cockroft y E. T. S. Walton desarrollaron un método muy ingenioso para obtener altos voltajes mediante transformadores eléctricos y bulbos a partir de una corriente alterna. Fueron ellos quienes produjeron la primera reacción nuclear mediante partículas aceleradas artificialmente, por lo que recibieron cl premio Nobel en 1951. Este acelerador se utiliza en el IFUNAM en el estudio de la rigidez, dieléctrica en el aíre, en polímeros y los halogenuros alcalinos mediante la producción de pulsos de muy alto voltaje (100 000 voltios).

El primer acelerador tipo Van de Graaff instalado en América Latina, fue el de la UNAM, que en un principio fue utilizado en el estudio de las reacciones nucleares.

La participación de México en el desarrollo de la física nuclear empezó con la utilización del acelerador Van de Graaff adquirido al iniciarse los años cincuenta. Aquí aparecen algunos de los investigadores precursores de este campo en México: Tomás Brody, Fernando Alba, Marcos Mazari y Carlos Graef Fernández.

El pabellón Van de Graaff tal como se veía en la recién construida Ciudad Universitaria en 1953.
Reacciones
A(P1, P2) B |
Fig. Ident |
UNAM 1960 |
UNAM 1963 |
M.I.T.1 |
Peso promedio1 |
Qm6 |
Q UNAM - Qm (keV) |
|
1961 |
1963 |
|||||||
He3(d, p) He4 |
1 |
18.434 ±0.010 |
18.380 ± 0.010 |
18.377 |
— |
18.352 |
+ 82 |
+28 |
Li6(d, a)He4 |
2 |
22.431±0.010 |
22.403 ±0.012 |
— |
22.386 ±0.011 |
22.375 |
+ 56 |
+28 |
Li7 (p, a)He4 |
3 |
17.406 ±0.030 |
17.373 ±0.014 |
17.357 ±0.010 |
17.346 |
17.347 |
+ 59 |
+26 |
Be9 (d, a)Li7 |
4 |
7.164 ±0.012 |
7.157 ±0.004 |
7.153±0.008 |
7.153 ±0.003 |
+ 11 |
+ 9 |
|
Be9 (d, p)Be10 |
5 |
4.598 ±0.012 |
4.595 ±0.004 |
4.590 ±0.009 |
4.587 ±0.005 |
4.590 |
+ 8 |
+5 |
B10 (d, a)Be8 |
6 |
17.850 ±0.006 |
17.830 ±0.006 |
— |
— |
17.818 |
+ 32 |
+12 |
B11 (d, a)Be9 |
7 |
8.036 ±0.009 |
8.035 ±0.009 |
8.023 ±0.010 |
8.024 ±0.004 |
8.028 |
+ 8 |
+7 |
B10 (d, p)B11 |
8 |
9.241 ±0.006 |
9.234 ±0.006 |
9.244 ±0.011 |
9.229 ±0.005 |
9.231 |
+ 10 |
+3 |
C13 (d, t)C12 |
9 |
1.317 ±0.005 |
1.311 ±0.006 |
1.311 ±0.006 |
1.310 ±0.003 |
1.310 |
+ 7 |
+1 |
C13 (d, p)C14 |
10 |
5.968 ±0.015 |
5.951 ±0.010 |
5.942 ±0.010 |
5.943 ±0.003 |
5.951 |
+ 17 |
0 |
N14 (d, a)C12 |
11 |
13.594 ±0.005 |
13.579 ±0.006 |
13.588 ±0.012 |
— |
13.574 |
+ 20 |
+5 |
N14 (d, p)N15 |
12 |
8.615 ±0.010 |
8.614 ±0.006 |
8.623 ±0.010 |
8.614 ±0.007 |
8.609 |
+ 6 |
+4 |
O16 (d, a)N14 |
13 |
3.108 ±0.008 |
3.110 ±0.006 |
3.111 ±0.002 |
3.115 |
3.111 |
- 3 |
-1 |
Na23 (d, a)Ne21 |
14 |
6.907 ±0.012 |
6.911 ±0.009 |
6.908 ±0.010 |
— |
6.913 |
-6 |
-2 |
Na23 (d, p)Na24 |
15 |
4.731 ±0.009 |
4.736 ±0.005 |
4.736 ±0.007 |
4.727 ±0.005 |
4.734 |
- 3 |
+2 |
Si28 (d, p)Si29 |
16 |
6.254 ±0.015 |
6.252 ±0.010 |
6.252 ±0.010 |
— |
6.253 |
+ 1 |
-1 |
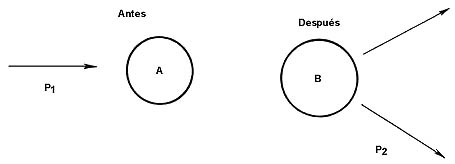
Algunas de las reacciones nucleares que han estudiado los físicos experimentales del IFUNAM. En esta tabla, los símbolos A (P1, P2) B tienen el significado siguiente : A es el núcleo blanco y P1 el proyectil. Luego de la reacción, A se transmuta en B y P1 en P2, se muestra en la figura.

A mediados de los años treinta, el barón von Weizsäcker propuso un modelo nuclear en que los protones y neutrones no interactuaban entre sí, pues sólo se veían sujetos a una fuerza promedio. Este modelo fue presentado en un artículo al Physical Review y... fue rechazado. El árbitro que usó esta famosa revista fue, nada menos que el gran Niels Bohr, quien desechó el modelo pues era inconcebible que siendo tan intensa la fuerza nuclear, los nucleones se movieran con facilidad dentro del núcleo. Cerca de doce años después, Maria Goeppert-Mayer y Hans Jensen resucitan la misma idea, estableciendo el modelo nuclear de capas, base de muchos de los avances logrados en la física del núcleo. La moraleja de esta historia es interesante: a veces en la ciencia es útil y conveniente no ser demasiado quisquilloso. El rechazo de Bohr retrasó, en buena medida, el avance de la física nuclear por algunos años. Aquí vemos a Maria Goeppert-Mayer con Ben Mottelson (a su derecha), Hans Jensen (a su izquierda) y Aage Bohr, este último hijo de Niels y a su vez físico nuclear famoso por inventar el modelo colectivo del núcleo, lo que lo hizo acreedor, junto con Mottelson, a recibir el premio Nobel en 1975.
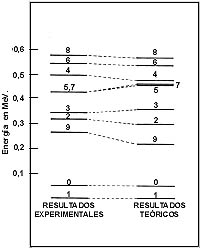
Comparación de los niveles de energía teóricos y experimentales para el 210Bi con fuerzas tensoriales.
Para calcular las energías de los diversos estados de excitación del isótopo 210 del bismuto, se incluyó una fuerza nuclear bastante compleja. Esto fue hecho por primera vez, usando el método de cálculo de Moshinsky, por los investigadores Jorge Flores y Pier Mello del IFUNAM, en 1963.

Acelerador Van de Graaff Tandem de 12 MeV instalado en el Centro Nuclear de Salazar, México.

El Centro Nuclear de Salazar, México. Al fondo se aprecia el edificio del acelerador y los talleres. Al centro, los laboratorios y servicios de cómputo. En primer plano, las oficinas, los cubículos y el auditorio.

Paul Adrien Maurice Dirac (1902- ). En principio ingeniero electricista, obtuvo su doctorado en matemáticas (Cambridge, 1926). Sus ecuaciones lo llevaron a concluir la existencia de una partícula en todo igual al electrón excepto por su carga eléctrica: el antielectrón. Esto podría extenderse a otras partículas: por ejemplo, debería existir el antiprotón, el cual no se "dejó ver" sino 25 años después de haber sido predicho. Estos trabajos le llevaron al premio Nobel en 1933, que compartió con Erwin Schrödinger.

Fotografía de la trayectoria de un positrón detectada por primera vez en la cámara de niebla por C. D. Anderson en 1932. El positrón penetra en la parte inferior mostrada por la fotografía siguiendo una trayectoria circular debido al campo magnético aplicado. La línea gruesa horizontal es una placa delgada de plomo empleada para frenar al positrón, lo que cambia el radio de curvatura de su órbita.

La relación entre masa y energía predicha por Einstein se verifica claramente en la "producción de pares" electrón-positrón cuando incide radiación muy energética sobre un material. En esta fotografía se observan las trazas dejadas por pares electrón-positrón creados por rayos gamma de 330 MeV. Obsérvense las trayectorias opuestas y simétricas.

Diagrama que muestra el intercambio de un mesón entre dos nucleones.

Hideki Yukawa (1907- ), izquierda, llegó a la conclusión de que el mensajero entre los nucleones debería ser una partícula alrededor de 200 veces más pesada que el electrón. Esta predicción la formuló en 1935. Al año siguiente, Anderson detectó una partícula de masa intermedia como ésta y la llamó mesón. Desafortunadamente no era la partícula esperada, sino otra que se descubrió 11 años después: el mesón p.



Tabla de algunas partículas elementales. Actualmente hay muchas conocidas como elementales y existen muchas maneras de clasificarlas de acuerdo a sus números cuánticos o su tipo de interacción, por ejemplo los fotones (electromagnéticos, espín entero); bariones (interacción fuerte y espín semientero), etcétera. Aún hay muchas nuevas partículas descubiertas y otras por descubrir.
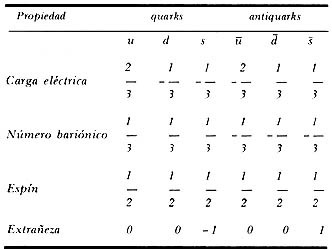
Tabla de las propiedades de los quarks, partículas básicas de las que, hipotéticamente, están compuestas los bariones y los mesones, Aun cuando en teoría los modelos que utilizan el concepto de quark han tenido mucho éxito al describir una gran variedad de fenómenos en la física de sus partículas elementales, los quarks aún no han sido observados experimentalmente. La tabla muestra los números cuánticos que caracterizan a los tres tipos de quarks y a sus correspondientes antiquarks, como se predijeron originalmente. Hoy tenemos evidencia de la existencia de otros dos tipos de quarks, el b y el c, y sospechamos de la presencia de un sexto quark el t.

Fueron los griegos quienes introdujeron el término krustallos que literalmente significa "hielo petrificado". Probablemente la razón es que conocían el cuarzo o cristal de roca y pensaban que se trataba de agua congelada, pues estos cristales se encontraban por lo general en lugares muy altos e inaccesibles como lo registra Plinio en su Historia natural: "Los cristales solo se encuentran en aquellos lugares altos donde la nieve invernal ha caído en gran cantidad y se ha hecho hielo y por esta razón los griegos le dieron este nombre." El mismo Plinio habla del cristal sexangulum, refiriéndose seguramente al cuarzo con sección transversal hexagonal que, por otra parte, es la forma más común en que se presentan estos minerales. El término cristal se aplicaba a los minerales que presentaban cierta regularidad geométrica y en este sentido, y a diferencia del término átomo, el vocablo sigue siendo más o menos válido hasta nuestros días.

Para experimentar con cristales es muy importante que crezcan en forma controlada, sabiendo sus defectos. Con este horno diseñado por Héctor Riveros, se crecen los cristales que usan para sus mediciones una buena cantidad de físicos experimentales del IFUNAM.
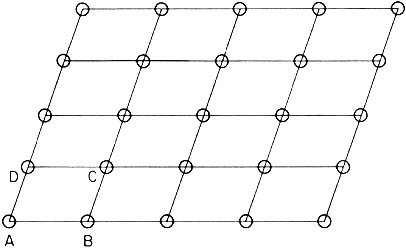
La periodicidad que caracteriza a una malla cristalina nos permite descubrirla con la celda unidad. Mediante translaciones de esta celda a lo largo de las direcciones que la definen, podemos reproducir todo el cristal. De acuerdo a la figura, el paralelogramo ABCD constituye la celda unidad del cristal bidimensional.

La Pirámide de los Nichos en Tajín, Estado de Veracruz, es un ejemplo de arquitectura prehispánica en el que dominan la simetría y la periodicidad. Como en un cristal, muchos de sus elementos arquitectónicos pueden caracterizarse por una celda unidad.
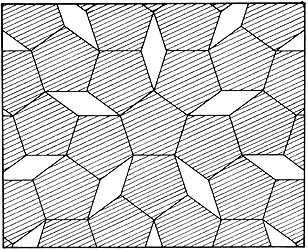
Imposibilidad de llenar con pentágonos regulares un plano.

Foto de una partícula pequeña cuya dimensión es de 50 Å. y en donde se observa claramente un pentágono. La foto fue obtenida por el grupo de microscopía electrónica del IFUNAM.
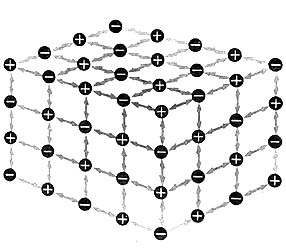
Esquema que muestra las fuerzas atractivas entre iones en un cristal iónico. Los cristales jónicos por excelencia son los halogenuros alcalinos como el cloruro de sodio.

Patrón de difracción de rayos X producidos por un monocristal de silicio. La periodicidad de la red cristalina y su simetría se aprecian evidentemente del patrón.

Esquematización de un cristal con ligadura covalente. La concentración de carga negativa entre los núcleos hace posible la estabilidad de la estructura, dada la atracción entre carga positiva y negativa ¡Nótese la diferencia entre este tipo de estructura y la iónica.!
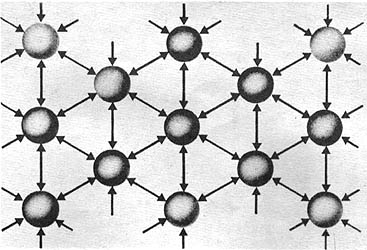
Los cristales metálicos tienen como característica un enlace colectivo, es decir, los átomos se atraen unos a otros gracias a los electrones casi no localizados, compartidos por todos los átomos.

Espectrómetro de resonancia paramagnética electrónica (RPE) propiedad del IFUNAM. El principio de operación de este aparato es, grosso modo, el siguiente: se irradia con microondas de frecuencia fija la muestra a estudiar, al mismo tiempo que se aplica un campo magnético cuya intensidad varía en el tiempo. Cuando el valor del campo magnético abre los niveles de energía a un valor igual a la energía proporcionada por las microondas, el electrón brinca de un nivel a otro, es decir, resuena. Este fenómeno ha sido utilizado por investigadores del Instituto para realizar, entre otros, un estudio sistemático del elemento Eu2+ (Enropio doblemente ionizado) en redes de halogenuros alcalinos y a partir de estos resultados proponer un modelo de lo que ocurre dentro del cristal.


Herederos del espectroscopio óptico inventado por Kirchhoff son estos dos espectrofotómetros modernos con los que cuenta el IFUNAM. A la izquierda, se ve uno de absorción atómica, con el que se determinan con gran precisión los elementos presentes en una muestra. En particular, se usa para medir el número de impurezas en un sólido. Con el espectrofotómetro de absorción óptica, que se ve en la foto inferior, se miden los espectros de emisión y de absorción de diversas muestras. En particular, se utiliza para analizar el efecto óptico que tienen las impurezas en un sólido.
Modelo simplista de un cristal que sirve, fundamentalmente, para el estudio de las vibraciones. En él, se considera a los átomos unidos por un resorte. Con este modelo se pueden estudiar modos de vibración, transversales y longitudinales.
Un electrón en un cristal puede interactuar con otro indirectamente gracias a los iones que lo rodean. En la figura, el electrón situado en el centro de la figura jala a los iones vecinos próximos, los que a su vez atraen al otro electrón.
Esta gráfica, hecha por Kamerlingh Onnes, muestra la resistencia en ohms de mercurio versus temperatura absoluta. Éste fue el descubrimiento de la superconductividad. (En el caso del mercurio a 4.2 K, la resistencia se anula y el material se transforma en un superconductor.)
Heike Kamerlingh Onnes (1853-1926), originario de Gröningen, Alemania, estudió en Heidelberg bajo la tutela de Bunson y Kierchhoff. doctorándose en 1879. En 1882 fue nombrado profesor de la Universidad de Leyden donde estableció el laboratorio de bajas temperaturas, en el que logró por primera vez obtener el helio líquido y alcanzar temperaturas tan bajas como 0.8 grados sobre el cero absoluto. Kamerlingh Onnes descubrió también la superconductividad, gracias a las bajas temperaturas logradas en su trabajo anterior. Recibió el premio Nobel de Física en 1913 por su trabajo sobre la licuefacción del helio. En la fotografía aparecen Kamerlingh y Van der Waals junto al licuefactor de hielo en el laboratorio de Leyden en 1911.