XI. LOS NUEVOS USOS
LAS RADIACIONES encontraron usos casi desde el momento de descubrirse, gracias a sus características tan especiales. Desde luego, está su poder de penetración, que dio lugar a las radiografías y al uso de radioisótopos como trazadores. Luego está su poder de ionización, que permitió la radioterapia y muchos usos industriales, como la esterilización conservación de alimentos y curado de plásticos. Su relación con la energía nuclear resultó en los reactores de potencia y en posibilidades de energía ilimitada. Sus efectos en las distintas substancias abre nuevas perspectivas en la ciencia de materiales.
Por otro lado, tienen la característica de afectar regiones microscópicas, átomos, electrones y núcleos. De hecho, se han convertido en la principal arma para investigar la materia, su estructura cristalina, la estructura de los átomos, de los núcleos y de los nucleones. Han sido piedra angular en el reconocimiento de leyes fundamentales de la física, como el principio de incertidumbre, la dualidad onda-partícula y el principio de exclusión. Permitieron el descubrimiento del núcleo, la búsqueda de nuevos elementos y la demostración de la estructura periódica de los sólidos.
En este capítulo vamos a describir cómo la radiación se emplea en técnicas analíticas muy finas, que son capaces de dar información que no se puede obtener con ningún otro método. Muchas de ellas son de aplicación reciente porque se basan en el desarrollo de métodos de generación, detección y análisis, los cuales siempre están mejorando y cada vez son más precisos y sensibles. La radiación está bien colocada dentro de la espiral de alta tecnología, cuyo desarrollo se da gracias a nuevos métodos que provienen de información más fina, que se obtiene aplicando a su vez la alta tecnología. Describiremos las técnicas de análisis por activación, la fluorescencia de los rayos X, la espectroscopía de electrones Auger, la retrodispersión de iones y la espectroscopía de iones secundarios.
El análisis por activación es un método de identificación de elementos químicos.
Con él se pueden medir concentraciones de partes por millón y mucho menos. Fue
posible emplearlo cuando comenzaron a fabricarse fuentes potentes de neutrones,
como los reactores nucleares y los aceleradores. El método consiste en colocar
la muestra que se desea analizar en un flujo intenso de neutrones. Estos producen
en ella reacciones nucleares de diversos tipos, y así transforman algunos de
los núcleos del material en otros que son radiactivos. Una vez que se retira
la muestra de los neutrones, queda activada y decae con la vida media de los
nuevos núcleos. Valiéndose de un detector de centelleo o de estado sólido, se
puede medir la energía de los rayos g que emite,
y esto, junto con la vida media, permite identificar el elemento. La cantidad
de rayos g que se mide depende de la cantidad del
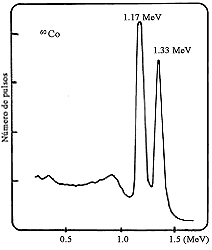
elemento que está presente. En la figura 51 se muestra un espectro típico de
rayos g provenientes de una muestra activada.
Para hacer un análisis cuantitativo preciso, se necesita conocer bien las condiciones del experimento; por ejemplo, el flujo de neutrones y su energía y la probabilidad o sección de activación. Si la vida media es corta, perderá actividad en el lapso en que se transporta la muestra de los neutrones al contador. Al contar los rayos g hay que corregir además por autoabsorción en la muestra, por radiación dispersada y por eficiencia del detector. En general las determinaciones se hacen por comparación con una muestra patrón que contiene una cantidad conocida del elemento.
Casi todos los elementos se pueden detectar por activación con neutrones, aunque para algunos elementos es más sensible que para otros. En ciertos casos difíciles existen otras posibilidades también basadas en reacciones nucleares, en que la activación se produce por protones, partículas a u otros proyectiles. Todos estos métodos se basan en que cada tipo de núcleo atómico tiene su propio modo de absorber radiación, sufrir transmutaciones y emitir fragmentos. Ni uno solo de éstos se repite entre núcleos diferentes, así que constituyen una huella digital que permite identificar elementos sin duda alguna.
La práctica del método generalmente se hace en reactores nucleares, para aprovechar el alto flujo de neutrones. Los reactores de investigación suelen estar provistos de un mecanismo neumático que transporta la muestra del corazón del reactor a los detectores con gran rapidez, para disminuir errores. También se puede llevar a cabo en un acelerador si se producen neutrones a propósito mediante alguna reacción nuclear como 3H + 2H ® 4He + n. Se fabrican aceleradores diseñados especialmente para este uso.
Las aplicaciones del análisis por activación son prácticamente ilimitadas. Es útil en cualquier caso en que se requiera un análisis de trazas de elementos. Esto puede abarcar muestras geológicas y arqueológicas; se puede usar en biología y medicina, en estudios hidrológicos y para medir la contaminación ambiental. Se ha usado para medir la concentración de elementos en aerolitos y muestras de la Luna; también para detectar la presencia de elementos raros en minerales.
Una de las grandes ventajas de la activación por neutrones, además de su gran sensibilidad, es que no destruye la muestra, y esto es particularmente importante cuando se trata de muestras únicas o irreemplazables, como las arqueológicas. La muestra puede quedar radiactiva, pero decae pronto, dependiendo de su composición, quedando esencialmente intacta. Por otro lado, tiene como desventaja su alto costo comparado con otros métodos, y, además, que no distingue compuestos químicos.
Aquí vale la pena hacer una digresión sobre cómo evaluar los distintos métodos analíticos. El usuario de cada técnica tiene la tendencia a afirmar que la suya es superior a cualquier otra, en buena parte para justificarse. La verdad es que depende del caso particular y de cada problema específico que se tiene que resolver. La activación por neutrones, por ejemplo, puede ser muy útil para un elemento, pero poco práctico para otro. En ese sentido todas las técnicas se complementan unas a otras. Algunas características que permiten averiguar qué técnica es la mejor para un análisis específico son las siguientes. La sensibilidad está relacionada con la mínima cantidad de un elemento que se puede detectar. Generalmente aumenta el costo si se requiere más sensibilidad, así que no conviene usar un aparato que rebase las necesidades del caso particular. Por ejemplo, si una muestra contiene 10% de un elemento dado, no tiene sentido usar un equipo que detecte partes por millón. El nivel de precisión de una técnica nos indica los errores cometidos al aplicarla, y por lo tanto qué tan confiables son los resultados. También la alta precisión va ligada con alto costo, y vale el mismo comentario sobre la determinación previa de los requisitos, a fin de no sobrepasarlos innecesariamente.
El tipo de información que se necesita de una muestra también determina qué técnica es más útil. El análisis por activación distingue elementos, pero no da información sobre qué compuestos químicos existen, sobre cómo son los enlaces químicos, ni si la muestra es cristalina o amorfa; para esto hay otras técnicas. La cantidad de información que da un solo análisis también es importante. Hay técnicas que analizan muchos elementos a la vez; otras que van de uno por uno, y por lo tanto son más tardadas. Algunos aparatos están diseñados específicamente para una substancia, por ejemplo, los monitores de monóxido de carbono en la emisión de un motor de combustión interna. Algunas veces puede requerirse información más detallada, como la localización precisa de una impureza, la profundidad de difusión de un gas en un sólido, la posición de un átomo en la red cristalina o la existencia de defectos en la red; cada uno de estos casos se puede estudiar con la técnica apropiada.
Desde el punto de vista práctico, cuentan la rapidez con que pueden obtenerse los resultados y la sencillez del procedimiento. También la forma física de la muestra es importante que sea compatible con el equipo. Un líquido, por ejemplo, no se puede introducir a un acelerador o a un microscopio electrónico para analizarlo con rayos X; habría que hacer antes una transformación química para convertirlo en sólido o en polvo, y en dicha transformación se puede perder parte de la información que se necesita. Desde luego, a todo esto hay que agregar la disponibilidad del equipo y el costo, factores que muchas veces son los determinantes cuando se selecciona una técnica. Sin embargo, si un país no quiere quedarse a la zaga del desarrollo tecnológico moderno, debe mantener, si no todas, por lo menos la mayoría de las técnicas analíticas en operación continua, segura y confiable. En la actualidad, en México este servicio lo cubren principalmente las instituciones de educación superior y las de investigación, aunque en algunos casos se tiene que recurrir al extranjero.
La fluorescencia de rayos X también da la composición química de una muestra.
Se ha usado ya por muchos años para analizar minerales. Ya sabemos que cuando
un átomo de una substancia se ioniza (lo cual puede ser provocado por partículas
a o b, rayos X o g,
protones, electrones, o iones pesados), al perder un electrón queda un hueco
en alguna capa electrónica. Este hueco es llenado por un electrón de una capa
más externa, menos ligado, y por lo tanto debe ceder energía. Un modo de hacerlo
es emitir un fotón con la energía que sobra, y si la transición es entre capas
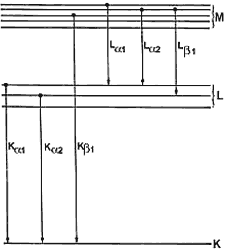
K, L o M, casi siempre corresponde a rayos X. La figura 52 muestra la estructura
de capas típica de un átomo, y se indican las transiciones más importantes con
emisión de rayos X. Ahora bien: cada elemento tiene una separación propia entre
niveles, así que la energía de los rayos X que emite es una marca característica
del elemento. Uno mide entonces esta energía para identificar los elementos
de una muestra.
En el Instituto de Física de la UNAM se usa este método provocando
la ionización inicial con un haz de protones (véase la Fig. 53). Estos proyectiles,
provenientes del acelerador Van de Graaff de 700 keV (Fig. 54), inducen la emisión
de rayos X, los cuales son recogidos por un detector de silicio con litio difundido,
que produce, por cada fotón que llega, un pulso de tamaño proporcional a su
energía. El resultado es un espectro de energías como el de la figura 55, en
que cada pico corresponde a una transición, y permite identificar tanto los
elementos que la produjeron como su abundancia. En un solo espectro aparecen
los picos de todos los elementos presentes; el método sirve para análisis simultáneo
de todos los elementos, desde el sodio hasta el uranio.

Figura 53. Detector de rayos X acoplado a la línea de un acelerador para observar los rayos producidos al ser bombardeada la muestra por el haz de protones.

Figura 54. Acelerador de Van de Graaff de 700 kV del Instituto de Física
de la UNAM; se emplea para estudiar superficies.
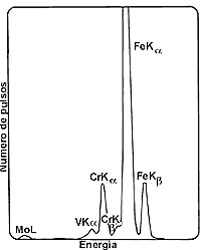
Figura 55. Espectro de energías de rayos X emitidos por una muestra de acero
al ser bombardeada con protones. Se distinguen con claridad los picos correspondientes
al fierro, cromo, vanadio y molibdeno.
Estrictamente hablando, se llama fluorescencia cuando la excitación o ionización inicial es causada por rayos X incidentes. Este método es el que se ha usado comercialmente por muchos años, especialmente en minería, para analizar las componentes de un mineral con gran sensibilidad. Se usa un tubo de rayos X y se lanzan éstos sobre la muestra que se desea estudiar. Los rayos X que ésta emite pasan luego a un cristal analizador, que separa por difracción las longitudes de onda y las emite a su vez en diferentes direcciones, de acuerdo con la ley de Bragg. El detector barre todas las direcciones de salida para identificar los picos. Con este método se tiene mayor sensibilidad, pero la cuantificación es mucho más difícil que si la ionización se efectúa con protones.
Si a un microscopio electrónico se le adapta un detector de silicio, se pueden ver los rayos X inducidos por el bombardeo con electrones. Esto tiene la gran ventaja de que, además de observar la muestra con una alta amplificación, se puede saber qué elementos contiene. Si además se sincroniza la salida de pulsos del detector con el rastreo del haz de electrones, es posible saber dónde están colocados los diferentes elementos. El aparato que hace esto se llama microsonda.
Así como la ionización o la excitación atómica pueden ser provocadas por distintas
radiaciones, también la desexcitación puede ser causada por un mecanismo distinto
de los rayos X. Se trata de la emisión de electrones Auger, que se muestra en
la figura 56. En el caso mostrado la ionización inicial se produce en la capa
K. Un electrón de la capa L pasa a llenar el hueco, pero en vez de emitir un
fotón, la energía que sobra se la transmite a un segundo electrón de la capa
L, que sale despedido con la diferencia de energías de las capas K y L. Este
proceso se denomina KLL porque en él entran un electrón K y dos L. Así como
en la fluorescencia, la energía con que sale el segundo electrón L (electrón
Auger) es propia de cada elemento. Para medirla se usa un analizador electrostático
(Fig. 57) que produce trayectorias curvas de los electrones y las selecciona
de acuerdo con su energía. Se obtiene una gráfica como la de la figura 58, en
que los picos corresponden a diferentes elementos.
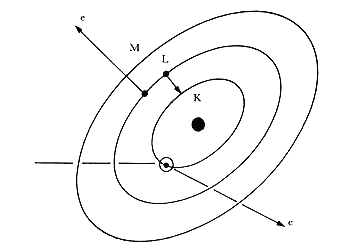
Figura 56. Mecanismo de desexcitación atómica emitiendo electrones Auger.
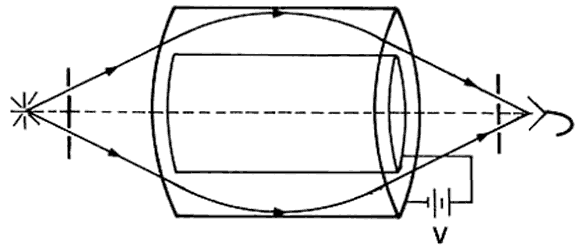
Figura 57. Analizador electrostático para medir las energías de los electrones
Auger. De los múltiples electrones que emite la muestra, sólo los de la energía
correcta logran pasar hasta el detector de la derecha.
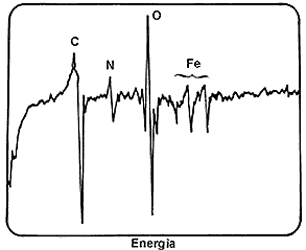
Figura 58. Espectro de energías de electrones Auger emitidos por una muestra de acero nitrurado. Se distinguen carbono, nitrógeno, oxígeno y fierro.
La espectroscopía Auger tiene la característica de que la energía de los electrones
es relativamente baja; si se produce un electrón Auger muy dentro de la muestra,
no logra salir. Por lo tanto, se deduce que cuando sale un electrón, éste proviene
de la superficie o cuando mucho de 4 o 5 capas atómicas por debajo. Este método
es, pues, muy útil para identificar elementos en la superficie de cualquier
sólido, y se ha convertido en la principal herramienta para esto. Las superficies
que manejamos normalmente están cubiertas por suciedad, grasa y vapores absorbidos,
que ni aun los solventes pueden eliminar fácilmente; hasta en alto vacío están
sucias. Por ello se usan presiones hasta de 10-13 de atmósfera (región
de ultraalto vacío) para estas determinaciones. Para la ionización inicial,
en la actualidad se usa la espectroscopía Auger en combinación con el rastreo
de un haz de electrones sobre la muestra. Así puede uno tener no sólo el análisis
de los elementos en la superficie, sino también su localización precisa. La
figura 59 muestra un microscopio Auger de barrido que se encuentra en el laboratorio
de Ensenada del Instituto de Física de la UNAM.

Figura 59. Microscopio de electrones Auger de barrido en el laboratorio de Ensenada
del Instituto de Física de la UNAM.
La emisión de rayos X y la emisión de electrones Auger son complementarias. En general, los elementos ligeros emiten preferentemente electrones Auger, y los pesados rayos X. De ahí que cada método es más sensible para diferente región de la tabla de los elementos.
Muchas de las técnicas analíticas que emplean radiación tienen una característica especial, a saber: que el estudio se hace a golpes. Esto se realiza de la siguiente manera: se lanza un proyectil que golpea la muestra, y luego se averigua cuáles son los fragmentos que salen del choque. Es algo así como si en boliche se colocaran los pinos en cualquier posición y de cómo se dispersan al lanzarles la bola se tratase de averiguar en dónde estaban originalmente y qué características tiene cada uno. Además, el jugador está ciego, pues no sabe siquiera en qué dirección lanzar la bola, ni cuántos pinos hay. Se recurre entonces a enviar un gran número de proyectiles y hacer estudios estadísticos.
Otro método que permite hacer análisis químico de una muestra es la retrodispersión
nuclear, llamada también de Rutherford, en honor de quien descubrió la existencia
de los núcleos con este proceso. Si se lanzan proyectiles ligeros como protones
o partículas a sobre núcleos, rebotan en ellos. La energía con que emergen después
del rebote depende de la masa del núcleo: cuanto mayor sea ésta, más energía
se llevará el protón. Esto se puede visualizar como un juego de canicas. Si
una canica le pega a otra igual, se reparten la energía, y siempre ambas se
mueven hacia adelante. En cambio, si se lanza la canica sobre una bola de boliche,
ésta se mantiene prácticamente inmóvil, y la canica rebota hacia atrás casi
con la misma energía que llevaba en un principio. Como se cuenta con medidores
de energía de protones (y otros proyectiles) muy precisos, es posible de esta
manera ir relacionando elemento por elemento con la energía del rebote. La figura
60 muestra un espectro de energías de protones rebotados en una película delgada
de plástico; cada pico corresponde a un elemento. El método es muy útil para
identificar elementos ligeros; los picos de los elementos pesados se amontonan
unos sobre otros, y esto dificulta la interpretación.
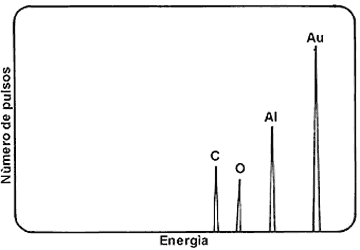
Figura 60. Espectro de protones retrodispersados por una película muy delgada
de un plástico con cubierta de aluminio y oro.
Hay técnicas que, además de identificar los elementos que contiene una muestra,
nos indican su localización. Desde luego, los microscopios, y especialmente
los electrónicos y las microsondas, nos dan una imagen con muchos aumentos de
la superficie, pero aquí nos vamos a referir a la localización por debajo de
la superficie, a cierta profundidad dentro del objeto. Una manera de hacerlo
es ir quitando capas y observar a cada paso los elementos que van apareciendo
en la superficie. Esto, sin embargo, destruye la muestra e impide otras clases
de observaciones o usos de ella. La retrodispersión de iones no destruye la
muestra y sí nos da información sobre su interior. Cuando los protones o partículas
a llegan a una muestra sólida, penetran en ella,
y con ello pierden energía poco a poco en el proceso. Por ejemplo, un protón
de 3 MeV penetra en cobre hasta 30 micras; una partícula a
de 3 MeV, 5 micras. En un sólido típico, 1 micra corresponde a unas 3 000 capas
atómicas. Cuando la retrodispersión sucede a cierta profundidad, el proyectil
ya perdió energía, y al regresar después del choque nuevamente pierde algo,
como lo muestra la figura 61. Entonces la energía con que se detecta la partícula
dispersada depende no sólo del elemento con que chocó, sino también de su profundidad
dentro del sólido. El espectro de energías que se obtiene es como el de la figura
62, que es esencialmente un perfil de la muestra.
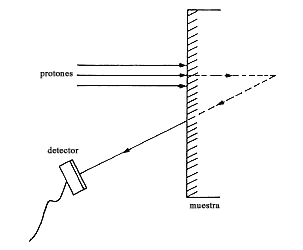
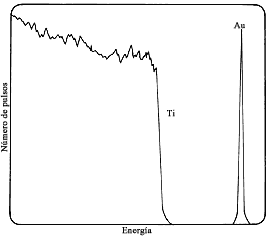
Figura 62. Espectro de energías de partículas a de
2 MeV dispersadas de una muestra de titanio sólida, con un recubrimiento muy
delgado de oro.
Desde luego, cuando uno de estos proyectiles penetra, además de retrodispersarse, puede producir rayos X, electrones Auger, partículas b, rayos g y otros productos de reacciones nucleares. Cada uno de éstos se puede observar y correlacionar con las propiedades de la muestra. Se puede determinar la abundancia, localizar impurezas y conocer perfiles, espesores de películas delgadas como óxidos, profundidad de átomos implantados y hasta estructura cristalina y daños en la red
Ya hemos visto que una superficie se erosiona cuando es bombardeada por iones. Esta erosión iónica se usa en combinación con las otras técnicas mencionadas, porque se puede ir quitando capa por capa de manera controlada, con mucha más exactitud que con un ataque químico o un desbastado mecánico. Si entre capa y capa se hace un estudio, por ejemplo de electrones Auger, se puede tener un perfil muy preciso de la composición. Muchos equipos de estudio de superficies traen integrado un cañón de iones para provocar la erosión, no sólo para ir quitando capas, sino también para limpiar las muestras al iniciar el experimento.
Cuando se erosiona una muestra, los átomos eyectados se pueden recoger en otra superficie para un análisis posterior, pero también es posible analizarlos durante su paso por el sistema de vacío. Si se les aplican en su camino un campo eléctrico y un campo magnético, se puede hacer que iones de distintas masas sigan distintas trayectorias. Éste es el método tradicional con que se han medido con gran precisión las masas atómicas. En el caso que nos interesa, es posible identificar la masa de cada uno de los productos de la erosión iónica, y con ello se obtiene la composición original. El proceso, llamado espectroscopía de masas de iones secundarios, tiene una alta sensibilidad y complementa los descritos previamente.
Las técnicas que hemos revisado aquí son sólo algunas de las muchas que hay para investigar la materia. Saltan a la vista varios puntos. Primero, todas son de alta sensibilidad, y no hay otros modos de obtener la misma información. Segundo, implican átomos individuales, los choques suceden uno por uno, aunque tal vez necesitemos millones de millones de ellos para concluir algo. Tercero, todas emplean tecnología avanzada, a saber: aceleradores o reactores, fuentes de iones, ultraalto vacío, alta precisión en la medición de campos eléctricos y magnéticos, detectores sensibles a distintas radiaciones, electrónica digital y computación.