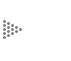I. CÓMO SOMOS Y POR QUÉ SOMOS COMO SOMOS
LA RADIACIÓN ionizante es atómica o subatómica. Proviene principalmente de los átomos y de sus componentes. También sus efectos se dejan sentir en los átomos y en sus partes. Por eso no es posible hablar de radiación sin antes haber visto aunque sea de manera general cómo es la estructura de la materia y cómo se comporta en el nivel más elemental. Habrá que aclarar que la descripción que sigue sólo pretende ser un punto de partida para analizar la radiación. Una descripción pictórica puede ser útil para visualizar los fenómenos, aun cuando no se apegue estrictamente al entendimiento actual de la física. El que quiera profundizar en el tema podrá consultar los abundantes libros especializados de física y química para estudiar en detalle el asunto específico que le interese. Sin embargo, las leyes de la naturaleza se siguen investigando en la actualidad; por eso, ninguna explicación será completa. El verdaderamente curioso podrá dedicar la vida entera a su investigación, y probablemente nunca llegue a comprenderlo en su totalidad. Baste entonces con que hagamos una descripción somera, inevitablemente incompleta, de lo que hoy en día se sabe de la estructura de la materia, conforme a lo que necesitamos, para abordar luego el tema de la radiación.
A lo largo de la explicación surgirán términos tal vez nuevos para el lector, y es posible que éstos se vayan sumando hasta volverse una maraña confusa. Por esta razón, a este capítulo se le ha dado una forma escueta, casi como de glosario, sin entrar en explicaciones que no sean pertinentes para el posterior desarrollo del libro. Los términos más importantes aparecen en cursivas para que el lector pueda después fácilmente recurrir a sus definiciones.
Comencemos con el átomo, originalmente pensado como indivisible, y que es la unidad más pequeña de un elemento que puede existir sola y conservar las propiedades químicas del elemento. Los átomos son extremadamente pequeños: miden aproximadamente 10-8 cm, y pesan alrededor de 10-24 g. Es claro entonces que cualquier objeto de uso común contiene un enorme número de ellos: una moneda de un gramo tiene cerca de 1024.
Para el lector que no esté familiarizado con la notación exponencial, diremos que el número 10 elevado a un exponente significa el número 1 seguido de tantos ceros como indica el exponente. Por ejemplo, un millón (1 000 000) se puede escribir como 106; mil (1 000) como 103. Cinco millones sería 5 X 106; ocho mil, 8 X 103. Esta notación nos permite escribir en forma abreviada cantidades tan grandes como el número de átomos en una moneda, 1024, con poco gasto de papel. Un exponente negativo como en 10-8 cm, el tamaño de los átomos, significa la fracción 1/108, o sea 1/100 000 000 de centímetro. Usaremos esta notación frecuentemente.
Regresando a los átomos, cada uno de ellos esta formado por un núcleo
y varios electrones; el número de estos puede llegar a sobrepasar los
cien. Casi todo el peso, o más correctamente la masa, del átomo esta concentrado
en el núcleo, en el centro, por lo que la posición del núcleo determina la posición
del átomo. El núcleo tiene carga eléctrica positiva, y los electrones negativa.
Es la fuerza eléctrica (las cargas opuestas se atraen) la que mantiene a los
átomos como unidad; y siendo más ligeros los electrones, éstos giran alrededor
del núcleo (véase la Fig. 1).
Los núcleos están formados por protones y neutrones, juntos como en un racimo de uvas. Los protones tienen carga positiva; el número de protones (Z) en un núcleo determina de qué elemento químico se trata. Los neutrones no tienen carga eléctrica; su presencia en los núcleos en número N contribuye a la masa nuclear. Protones y neutrones se llaman genéricamente nucleones; el número de nucleones (A) en un núcleo es igual a la suma del número de protones (Z) y el número de neutrones (N): A=Z+N.
Los núcleos atraen eléctricamente a cuantos electrones se requieran para balancear
su carga. Ahora bien: las cargas de protones y electrones son de igual magnitud,
pero de signo opuesto, así que un átomo neutro tiene tantos electrones como
protones.
| Elemento |
Simbolo |
Z |
Elemento |
Simbolo |
Z |
Elemento |
Simbolo |
Z |
Elemento |
Simbolo |
Z |
Elemento |
Simbolo |
Z |
| Hidrógeno |
H |
1 |
Titanio |
Ti |
22 |
Tecnecio |
Tc |
43 |
Gadolinio |
Gd |
64 |
Astatinio |
At |
85 |
| Helio |
He |
2 |
Vanadio |
V |
23 |
Rutenio |
Ru |
44 |
Terbio |
Tb |
65 |
Radón |
Rn |
86 |
| Litio |
Li |
3 |
Cromo |
Cr |
24 |
Rodio |
Rh |
45 |
Disprosio |
Dy |
66 |
Francio |
Fr |
87 |
| Berilio |
Be |
4 |
Manganeso |
Mn |
25 |
Paladio |
Pd |
46 |
Holmio |
Ho |
67 |
Radio |
Ra |
88 |
| Boro |
B |
5 |
Fierro |
Fe |
26 |
Plata |
Ag |
47 |
Erbio |
Er |
68 |
Actinio |
Ac |
89 |
| Carbono |
C |
6 |
Cobalto |
Co |
27 |
Cadmio |
Cd |
48 |
Tulio |
Tm |
69 |
Torio |
Th |
90 |
| Nitrógeno |
N |
7 |
Niquel |
Ni |
28 |
Indio |
In |
49 |
Iterbio |
Yb |
70 |
Protactinio |
Pa |
91 |
| Oxígeno |
O |
8 |
Cobre |
Cu |
29 |
Estaño |
Sn |
50 |
Lutecio |
Lu |
71 |
Uranio |
U |
92 |
| Fluoro |
F |
9 |
Cinc |
Zn |
30 |
Antimonio |
Sb |
51 |
Hafnio |
Hf |
72 |
Neptunio |
Np |
93 |
| Neón |
Ne |
10 |
Galio |
Ga |
31 |
Telurio |
Te |
52 |
Tantalio |
Ta |
73 |
Plutonio |
Pu |
94 |
| Sodio |
Na |
11 |
Germanio |
Ge |
32 |
Iodo |
I |
53 |
Wolframio |
W |
74 |
Americio |
Am |
95 |
| Magnesio |
Mg |
12 |
Arsénico |
As |
33 |
Xenon |
Xe |
54 |
Renio |
Re |
75 |
Curio |
Cm |
96 |
| Aluminio |
Al |
13 |
Selenio |
Se |
34 |
Cesio |
Cs |
55 |
Osmio |
Os |
76 |
Berkelio |
Bk |
97 |
| Silicio |
Si |
14 |
Bromo |
Br |
35 |
Bario |
Ba |
56 |
Iridio |
Ir |
77 |
Californio |
Cf |
98 |
| Fósforo |
P |
15 |
Kriptón |
Kr |
36 |
Lantano |
La |
57 |
Platino |
Pt |
78 |
Einstenio |
Es |
99 |
| Azufre |
S |
16 |
Rubidio |
Rb |
37 |
Cerio |
Ce |
58 |
Oro |
Au |
79 |
Fermio |
Fm |
100 |
| Cloro |
Cl |
17 |
Estroncio |
Sr |
38 |
Praseodinio |
Pr |
59 |
Mercurio |
Hg |
80 |
Mendelevio |
Mv |
101 |
| Argón |
Ar |
18 |
Itrio |
Y |
39 |
Neodinio |
Nd |
60 |
Talio |
Tl |
81 |
Nobelio |
No |
102 |
| Potasio |
K |
19 |
Circonio |
Zr |
40 |
Promecio |
Pm |
61 |
Plomo |
Pb |
82 |
Lawrencio |
Lw |
103 |
| Calcio |
Ca |
20 |
Niobio |
Nb |
41 |
Samario |
Sa |
62 |
Bismuto |
Bi |
83 |
|||
| Escandio |
Sc |
21 |
Molibdeno |
Mo |
42 |
Europio |
Eu |
63 |
Polonio |
Po |
84 |
Se llama número atómico (Z) al número de protones en el núcleo o al número de electrones en el átomo neutro. Nos identifica al elemento y sus propiedades químicas. El átomo del elemento más sencillo, el hidrógeno (Z = 1), consta de un protón y un electrón. En el siguiente, el helio (Z = 2), tiene el núcleo 2 protones y 2 neutrones (4 nucleones) y, por lo tanto, 2 electrones. Así sucesivamente se va conformando la tabla de los elementos, en donde Z va desde 1 hasta más de 100 (véase el cuadro 1).
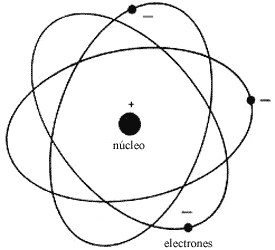
Las propiedades químicas de los elementos, o sea, su capacidad de unir sus
átomos a otros compartiendo electrones, están determinadas por la estructura
de capas de los electrones en los átomos (Fig. 2). La primera capa, llamada
K, la más cercana al núcleo, admite sólo dos electrones, por lo que se dice
que el helio (Z = 2) es de capa cerrada y no tiene actividad química. El siguiente
elemento, el litio (Z = 3), tiene la capa K llena y el electrón adicional está
en la capa L. Este electrón, más alejado del núcleo y más suelto, es fácilmente
compartido con otros átomos, lo cual da lugar a reacciones químicas. La capa
L se llena con 8 electrones, que sumados a los 2 de la capa K nos dan un total
de Z = 10, el neón, otro elemento inerte. No viene al caso aquí hacer un tratado
de química, así que baste con indicar en el cuadro 2 las capas más importantes
y cómo están distribuidos los electrones en los elementos más ligeros.
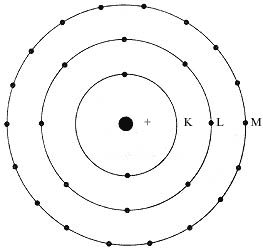
Figura 2. Estructura de las tres primeras capas electrónicas
de los átomos.
| elemento |
Z |
número de electrones
en capa K |
número de electrones
en capa L |
número de electrones
en capa M |
| H |
1 |
1 |
||
| He |
2 |
2 |
||
| Li |
3 |
2 |
1 |
|
| Be |
4 |
2 |
2 |
|
| B |
5 |
2 |
3 |
|
| C |
6 |
2 |
4 |
|
| N |
7 |
2 |
5 |
|
| O |
8 |
2 |
6 |
|
| F |
9 |
2 |
7 |
|
| Ne |
10 |
2 |
8 |
|
| Na |
11 |
2 |
8 |
1 |
| Mg |
12 |
2 |
8 |
2 |
| Al |
13 |
2 |
8 |
3 |
| Si |
14 |
2 |
8 |
4 |
Los electrones que se encuentran más cercanos al núcleo (por ejemplo los de
la capa K) están, por esta cercanía, fuertemente ligados a él. En términos técnicos,
decimos que tienen una gran energía de amarre, lo que equivale a decir que para
separarlos necesitamos mucha energía. La ionización es la acción de separar
completamente a un electrón del resto del átomo; requiere energía. La unidad
de energía que se usa en estos casos es el electrón-volt (eV), que es
la energía cinética que adquiere un electrón al atravesar por una diferencia
de voltaje de 1 volt. Por ejemplo, la energía de amarre del electrón en el hidrógeno
es de 13.6 eV; para ionizar el átomo de hidrógeno debemos impartirle esta energía
o más. En elementos más pesados (Z mayor) los electrones de la capa K tienen
energías de amarre mayores. El hierro tiene 7.1 x 103 eV, o sea 7.1
keV (kiloelectrón-volts); el uranio, 115.6 keV.
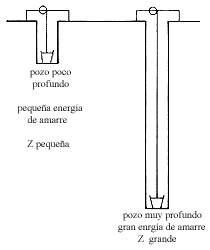
Figura 3. Podemos imaginarnos a los electrones muy amarrados como si estuvieran
en un pozo muy profundo, un electrón suelto estaría en un pozo poco profundo.
A veces se hace la analogía de una cubeta en un pozo. Si la cubeta está a gran profundidad cuesta mucho trabajo sacarla del pozo; si el electrón tiene gran energía de amarre se necesita mucha energía para ionizar. Cuanto más pesado es el elemento, la atracción eléctrica de núcleo y electrones es mayor, por lo que el pozo es más profundo. La figura 3 muestra este símil.
La acción de ionizar un átomo rompe su equilibrio eléctrico. Queda un electrón suelto por un lado y por otro un átomo al que le falta un electrón y por lo tanto tiene carga neta positiva; se le llama ion positivo. De inmediato se puede ver que este desequilibrio eléctrico afectará las uniones con otros átomos, o sea, las propiedades químicas.
La esencia de la que hemos llamado radiación ionizante es precisamente que tiene la capacidad de ionizar la materia. Para ionizar, la radiación debe llevar energía y poder transmitirla a la materia. Los principales cambios que se producen en la materia son en sus propiedades químicas.
La presencia de capas se debe a que en un átomo dado sólo pueden existir ciertas energías de amarre; cualquier otra es imposible. Éste es un resultado de la teoría cuántica de los átomos. Se dice que la energía está cuantizada, y se habla de niveles de energía. En el pozo del cual hablamos, equivale a que la cubeta sólo puede estar en ciertos peldaños, y el cambio de energía de amarre sólo puede hacerse de un peldaño a otro bruscamente. Cada elemento tiene su propia estructura de niveles o peldaños, por lo que identificar los niveles de energía equivale a identificar el elemento.
En un átomo dado los electrones pueden brincar de un nivel a otro. Si el nivel
original es más bajo que el final, se requiere energía para lograr la transición.
El paso de un nivel bajo a uno más alto se llama excitación electrónica.
Inversamente, el paso de un nivel alto a uno más bajo se llama desexcitación,
y en este proceso sobra energía. La figura 4 muestra esquemáticamente los niveles
de energía de un átomo y algunas transiciones tanto de excitación como de desexcitación.
La energía necesaria para excitar (ó para ionizar) un átomo se obtiene generalmente
de absorber radiación; la energía que sobra cuando se desexcita se va en forma
de radiación u otros mecanismos semejantes. Esta radiación que emiten los átomos
puede ser infrarroja, visible, ultravioleta o de rayos X.
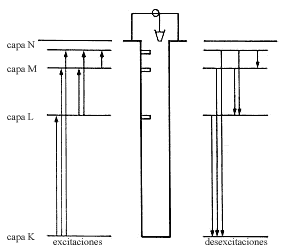
Figura 4. Las transiciones de un nivel atómico a otro son como
pasos bruscos
entre peldaños del pozo.
Habiendo visto cómo se acomodan y reacomodan los electrones en los átomos, regresemos ahora al núcleo, con sus Z protones y N neutrones. Si el radio de un átomo es como de 10-8 cm, el de un núcleo es de 10-12 cm, o sea 10 000 veces más pequeño. Esto equivale a que el volumen que ocupa un núcleo es 1012 veces más pequeño que el que ocupa un átomo. La fuerza que mantiene unidos a los protones v neutrones en el núcleo no es eléctrica, pues por un lado los neutrones no tienen carga, y por el otro los protones más bien se rechazan entre sí por tener todos cargas iguales (positivas). Esta nueva fuerza se llama fuerza nuclear, y es por lo menos suficientemente intensa para contrarrestar la repulsión eléctrica entre protones.
El número de protones (Z) y de neutrones (N) es variable en los distintos núcleos. Para empezar, Z y N suelen ser parecidos, especialmente en los elementos ligeros; en los más pesados N es mayor que Z. Esto se puede ver en la figura 5, que es un ordenamiento, respecto de Z y N, de los núcleos ligeros hasta el oxígeno. En la escala vertical aumenta Z, así que cada renglón corresponde a un elemento. En la escala horizontal está N. Cada cuadro corresponde a un tipo de núcleo, con sus correspondientes Z y N. El número en cada cuadro es el número total de nucleones, A = Z + N. La notación que se usa internacionalmente para identificar los núcleos es la siguiente: por un lado se usa el símbolo químico que identifica al elemento y determina su número atómico Z (el renglón en la Fig. 5); además, se pone un número pequeño en la esquina superior izquierda, que es el número A. Por ejemplo, el carbono más abundante es el 12C, que corresponde a Z = 6 y N = A - Z = 6. También se encuentra en la naturaleza el 13C, con Z = 6 y N = 7.
En la misma figura 5 se puede ver que a cada elemento (renglón) corresponden varios cuadros. Cada uno de éstos se llama isótopo, y cada elemento puede tener varios isótopos. Por ejemplo, el carbono tiene varios isótopos conocidos, del 9 a1 18. De todos éstos, únicamente el 12C, el 13C y el 14C existen en la naturaleza; los demás sólo se conocen por haberse creado artificialmente en los laboratorios. La generalidad de los isótopos naturales, que aparecen con un círculo en la figura 5, son estables; es decir, una vez que se produjeron al formarse la Tierra, no se han transformado en otro elemento. Existen en proporciones bien definidas; por ejemplo, de todos los núcleos de carbono que hay en la Tierra, 98.89% son 12C y 1.11% 13C.
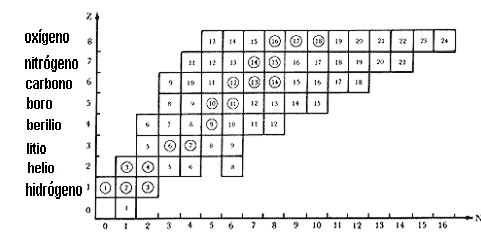
Figura 5. Tabla de los isótopos de los elementos ligeros. Cada renglón
corresponde a un elemento. El número de cada cuadro es el número total de nucleones
A. Los círculos indican isótopos naturales.
En cambio, los isótopos que no tienen círculo son inestables o radiactivos, lo cual significa que con cierta rapidez sufren cambios, siempre con emisión de radiaciones. Éstos no se encuentran en la naturaleza porque de haberse formado alguna vez, rápidamente hubieran decaído y desaparecido. Por eso sólo se conocen producidos artificialmente, en aceleradores o en reactores nucleares. De hecho, se conocen más isótopos artificiales: unos 1 850, contra 320 naturales.
El 14C merece una mención especial; es natural, pero a la vez decae. Lo que sucede es que está en constante producción a causa de la radiación cósmica que nos llega; pero también decae, de manera que se equilibran su creación y su desaparición, manteniéndose siempre en la Tierra una pequeñísima cantidad. Lo mismo sucede con el tritio, que es el isótopo pesado del hidrógeno, el 3H. Por otro lado hay algunos isótopos que se formaron con la Tierra hace miles de millones de años, pero decaen tan lentamente que todavía están con nosotros. Ejemplos son el 40K y los isótopos 234, 235 y 238 del uranio.
Podemos preguntarnos ahora qué sucede cuando un núcleo radiactivo decae. No puede simplemente desaparecer, pues tiene masa y carga eléctrica que no se pueden destruir. Lo que pasa es que se transforma en otro núcleo al emitir partículas alfa o beta, o rayos gamma.
Veamos la mecánica del decaimiento alfa (a)
con un ejemplo conocido, el del 235U. Este isótopo tiene la particularidad
de que fácilmente puede emitir partículas alfa, y al mismo tiempo se transforma
en un nuevo núcleo. La partícula a está formada de
dos protones y dos neutrones, como un núcleo de 4He; entonces
el nuevo isótopo que queda después de la emisión está disminuido en este número
de partículas. Se representa como sigue: ![]() .
La partícula a es despedida con energía de algunos
Mev (1 Mev es 106 eV), energía que proviene de la transformación
de masa en energía, según la conocida fórmula de Einstein: E = mc2.
Aquí E es la energía con que sale la partícula a, m es la masa que sobró entre
el isótopo original ( 235U ) y los fragmentos finales (231Th
+ a), y c2 es el cuadrado de la velocidad
de la luz. Nótese que el proceso sólo puede suceder si sobra masa (energía).
Además constituye una verdadera transmutación de elementos.
.
La partícula a es despedida con energía de algunos
Mev (1 Mev es 106 eV), energía que proviene de la transformación
de masa en energía, según la conocida fórmula de Einstein: E = mc2.
Aquí E es la energía con que sale la partícula a, m es la masa que sobró entre
el isótopo original ( 235U ) y los fragmentos finales (231Th
+ a), y c2 es el cuadrado de la velocidad
de la luz. Nótese que el proceso sólo puede suceder si sobra masa (energía).
Además constituye una verdadera transmutación de elementos.
El segundo tipo de decaimiento, el decaimiento beta (b)
, implica la emisión de una partícula b, que es un
electrón pero que puede tener carga positiva o negativa. Como la masa del electrón
es 1 840 veces más pequeña que la de los nucleones, la emisión b
no implica cambio en A. Sin embargo, Z sí cambia. Si un núcleo emite una beta
negativa (b-), perder una carga negativa
implica ganar una positiva y su Z aumenta. En cambio, si emite una beta positiva
o positrón (b+) disminuye su Z.
Un ejemplo es el 60Co, que se usa ampliamente para irradiar: ![]() .
El decaimiento b siempre va acompañado de la emisión
de una nueva partícula, el neutrino, que no tiene carga ni masa, pero
que sí comparte la energía sobrante con la b.
.
El decaimiento b siempre va acompañado de la emisión
de una nueva partícula, el neutrino, que no tiene carga ni masa, pero
que sí comparte la energía sobrante con la b.
El decaimiento gamma (g) es un mecanismo que tienen los núcleos de expulsar energía cuando sobra ésta después de un decaimiento a o b. Esta expulsión es en forma de un fotón, que es la unidad de radiación electromagnética, como la luz, los rayos ultravioleta e infrarrojos y los rayos X. Al igual que en el átomo, en el núcleo existen niveles de energía. La desexcitación de un nivel alto a un nivel bajo en este caso va acompañada de la emisión de un rayo g.
Muy recientemente se han encontrado pruebas de una nueva emisión radiactiva natural. El radio 223Ra emite partículas de 14C, perdiendo en el proceso 6 protones y 8 neutrones en forma de racimo. Esta radiactividad nueva es muy rara; se necesitó un experimento que duró 600 días para observarla.
Definitivamente el decaimiento más violento es la fisión nuclear, en que un núcleo se divide en dos partes casi iguales. Los dos fragmentos salen despedidos con gran velocidad. Estos procesos son también muy raros en la naturaleza, pero pueden ser inducidos en el laboratorio. Los fragmentos casi siempre son núcleos inestables que a su vez luego decaen por emisiones b y g. Además de los dos fragmentos de fisión, salen 2 o 3 neutrones.
Aparte de los decaimientos nucleares que suceden espontáneamente en la naturaleza, el hombre se las ha ingeniado para inducir artificialmente transformaciones de unos núcleos en otros, mediante reacciones nucleares. En este caso se lanza un proyectil sobre un núcleo y se observan los núcleos que salen de esa unión. Por ejemplo, en 18O + p ® a + 15N se lanza un protón energético sobre un núcleo de 18O y se observa que el producto de esta reacción es un 15N y una partícula a. Las reacciones nucleares han sido la herramienta más poderosa para estudiar la física de los núcleos.
A medida que se han perfeccionado las técnicas para la investigación nuclear, se han descubierto muchas partículas más, que sólo mencionaremos de paso, pues si bien son fundamentales en el entendimiento de la estructura de la materia, para nuestro objetivo desempeñan un papel secundario. Así, tenemos los mesones m o muón, p o pión, K o kaón, y h o eta, todos de masa intermedia entre el electrón y el protón. Más pesados que el protón y el neutrón son los hiperones L, S, X, W (lambda, sigma, xi y omega). Por otro lado, se sabe ahora que los nucleones están formados cada uno por tres cuarks.
Habiendo visto las partes del átomo y, a su vez, del núcleo e incluso de los nucleones, vayamos ahora en la dirección opuesta: cómo se agregan los átomos para formar los materiales. La forma más elemental en que se unen los átomos es por parejas, como, por ejemplo, el oxígeno, en que dos átomos se unen, compartiendo electrones, para formar una molécula. En el agua la molécula está formada por dos átomos de hidrógeno y uno de oxígeno, H2O, que es la unidad más pequeña de este compuesto químico que se puede encontrar. En virtud de los enlaces químicos, las moléculas pueden contener hasta muchos miles de átomos, como en el caso de los polímeros, que consisten en gran número de repeticiones de una unidad básica, en forma de cadenas, las cuales a su vez pueden entrelazarse, unirse y trenzarse. La materia orgánica está formada por estas cadenas, en que el eslabón principal es el átomo de carbono.
La mayoría de las substancias inorgánicas están formadas por apilamientos regulares de átomos llamados cristales, en que los átomos se acomodan guardando entre sí una posición que se repite en todas direcciones, como si estuviesen en los vértices de la estructura de acero de un gran edificio. Hay 14 diferentes tipos de estructura en que se pueden acomodar. Esta regularidad explica por qué en los diamantes, por ejemplo, o en los granos de arena, se notan facetas bien definidas.
Es de notarse que todas las propiedades macroscópicas, y por lo tanto las posibilidades de uso de los materiales, están determinadas por las estructuras que hemos mencionado, tanto atómicas y subatómicas como multiatómicas. Peso, color, estabilidad dimensional, conductividad eléctrica, dureza, elasticidad, densidad, fosforescencia, magnetización, reactividad química, brillo, radiactividad, porosidad, transparencia y muchas características más: todas vienen a final de cuentas de la estructura. Una vez comprendido cómo somos y por qué somos así, vayamos ahora a lo que nos trae aquí: la radiación.