INTRODUCCIÓN
El hombre, en su afán de lograr mejores condiciones de vida, ha usado constantemente su ingenio durante su larga historia. Para lograr tal objetivo, mucho lo ha debido al uso de metales que ahora forman parte de nuestra vida cotidiana y, casi sin quererlo, hemos creado una dependencia tal que sería imposible hablar del desarrollo y avance de la civilización moderna sin el uso de metales y aleaciones.
Desde muy temprano por la mañana hacemos uso del metal, en los grifos del agua para asearnos, con sus recubrimientos de níquel y cromo, en los utensilios de la cocina, tales como los sartenes, cuchillos, cucharas, etc. Aun cuando lo olvidemos, sabemos que nuestra casa, así como todos los demás edificios, sean éstos pequeños o impresionantes rascacielos, están estructurados de acero, el cual actúa como un verdadero esqueleto que conforma, soporta y da resistencia a la construcción. Para el traslado a nuestro trabajo, lo hacemos usualmente en un medio de transporte fabricado en su gran totalidad de metal: autobús, coche, tren, etc. Si, mientras viajamos hacia nuestro trabajo, nos detenemos a pensar por un momento en la cantidad de metal que usa el transporte en el que vamos, nos sorprenderíamos al enterarnos de que es inmensa la cantidad de éste empleada en la carrocería, en el motor, con todo y sus componentes; incluso en el sistema de energía, como lo es el acumulador, encontramos metal en forma de láminas de plomo sumergidas en un medio ácido. Lo mismo podemos decir de los aviones que surcan los cielos actualmente, de los medios de transporte espaciales modernos y de los satélites, hechos todos ellos de aleaciones metálicas muy especiales.
Aquellos que laboran en una industria, se percatarán de que casi toda la instalación productiva está constituida de diversos metales: grandes reactores donde ocurren las transformaciones químicas operando a presiones y temperaturas elevadas, tuberías que transportan las materias primas así como los productos, tanques de almacenamiento, bombas, etc.
Por todo esto podemos decir, sin temor a equivocarnos, que aun y cuando se nos escape de la conciencia, vivimos en una civilización basada en el metal y que por lo tanto requerimos que los materiales metálicos en los cuales está basada dicha civilización industrial sean estables en nuestra atmósfera terrestre y que al menos duren en uso varios años.
Sin embargo, nosotros sabemos por experiencia que las cosas no son así. Los metales se degradan inexorablemente con el tiempo de muy diversas formas, dejan de ser funcionales, perdiendo sus propiedades decorativas o mecánicas. Algunos simplemente se disuelven en su totalidad en el medio que los envuelve.
De lo que muy poco nos percatamos es que el hombre desarrolla un esfuerzo grandioso para evitar que los metales de uso industrial básico para la sociedad se deterioren y vuelvan a su estado original (es decir, de metal combinado con algunos otros elementos activos tales como el oxígeno, azufre y cloro). Veremos más adelante que salvo contados metales, la mayoría de ellos son inestables en muchos de los ambientes encontrados en la Tierra. La misma atmósfera, el agua del mar, salmueras, las soluciones ácidas, neutras o alcalinas y cientos de otros ambientes causan el retorno del metal hacia una forma más estable, similar a la de los minerales.
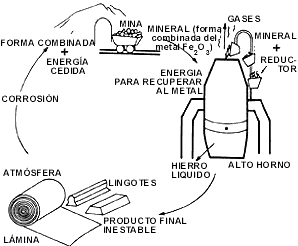
El hombre invierte mucha energía para extraer el metal de los yacimientos encontrados en la Tierra. Pensemos en el balance térmico global empleado durante la extracción del hierro en los altos hornos a partir de un mineral de hierro oxidado, tal como la hematita, Fe2O3. Aquí el hombre invierte grandes cantidades de energía termoquímica con el fin de liberar el hierro del oxígeno con la ayuda de coque (carbono), obteniéndose como productos la liberación de bióxido de carbono, C02, escoria y el hierro primario, también llamado arrabio. En otros muchos procesos pirometalúrgicos tales como aquellos empleados para obtener cobre, zinc, níquel, plomo y otros metales, el consumo de energía ocurre de una manera similar. En estos procesos también se utilizan calor y atmósferas calientes como fuentes de energía para facilitar la obtención del metal. Otra manera alternativa para recuperar ciertos metales consiste en la descomposición de un electrolito por medio del paso de corriente eléctrica. Un electrolito es un medio iónico conductor de la electricidad. Puede ser una disolución acuosa de una sal conteniendo al metal de interés, por ejemplo, sulfato de cobre, o bien la misma sal fundida, la alúmina u óxido de aluminio como ejemplo. Esta descomposición ocurrirá, como se mencionó, por el efecto del paso de una corriente eléctrica a través del electrolito, dando como principal producto el depósito, en uno de los electrodos, del metal que estamos interesados en recuperar. De ésta y otras muchas maneras el hombre obtiene metal en forma libre, consumiendo por ello grandes cantidades de energía.
Sin embargo, y como el lector puede deducir, el estado de existencia más estable
para un metal es su forma combinada, o dicho desde un punto de vista termodinámico,
es el estado de más baja energía, ya sea en forma de óxido, sulfuro, cloruro,
sulfatos o carbonatos. En realidad lo que nosotros hacemos para extraer el metal
es ir en contra de una reacción que ocurre espontáneamente en la naturaleza,
por ejemplo, la reacción de formación de un mineral oxidado. Muchas de las formas
combinadas de los metales han permanecido tal y como las encontramos ahora por
muchos miles de millones de años. Es muy posible que cuando los elementos aparecieron
en el universo, poco tiempo después de la creación de éste, hará aproximadamente
unos 15 mil millones de años, muchas de las especies metálicas comenzaron a
reaccionar con otros elementos recién formados. Con el paso del tiempo y con
la formación y estabilización de galaxias y sistemas solares, muchos planetas,
y entre ellos el nuestro, acumularon una gran cantidad de metales en su interior,
que fueron reaccionando con el medio ambiente y con la atmósfera reinante entonces.
El paso de metal a forma combinada fue cosa de millones de años. Lentamente,
el metal iba pasando de un estado inestable a uno más estable que es la forma
combinada. Aunado a esta transformación espontánea venía un cambio en
energía. El sistema en proceso de transformación cedía energía lentamente y
pasaba a un estado de energía mínima, a un estado estable, en equilibrio. Industrialmente
lo que hacemos hoy en día es suministrar al mineral o mena una cantidad de energía
equivalente a la que la reacción cedió a través de mucho tiempo para pasar a
la forma combinada. Al obtener un metal en forma libre volvemos al estado inicial.
El metal libre, poseyendo una energía elevada y con fuertes tendencias a bajarla,
tenderá a estabilizarse, reaccionando con el medio ambiente y volviendo a su
forma de mineral original. El cobre, el cinc, el níquel, el cromo, el hierro,
el aluminio, el plomo, el estaño y la mayoría de los metales ingenieriles que
usamos, sufren esa tendencia después de ser obtenidos en su forma libre. Se
puede decir, como una aceptable generalización, que cuanto mayor haya sido la
cantidad de energía invertida en la obtención de un metal a partir de su mineral
(térmica, eléctrica o de otro tipo), mayor será su tendencia a volver a combinarse
para estabilizarse. Figura 1.
Es interesante el pensar que un pedazo de metal puede permanecer estable por un período indefinido, si es que se le mantiene en el vacío, es decir, en donde el metal no entre en contacto con ningún medio o sustancia, incluyendo al aire por supuesto. Parece ser que la gran mayoría de los metales adquieren esa estabilidad tan deseada sólo cuando se les aisla del ambiente terrestre. Si este aislamiento no ocurre, los metales pueden reaccionar con el medio ambiente y formar compuestos tal y como lo mencionamos anteriormente. Estos compuestos permanecen sobre la superficie del metal y son por lo general frágiles, de mal aspecto y fácilmente desprendibles, por ejemplo los óxidos del hierro, lo que origina una transformación continua del metal al repetirse periódicamente el proceso de oxidación. Sin embargo, esta forma de degradación metálica no es la única. Existen muy diversas formas por las cuales un metal o aleación deja de ser útil a consecuencia de su inestabilidad frente al medio. El metal bien puede disolverse lentamente y llegar a transformarse totalmente en otra especie (corrosión uniforme).
Asimismo, los metales, bajo ciertas condiciones, pueden formar grietas y romperse catastrófica y súbitamente al estar sujetos simultáneamente a un medio agresivo y a un esfuerzo mecánico moderado (corrosión bajo tensión). También pueden ser atacados muy localizadamente en forma de pequeños agujeros profundos que avanzan rápidamente, llegando a perforar gruesas secciones de estructuras metálicas, haciendo a éstas deficientes en sus propiedades mecánicas e inutilizándolas por completo (corrosión por picaduras). Los metales también pueden sufrir de fatiga con la consecuente pérdida de resistencia cuando son sometidos a esfuerzos periódicos (corrosión, fatiga) o fragilizarse súbitamente y ser inoperativos (fragilidad por hidrógeno). Es entonces precisamente cuando todos los conocimientos que se tienen de la lucha contra la corrosión deben de ser aplicados para que un metal o aleación perdure más años en servicio, sin transformarse rápidamente en formas combinadas (óxidos, sulfuros, etc.) o en sistemas degradados localizadamente que no cumplan con los requisitos exigidos a los metales o aleaciones originales, tales como resistencia, dureza, lustre, apariencia, etc.
Para tal fin se emplean diversas técnicas de protección tales como la alteración superficial de los metales, consistente en crear o provocar una barrera protectora producto del mismo metal, como es el caso del anodizado. En este proceso el metal puesto a proteger se oxida electrolíticamente, es decir, se le somete a condiciones tales que produce una película superficial de óxido del mismo metal, óxido que por lo general es de apariencia agradable, transparente, duro y muy protector; ejemplo, el aluminio anodizado. Asimismo, un metal dado puede combinarse o alearse con otros metales, no tanto con el fin de conseguir una alteración benéfica en sus propiedades mecánicas, sino para mejorar su resistencia a algún tipo de corrosión. Un ejemplo típico lo constituye el acero inoxidable, en donde el hierro se combina con elementos tales como el cromo, níquel, molibdeno, etc, los cuales incrementan notablemente la resistencia de esa aleación a degradarse químicamente.
También se puede aislar físicamente al metal del medio en que se encuentra expuesto. Esto se efectúa por medio de recubrimientos aislantes como las pinturas anticorrosivas. La mayoría de estas pinturas contienen, aparte de los elementos de una pintura convencional, sustancias que inhiben activamente el deterioro de un metal por corrosión, en caso de que la pintura presente algún defecto tal como porosidad, fractura, etc.
Debido a que los procesos de corrosión son en esencia electroquímicos, es decir, transformaciones químicas que se llevan a cabo en presencia de diferencias de potencial eléctrico (tema que trataremos con más detalle en los capítulos siguientes), también se puede alterar la velocidad de corrosión de un metal al modificar las diferencias de potencial eléctrico existentes. A las técnicas que tratan acerca de este sistema de protección metálica se las conoce como protección catódica y anódica. Por último, al proceso de aplicar ciertas sustancias orgánicas e inorgánicas a la superficie del metal, que adhiriéndose a ella aminoran la velocidad con que el metal se transforma a un compuesto poco servible, se le conoce como inhibición de la corrosión.
Queremos poner énfasis en que la estabilidad de los metales está determinada por lo que sucede en la interfase entre el metal y el medio agresivo y que, en muchos casos, la resistencia interna de un metal está influenciada a largo plazo por los sucesos que suceden en esta interfase. La mayor parte de las degradaciones que un metal o aleación sufren en su apariencia o en su resistencia mecánica comienza pues en su superficie.