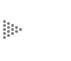II. ¿POR QUÉ EXISTE LA CORROSIÓN?
EN EL capítulo anterior hemos visto una serie de casos
que suelen presentarse con cierta frecuencia en la vida diaria, todos ellos
atribuibles a la corrosión.
Ahora bien, uno puede preguntarse ¿por qué existe la corrosión? Podemos empezar diciendo que la corrosión de los metales es en cierto sentido inevitable, una pequeña venganza que se toma la naturaleza por la continua expoliación a que la tiene sometida el hombre. Recordemos que los metales, salvo alguna que otra rara excepción, como los metales nobles (oro, platino, etc., se encuentran en estado nativo en la Tierra), no existen como tales en naturaleza, sino combinados con otros elementos químicos formando los minerales, como los óxidos, sulfuros, carbonatos, etc.
Para la obtención de los metales en estado puro, debemos recurrir a su separación a partir de sus minerales, lo cual supone un gran aporte energético. Pensemos solamente en el enorme consumo de energía eléctrica que supone el funcionamiento de una acería para obtener un material tan indispensable para el desarrollo actual, como el acero. Pues bien, producido el acero, éste prácticamente inicia el periodo de retorno a su estado natural, los óxidos de hierro.
Esta tendencia a su estado original no debe extrañar. Si después de milenios el hierro se encuentra en los yacimientos bajo la forma de óxido, es que este compuesto representa el estado más estable del hierro respecto al medio ambiente. El mineral de hierro más común, la hematita, es un óxido de hierro, Fe2O3. El producto más común de la corrosión del hierro, la herrumbre, tiene la misma composición química. Un metal susceptible a la corrosión, como el acero, resulta que proviene de óxidos metálicos, a los cuales se los somete a un tratamiento determinado para obtener precisamente hierro. La tendencia del hierro a volver a su estado natural de óxido metálico es tanto más fuerte, cuanto que la energía necesaria para extraer el metal del mineral es mayor. El aluminio es otro ejemplo de metal que obtenido en estado puro se oxida rápidamente, formándose sobre su superficie una capa de alúmina (A12O3, óxido de aluminio). La razón de ello estriba en el gran aporte energético que hay que realizar para obtener una determinada cantidad del metal a partir del mineral, bauxita (Al2O3) en este caso.
Entonces, la fuerza conductora que causa que un metal se oxide es consecuencia de su existencia natural en forma combinada (oxidada). Para alcanzar este estado metálico, a partir de su existencia en la naturaleza en forma de diferentes compuestos químicos (minerales), es necesario que el metal absorba y almacene una determinada cantidad de energía. Esta energía le permitirá el posterior regreso a su estado original a través de un proceso de oxidación (corrosión). La cantidad de energía requerida y almacenada varía de un metal a otro. Es relativamente alta para metales como el magnesio, el aluminio y el hierro y relativamente baja para el cobre y la plata.
En la tabla se presenta una lista de algunos metales, situados en orden a la cantidad de energía requerida, de mayor a menor, para convertirlos desde su estado mineral al estado metálico.
Posiciones relativas de algunos metales en cuanto a la energía requerida para convertir sus minerales en metales.
Mayor requerimiento de energía:
Menor requerimiento de energía:
De las diversas operaciones que deben realizarse para extraer el metal del mineral, la primordial se puede resumir en una sola palabra: reducción. Inversamente, las transformaciones sufridas por el metal que retorna a su estado original, también pueden resumirse en: oxidación.
Según esto, la corrosión puede describirse en primer término como una reacción de oxidación, semejante por tanto a cualquier oxidación química. Por esto mismo, debe y puede ser regida por las leyes establecidas por la física y la química. Un metal sólo podrá corroerse, o sea, pasar a un estado más oxidado, cuando sea inestable con respecto a los productos formados por su corrosión. Esta inestabilidad puede preverse en términos energéticos.
La termodinámica permite realizar los balances de energía que, para el caso de los metales puros colocados en una situación bien determinada, permitirán predecir su comportamiento; en este caso, si aparecerá o no en ellos tendencia a la corrosión.
La energía de un determinado sistema puede medirse en los términos de lo que se llama la energía libre. Se pueden presentar tres casos:
a) la energía libre es positiva. El metal es activo y puede haber corrosión. Es el caso más frecuente entre los metales de uso común (hierro, aluminio, cinc);
b) la energía libre es positiva, pero el metal en vez de presentar corrosión, permanece inatacado aparentemente. Se dice que el metal está pasivo o pasivado;
c) la energía libre es cero o negativa. El metal es indiferente a los agentes agresivos habituales, no siendo posible ninguna reacción de corrosión. Es el caso de los metales nobles.
Podemos resumir todo lo anterior diciendo que es posible prever el comportamiento de un determinado metal en un medio ambiente dado, ayudándonos de las predicciones que nos aporta la termodinámica. Así si el sistema formado por el metal y el medio ambiente posee una energía libre positiva, es posible que tenga lugar la corrosión. Si bien los entornos o ambientes para un metal pueden ser muy específicos (pensemos por ejemplo en los metales con los que se construye un reactor nuclear), uno de los más generales, es el más común a la vida humana: la atmósfera.
Como se verá más adelante, la presencia simultánea de agua (electrolito) y oxígeno (oxidante) hacen prácticamente inevitable la corrosión en estas condiciones para la mayoría de los metales más utilizados (hierro, aluminio, cinc, etc.). La reacción de oxidación en el sistema formado presenta una energía libre positiva. Volvemos a lo que decíamos al principio: la corrosión parece inevitable.
En presencia de un medio acuoso, la corrosión es de naturaleza electroquímica. Tal corrosión es un proceso espontaneo que denota la existencia de una zona anódica (que sufre la corrosión), una zona catódica y un electrolito, siendo imprescindible la presencia de estos tres elementos para que este tipo de corrosión pueda existir (se requiere asimismo de contacto eléctrico entre la zona anódica y la catódica).
El término ánodo se emplea para describir aquella porción de una superficie
metálica en la que tiene lugar la corrosión (disolución) y en la cual se liberan
electrones como consecuencia del paso del metal en forma de iones, al electrolito.
La reacción que sucede en el ánodo, por ejemplo para el caso del cinc, es:
o sea, una reacción de oxidación.
Como los electrones, en un conductor metálico, se mueven en sentido compuesto al convencional,1 en el ánodo la corriente eléctrica sale del metal para entrar a la solución (figura 2). El término cátodo se aplica a la porción de una superficie metálica en la cual los electrones producidos en el ánodo se combinan con determinados iones presentes en el electrolito.
Las reacciones catódicas más comunes en presencia de agua son:
o sea, reacciones de reducción.
En el cátodo, la corriente eléctrica sale del electrolito para entrar al metal
(figura 2), cerrándose el circuito eléctrico a través de un conductor metálico
externo.
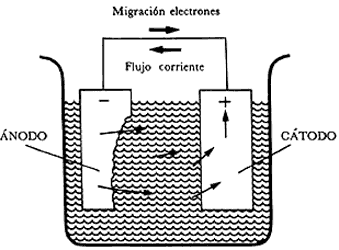
Figura 2. Dirección del flujo de corriente entre un ánodo y un cátodo en una
celda de corrosión.
Los componentes esenciales se presentan en la figura 2. Las flechas representan corrientes eléctricas (no electrones) fluyendo a la solución desde el ánodo (—) al cátodo (+) y regresando desde el cátodo al ánodo a través de un hilo metálico conductor (cobre por ejemplo).
La corrosión más frecuente es toda de naturaleza electroquímica y resulta de la formación de multitud de zonas anódicas y catódicas sobre la superficie metálica, siendo el electrolito, caso de no estar el metal sumergido o enterrado, el agua de condensación de la atmósfera, para lo cual se necesita que la humedad relativa del aire sea del orden del 70% o superior.
El proceso de disolución de un metal en un ácido (por ejemplo, cinc en ácido clorhídrico) es igualmente un proceso electroquímico. La infinidad de burbujas que aparecen sobre la superficie metálica corresponden a la formación de hidrógeno, H2, gaseoso, poniendo de manifiesto la existencia de infinitos cátodos, mientras en los ánodos se va disolviendo el metal.
Al cambiar continuamente de posición estas zonas anódicas y catódicas, llega un momento en que el metal se disuelve continuamente. Este tipo de corrosión se caracteriza porque casi siempre es más pronunciada en una zona que en otras, y su forma de manifestarse más característica es la aparición de picaduras.
LAS MANIFESTACIONES DE LA CORROSIÓN
Como vimos en el primer capítulo, la corrosión, especialmente la de naturaleza electroquímica, se puede manifestar de muy diversas maneras.
Por lo que hace referencia al metal más comúnmente empleado, el hierro, la presencia de la herrumbre constituye la manifestación de que se está desarrollando un proceso de corrosión. Pero entonces, la pregunta que nos podríamos hacer es ésta: ¿Qué hay más allá de la herrumbre?
El producto primario de la oxidación del hierro es el hidróxido ferroso blanco, Fe(OH)2 que a su vez se oxida a hidróxido férrico de color rojizo, Fe(OH)3.
Ayudémonos de una experiencia muy sencilla para comprender lo anterior. Veamos
el ataque producido por una gota de agua salada. Esta experiencia es debida
a Evans, uno de los investigadores que más han contribuido al conocimiento de
la corrosión. Evans demostró que en el caso de una gota de agua salada, las
diferencias en la cantidad de oxígeno disuelto en el líquido en contacto con
la superficie metálica, lo que se conoce como aireación diferencial,
crean pilas de corrosión en las que el ataque del metal ocurre en las áreas
menos oxigenadas, provocando una corrosión rápida e intensa. Si se deposita
una gota de agua salada (agua y cloruro de sodio) sobre la superficie horizontal
de una lámina de acero perfectamente limpia y desgrasada, como en la figura
3, se puede observar, por ejemplo después de unos 30 minutos, un precipitado
en el medio de la gota.
La parte periférica o más exterior de la gota, más aireada (con un más fácil acceso para el oxígeno) que el centro, juega el papel de lo que hemos llamado cátodo, con relación al centro, que a su vez se convierte en ánodo. Entre estas dos zonas se forma una membrana de hidróxido de hierro (herrumbre). Con ayuda de un tubo capital, se puede atravesar la membrana y comprobar la formación en el centro de la gota de una sal ferrosa (FeCl2, cloruro ferroso).
La presencia de la herrumbre es una manifestación clara de la existencia de corrosión para el caso del hierro y sus aleaciones (aceros). Para la mayoría de los metales, las manifestaciones de la corrosión pueden estudiarse en función de la forma o tipo de corrosión. En soluciones acuosas o en atmósferas húmedas, como ya se ha indicado, el mecanismo de ataque envuelve algunos aspectos electroquímicos. Debe de existir un flujo de electricidad desde unas ciertas áreas a otras en la superficie metálica, a través de una solución (electrolito) capaz de conducir la electricidad, tal como el agua de mar o el agua dura (agua con un alto contenido de sales).
Una solución que conduce la electricidad es un electrolito. Su cualidad para conducir la electricidad es debida a la presencia de iones. Éstos, son átomos cargados positiva o negativamente o bien agrupaciones de átomos con una cierta carga eléctrica, en solución.
El agua pura está ionizada en proporción muy pequeña. Sólo una mínima fracción de las moléculas de agua se disocia en iones hidrógeno, H+ (protones), y iones hidroxilo, OH—. El ión hidrógeno se une a una molécula de agua, H2O, para formar un ión hidronio, H3O+, aunque por facilidad lo representaremos por H+.
La disociación del agua, H2O, puede representarse así:
A efectos prácticos, el agua es un aislador casi perfecto. Entonces, cabría
preguntarse ¿por qué una sustancia iónica disuelta en agua produce iones? La
respuesta está en las propiedades dieléctricas del agua, o, en otras palabras,
en las propiedades polares de las moléculas de agua. Cada molécula de agua es
un pequeño dipolo, esto es, sus cargas positiva y negativa no coinciden. Podemos
representar estos dipolos de un modo exagerado por estructuras de forma oval.
Alrededor de un ión positivo habrán agrupadas un cierto número de moléculas de agua con sus extremos negativos próximos al catión. De modo análogo, los extremos positivos de algunas moléculas de agua se agruparán alrededor del ión negativo. De acuerdo con esta explicación, los iones de las sustancias disueltas deben estar libres en cualquier disolvente polar, como lo es el agua, como así ocurre en realidad.
Un electrolito capaz de formar un ambiente corrosivo puede ser, en principio, cualquier solución, lluvia o incluso la humedad condensada del aire. Puede abarcar desde el agua dura o salada hasta los ácidos y álcalis fuertes.
Los ánodos y cátodos involucrados en un proceso de corrosión se conocen como electrodos. Los electrodos pueden consistir en dos diferentes tipos de metal. En el electrodo negativo (ánodo) es donde tiene lugar la corrosión.
Podemos resumir lo anterior diciendo que para que exista corrosión deben cumplirse unas ciertas condiciones mínimas. Éstas son:
1. Debe haber un ánodo y un cátodo.
2. Debe existir un potencial eléctrico entre los dos electrodos (ánodo y cátodo).
3. Debe haber un conductor metálico que conecte eléctricamente el ánodo y el cátodo.
4. Tanto el ánodo como el cátodo deben estar sumergidos en un electrolito conductor de la electricidad, el cual está ionizado.
Una vez cumplidas estas condiciones, puede circular una corriente eléctrica dando lugar a un consumo de metal (corrosión) en el ánodo.
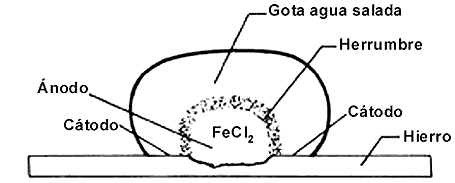
La diferencia de potencial creada entre el ánodo y el cátodo provoca una migración
de electrones desde el ánodo al cátodo a lo largo del conductor metálico
externo, un alambre de cobre por ejemplo, como se indica en la figura 4.
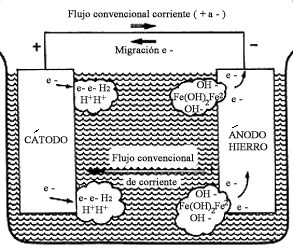
Figura 4. Sentido del flujo de electrones y del flujo convencional de la corriente
eléctrica en una celda de corrosión.
En el ánodo, al perder electrones, quedan iones hierro cargados positivamente, Fe2+, los cuales pueden combinarse con iones cargados negativamente, OH—, que se encuentran en las inmediaciones del ánodo, pudiéndose formar ocasionalmente hidróxido ferroso, Fe(OH)2, el cual puede reaccionar con posterioridad para formar hidróxido férrico, Fe(OH)3, la familiar y conocida herrumbre.
En el cátodo y procedentes del ánodo van llegando, a través del conductor metálico externo, electrones. Estos electrones cargados negativamente, al llegar a la interfase cátodo-solución, se combinan con los iones hidrógeno cargados positivamente, H+, para formar hidrógeno gas, H2. Cuando los iones hidrógeno se convierten en hidrógeno gaseoso, al combinarse con los electrones procedentes del ánodo, se crea un exceso de iones OH— en las inmediaciones del cátodo. Este exceso de iones OH— hace que aumente la alcalinidad y, por tanto, el pH del electrolito adyacente al cátodo.
Desde un punto de vista conceptual, hay algunos puntos de importancia que conviene aclarar por lo que respecta al flujo de la corriente eléctrica. El concepto convencional de corriente supone un flujo desde un potencial positivo (+) a un potencial negativo (—). Esto puede llevar a una cierta confusión, ya que la representación convencional del flujo de la corriente eléctrica es precisamente en la dirección opuesta al flujo de los electrones, como se indica en la figura 4.
Conviene recordar los siguientes puntos, en los términos del flujo de corrientes convencionales:
1) La corriente eléctrica, de acuerdo con la convención, circula desde el polo positivo (+) al negativo (-) en un circuito eléctrico. Esto indica que en nuestro caso la corriente circulará del cátodo hacia el ánodo, a través del conductor metálico.
2) En el electrolito, el transporte de la corriente eléctrica tendrá lugar entonces del ánodo al cátodo.
3) Habrá un consumo y por tanto la consiguiente pérdida de metal, en aquellos lugares del ánodo en que la corriente abandone el electrodo para pasar al electrolito.
PRODUCCIÓN DE UNA CORRIENTE ELÉCTRICA EN UN PROCESO DE CORROSIÓN
Podemos plantear un experimento sencillo para visualizar la producción de una corriente eléctrica en un proceso de corrosión. La producción de una corriente eléctrica por aireación diferencial fue llevada a cabo en el año de 1923 por el profesor Ulick R. Evans y por este motivo se lo conoce como experimento de Evans. En la figura 5. se presentan los detalles del mismo.
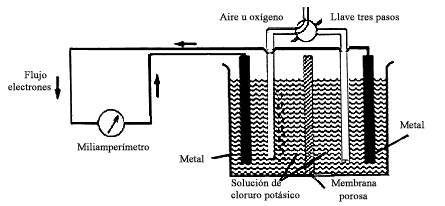
Figura 5. Producción de una corriente eléctrica por aireación diferencial.
Experimento de Evans.
Dos muestras de hierro se conectan a través de un amperímetro, con el cero en
el centro de la escala, y se colocan en una solución de una sal, separadas por
una membrana porosa. Cuando se hace pasar aire u oxígeno hacia el compartimiento
de la izquierda, se puede observar el paso de una corriente eléctrica a través
del amperímetro y la corrosión del hierro situado en el compartimiento de la
derecha, en el cual precisamente no hay oxígeno.
Parece evidente entonces que la presencia del oxígeno en el compartimiento
izquierdo está promoviendo la corrosión del hierro precisamente en el compartimiento
donde no hay oxígeno. Si se mueve la llave de tres pasos de manera que el oxígeno
(aire) pase ahora al compartimiento de la derecha en vez del de la izquierda,
la dirección de la corriente, observable en el amperímetro, cambia progresivamente,
al mismo tiempo que se puede observar que la corrosión del hierro tiene lugar
en el compartimiento en que no hay oxígeno, el de la izquierda. Tales hechos
pueden explicarse fácilmente, si se tiene en cuenta que la mayoría de las reacciones
involucradas no son de naturaleza química sino electroquímica.
Las reacciones químicas son reacciones en las cuales toman parte únicamente
especies químicas. Por ejemplo, la disociación química del agua (H2O)
en sus iones, H+ y OH—
Las reacciones electroquímicas, en cambio, son reacciones en las cuales no sólo toman parte especies químicas, sino también cargas eléctricas, por ejemplo, electrones negativos. Dos ejemplos de reacciones electroquímicas lo constituyen la reacción de los iones hidrógeno a hidrógeno gas:
y la oxidación del agua a oxígeno gas:
La combinación de estas dos reacciones electroquímicas conduce a la reacción
química global de descomposición del agua.
Para estudiar las reacciones electroquímicas es conveniente utilizar el concepto de potencial de electrodo, el cual veremos con detalle en el capítulo siguiente. Podemos adelantar que si un metal está en contacto con un electrolito, su potencial electródico será precisamente el potencial eléctrico de este electrodo medido con respecto al potencial eléctrico de un electrodo de referencia.
IMPORTANCIA DE LA CORROSIÓN EN LA PRODUCCIÓN Y EN EL DESARROLLO ECONÓMICO Y SOCIAL
Un estudio reciente efectuado por el National Bureau of Standards de los Estados Unidos (Efectos económicos de la corrosión metálica en los Estados Unidos, Departamento de Comercio, 1979) señala que tomando como base el año 1975, los costos totales de la corrosión metálica pueden estimarse del orden de los 70 billones de dólares, lo cual supone un 4.2% del Producto Nacional Bruto (PNB). El estudio señala que aproximadamente un 15%, o sea 10.5 billones de dólares (0.6% del PNB) pudiera haberse evitado. En un país de un nivel de desarrollo tecnológico más parecido a México, como Egipto, se ha realizado un estudio similar. Durante una investigación en la que se invirtió un periodo de 3 años, se evaluaron los efectos económicos provocados por la corrosión de los materiales metálicos, los cuales se estimaron en aproximadamente 475 millones de dólares, un 4.9% del PNB de Egipto.
Los estudios de que disponemos hasta la fecha han sido realizados entre 1949 y 1979 y provienen básicamente de 9 países. Los resultados globales están reproducidos en la siguiente tabla, con la indicación del costo total de la corrosión expresado en dólares americanos del valor del año de estudio. Asimismo y en aquellos casos en que ha sido posible, se expresa el porcentaje del Producto Nacional Bruto para el año en que se realizó el estudio.
Costo de la corrosión por año.
| Año |
País |
En millones de dólares EUA | En % del PNB |
| 1949 |
EUA |
5 500 |
|
| 1960-61 |
India |
320 |
|
| 1964 |
Suecia |
58 a 77 |
|
| 1965 |
Finlandia |
47 a 62 |
0.58 a 0.77 |
| 1968-69 |
RFA |
6 000 |
3.0 |
| 1969 |
URSS |
6 700 |
2.0 |
| 1969 |
Gran Bretaña |
3 200 |
3.5 |
| 1973 |
Australia |
550 |
1.5 a 3.0 |
| 1974 |
URSS |
18 850 |
4.1 |
| 1975 |
EUA |
70 000 |
4.2 |
| 1976 — 77 |
Japón |
9 200 |
1.8 |
Para varios de los países de que se dispone de datos, el costo de la corrosión
representa aproximadamente entre un 2 y un 4% del PNB. No existen
muchos datos sobre cómo se reparten estos costos. El estudio realizado en la
Gran Bretaña, conocido como informe Hoar, precisa que para este país los costos
debidos a la corrosión soportados por algunos sectores industriales, se pueden
desglosar aproximadamente así: transportes (26%), naval (21%), la industria
de la construcción (18%), el petróleo y la química (13%), etc. Muchos de los
estudios efectuados han señalado que entre un 20 y un 25% del costo total de
la corrosión pudiera haberse evitado, mediante una mejor aplicación de las diferentes
técnicas anti-corrosión existentes, y con una mayor toma de conciencia de los
riesgos que conlleva la corrosión. Mas allá de la frialidad de los números y
de los porcentajes del Producto Nacional Bruto, los problemas derivados de la
corrosión se dejan sentir en tres vertientes:
1) económica (pérdidas directas e indirectas);
2) conservación de recursos (agotamiento de las reservas naturales);
3) seguridad humana (fallos fatales en medios de transporte, corrosión de bidones que contienen residuos radioactivos, escapes en tuberías de refrigeración de plantas nucleares, etc.)
La pérdida de vidas humanas es, desgraciadamente, una posibilidad que se puede presentar como una consecuencia directa o indirecta de la corrosión. ¿De qué datos se dispone en México para realizar un estudio semejante al efectuado en otros países sobre los costos de la corrosión? No disponen a la fecha los autores del presente libro de un estudio, siquiera aproximado, de lo que pueden suponer las pérdidas debidas a la corrosión.
Una encuesta realizada muy recientemente sobre los problemas que plantea la corrosión a la Industria Química Mexicana (Ciencia y Desarrollo núm. 64 p. 103, septiembre-octubre 1985) ha señalado la incidencia del fenómeno en más de un 90% de las empresas que contestaron la encuesta. Ello habla por sí mismo de la gravedad del problema, y seguramente a nivel nacional, englobando a todos los sectores productivos, representa una cantidad más que respetable de dinero. No obstante, no son tanto los indicadores económicos lo preocupante, sino la incidencia que la corrosión tiene en la seguridad humana. El costo social de la corrosión puede llegar a ser tan elevado que debería prestársele una mayor atención por el lado de las autoridades, empezando por la propia toma de conciencia personal. Lo "normal" desgraciadamente entre los utilizadores de metales en su mayor o menor grado de ignorancia acerca del cómo y cuándo puede ocurrir la corrosión y el modo de prevenirla o evitarla.
A la corrosión, en los apretados programas de las carreras técnicas, si acaso, se le reserva el papel de una materia optativa, muchas veces para cubrir unos créditos sobrantes al finalizar los estudios de ingeniería. La preparación de los profesionales que tienen que ver con la utilización de materiales metálicos, redundaría en una acertada utilización de los recursos anticorrosivos de que se dispone a la fecha y con ello se conseguiría un considerable ahorro en la monstruosa cifra que anualmente representan las pérdidas originadas por la corrosión.
En estos días de recortes presupuestales, de ahorro de energía y de conservación de los recursos naturales, parece increíble que no se haga aún nada al respecto.
NOTAS
1 El sentido de una corriente eléctrica
se define como el sentido del movimiento de las cargas libres. Sin embargo,
surge la dificultad de que en un conductor electrolítico están en movimiento
en sentidos opuestos cargas libres de ambos signos (cationes y aniones). Cualquiera
que fuera el sentido asignado a la corriente, habría cargas moviéndose en sentido
opuesto. Ya que ha de adoptarse algún convenio, se ha coincidido en hablar del
sentido de una corriente como si los portadores fueran todos cargas positivas.
En un conductor metálico, sólo son libres las cargas negativas
o electrones libres. De aquí que toda la corriente en un conductor metálico
se produce por el movimiento de cargas negativas y, por tanto, los electrones
se mueven en sentido opuesto al convencional.