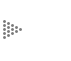I. EL MEDIO AMBIENTE DE LA VIDA, EL AGUA Y LAS SOLUCIONES
LA VIDA transcurre en el agua, se inició en ella. Cuando los seres vivos, formados originalmente en mares y lagos, salieron de ellos, llevaron consigo el agua y la mantuvieron en su interior a toda costa. Aun en los desiertos, animales y plantas conservan en su interior un medio acuoso en el que viven sus células. Si la proporción de agua disminuye por debajo de ciertos límites, estas células mueren.
Las membranas de las células sumergidas en estos medios acuosos separan realmente soluciones en las que hay azúcares, sales y un sin número de moléculas que se requieren para la vida. Las soluciones y el agua misma tienen funciones particulares que tienen mucho que ver con la estructura y la función de las membranas; por tanto es conveniente saber cómo están organizadas. Es muy importante entender, por ejemplo, cómo es que la membrana constituye una barrera efectiva entre diversas soluciones, que a fin de cuentas representan conjuntos de moléculas, y es interesante conocer las reglas más sencillas y generales que rigen su conducta y sus interrelaciones. Después de todo, las moléculas resultan de la combinación de átomos, y sus propiedades se explican mediante leyes simples de comportamiento que a su vez tienen origen en la distribución de los electrones de los átomos que se combinan para formularlas. Por esto es importante revisar primero las características generales de las uniones entre los átomos, partiendo de los diferentes tipos de valencias que existen.
CÓMO SON LOS ÁTOMOS Y MOLÉCULAS
Los átomos tienen la tendencia natural a unirse entre sí para formar moléculas, que obedece a reglas sencillas. La valencia, o capacidad de combinación de los átomos, resulta de la necesidad que tienen los átomos de "completar" sus órbitas externas, perdiendo o ganando electrones, dependiendo de lo que les resulte más sencillo. Un átomo de hidrógeno, por ejemplo, tiene espacio en su órbita más externa para aceptar dos electrones. Con frecuencia se une a otros átomos "perdiendo" el único electrón que posee, conservando un simple protón como núcleo. Aunque los protones no existen en forma libre, pues se asocian con otras moléculas como las del agua; en principio ésta es la situación cuando reacciona, por ejemplo, el hidrógeno con el cloro. Pero también puede completar su órbita aceptando un electrón de otro átomo. Un átomo de oxígeno, que tiene 6 electrones en su órbita más externa, al combinarse con otros elementos completaría su órbita más externa con dos más, por lo que suele unirse a otros tratando de completar esa "órbita" o nivel externo. De estas uniones, entre otras cosas, resultan distribuciones uniformes o desiguales de los electrones, que se traducen en la formación de sustancias que pueden tener o no cargas eléctricas, o cuando menos "polos" eléctricos que dan lugar a atracciones o repulsiones entre ellas, siguiendo la simple ley de los signos: cargas opuestas se atraen y cargas del mismo signo se repelen. En las moléculas grandes o en algunos grupos de ellas, estas atracciones y repulsiones pueden ser de extraordinaria importancia, pues con frecuencia son la razón y origen de estructuras de gran importancia; uno de estos casos es el de las membranas biológicas.
Uno de los casos de unión entre dos átomos es el de elementos que se encuentran muy separados entre sí en la tabla periódica de los elementos, como puede ser el caso del sodio (Na) y el cloro (Cl), que están en lados opuestos de la tabla. Como se muestra en la Figura 4, al Cl sólo le falta un electrón en su órbita más externa para completarla con ocho, como número máximo permitido. El caso del Na es el opuesto; este átomo sólo tiene un electrón en su última órbita, y la manera más simple de completarla consiste en deshacerse de ese solo electrón.
Es tal la tendencia de estos dos elementos a completar así sus órbitas más
externas, que la reacción entre ellos es extremadamente violenta. Como se muestra
en la figura, al final de esa reacción resulta lo que se conoce como dos iones,
es decir, los dos mismos átomos, pero con una carga neta cada uno que resulta
de la pérdida o ganancia de un electrón, según el caso. El ión sodio (Na+)
es el mismo átomo, pero ha perdido el único electrón que tenía en su última
órbita, y el ión cloruro (C-) es también el mismo átomo de
cloro, pero ahora contiene un electrón adicional en su última órbita, que obtuvo
de la reacción con el sodio. Inclusive cambia la forma de representarlos, y
el número y signo de sus cargas se representa a un lado y arriba del símbolo
del elemento original. El enlace que ahora mantiene unidos a los dos átomos
es el llamado enlace iónico, y no es otra cosa que la atracción resultante de
la diferencia de signos en la carga de ambos. Aunque el Na+
y el Cl- se encuentran firmemente unidos en los cristales
de cloruro de sodio (NaCl), no lo están cuando se disuelven en el agua, por
que hay una movilidad e intercambio constante entre los iones de signos contrarios
que están en contacto unos con otros.
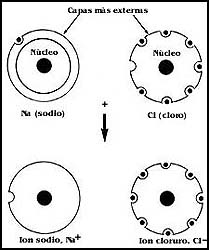
Figura 4. En la unión del sodio, NA, con el cloro, Cl, el primero pierde
un electrón que gana el segundo. El resultado es ion sodio, Na+, y el ion clouro,
Cl-, que se mantienen unidos por la diferencia de signos en su núcleo.
Hay casos en que se unen átomos iguales entre sí; por ejemplo dos átomos de hidrógeno que se unen para formar una molécula (H2). Dado que la atracción que ambos núcleos ejercen sobre los electrones es la misma, el resultado es que ambos átomos "comparten" sus electrones, y se mueven ambos alrededor de dos núcleos.
En el caso, por ejemplo, de los enlaces de carbono con el hidrógeno, cada enlace
entre los átomos se une por la participación de dos electrones, proporcionados
por cada uno de los átomos que participan en la unión, y la situación es semejante,
también aquí los átomos "comparten" los electrones, y éstos se mueven uniformemente
alrededor de ambos (Figura 5). Este tipo de enlace es llamado covalente, y en
él no hay diferencia en la distribución de los electrones, ni separación de
los átomos, que se mantienen unidos constantemente.
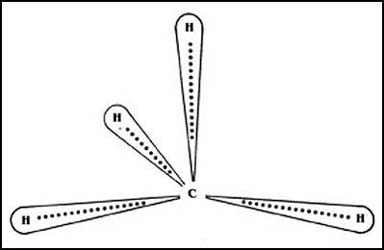
Figura 5. La estructura del metano (CH4).
En cada uno de los enlaces, los electrones se comparten por el átomo de carbono
y los de hidrógeno, de modo que no hay tendencia a que experimenten más atracción
hacia ninguno de ellos.
Hay casos intermedios en los que es difícil hablar de un enlace covalente puro,
o de un enlace iónico, que se presenta cuando se unen elementos que tienen una
diferente capacidad para atraer a los electrones (electronegatividad), pero
no al grado de que uno tome los electrones del otro ni viceversa. Esto es lo
que sucede con la molécula de agua, constituida, como todos sabemos, por un
átomo de oxígeno y dos de hidrógeno (H2O).
En la molécula de agua cada enlace también es covalente; en cada unión del oxígeno
con el hidrógeno se "comparten" dos electrones, provenientes de los átomos participantes,
uno del oxígeno y uno del hidrógeno. Sin embargo, como se muestra en la Figura
6, los electrones no se comparten equitativamente; el oxígeno, que tiene una
mayor electronegatividad, los atrae con mayor fuerza y los disfruta por mayor
tiempo. Esto da como resultado que se constituya una especie de carga negativa,
aunque incompleta en el oxígeno, y que, por otra parte, se genere una deficiencia
de carga en las dos zonas del hidrógeno.
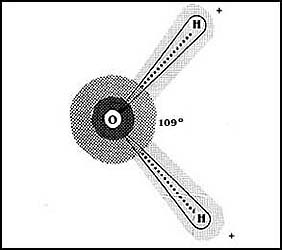
Figura 6. El caso del agua, H2O, es diferente.
Los electrones son atraídos con mayor intensidad por el oxígeno que por el hidrógeno.
El oxígeno se vuelve así ligeramente negativo y los hidrógenos ligeramente positivos.
Además, la distribución de los átomos en el espacio es la que se muestra en
la misma Figura 6; las uniones del oxígeno con los hidrógenos parten hacia un
solo lado del átomo, pero se abren formando un ángulo de 109º. Sucede así que
en la molécula se establecen dos polos negativos que lógicamente se convierten
en uno hacia el extremo donde se encuentra el oxígeno, y dos positivos hacia
los hidrógenos. Ésta es la disposición general que da lugar a las llamadas moléculas
polares, y que en el caso del agua hace que sus mismas moléculas se organicen
como se muestra en la Figura 7, gracias a la atracción que ejercen mutuamente
los polos negativos y los positivos.
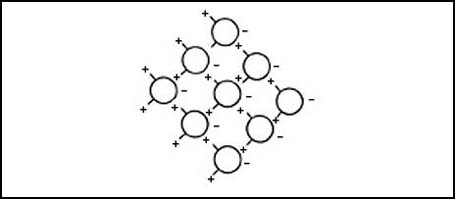
Figura 7. Representación de la "estructura" de las moléculas en el agua. Aunque hay una gran movilidad, pues el agua es un líquido, las porciones negativas son atraídas por las positivas de otras, impidiendo que se separen y pasen al estado gaseoso que le correspondería por su tamaño. La estructura, de hecho, es más complicada.
De aquí resultan propiedades del agua que son diferentes a las de moléculas de tamaño semejante como el metano (CH4). Entre las sustancias químicas, por ejemplo, el estado físico depende en gran parte del peso molecular; mientras más grande es una molécula, más se va acercando al estado sólido. Es así que el metano (CH4), el NH3 y moléculas de ese tamaño, son gases aún a temperaturas bajas. El agua, en la cual sus moléculas se atraen entre sí, tiene un punto de ebullición (pasa al estado gaseoso) de 100ºC al nivel del mar. Si el agua no tuviera "polos" de diferente signo, sería también un gas, pues sus moléculas tenderían a separarse al predominar su energía cinética sobre la atracción que ejercen unas por otras.
Hay muchas otras moléculas no polares, como la gasolina y otros combustibles, los aceites y grasas minerales, que no ejercen atracción importante unas por las otras, que son líquidas a la temperatura ambiente a partir de aquellas de 6 o 7 átomos de carbono, y una de sus propiedades importantes es que no se pueden disolver en el agua. La ausencia de polos en estas sustancias evita que se puedan intercalar con las moléculas del agua, pues éstas, atraídas unas por otras, impiden que las demás se coloquen entre ellas y las "exprimen" fuera del seno de las soluciones.
Hay pues compuestos iónicos y polares que pueden interactuar unos con otros porque sus cargas positivas o negativas o su polaridad les dan esta posibilidad. Dentro de este grupo se encuentran prácticamente todas las sales, los ácidos y las bases o álcalis. También son polares todos los azúcares y aminoácidos, así como un sinnúmero de sustancias que existen en la naturaleza.
Por otra parte, hay sustancias apolares que, al no tener cargas en sus moléculas, sólo pueden interactuar unas con otras, pero de ninguna manera con las polares, que las expulsan de su seno. Todo esto es fundamental para entender una cuestión muy sencilla, que es la solubilidad de las sustancias.
SOLUBILIDAD. ¿QUÉ ES UNA SOLUCIÓN?
La solubilidad es la propiedad que tienen las sustancias, gaseosas, líquidas o sólidas, de intercalar sus moléculas con las de un solvente (el líquido en que se disuelven). Como ya se mencionó en la sección anterior, depende en gran parte de las características relativas de polaridad de la sustancia que se disuelve, que se llama soluto, y las del solvente.
LA GASOLINA NO SE DISUELVE EN AGUA
Ya se mencionaron las razones de este fenómeno; las moléculas del hidrocarburo, que no son más que cadenas de átomos de carbono saturados de hidrógenos, no se pueden intercalar con las del agua, que se atraen fuertemente entre sí. La situación es semejante para las grasas y aceites. Tampoco es posible, por lo tanto, disolver sales o azúcares en la gasolina. La atracción entre sus partículas hace imposible que se separen y pasen al seno de los líquidos apolares.
Tomemos el caso, por ejemplo, del cloruro de sodio en agua, tal vez la solución
más abundante de nuestro planeta, o del azúcar en el agua. En el caso del cloruro
de sodio, la disolución tiene lugar porque cada uno de los iones, sea positivo
o negativo, ejerce una atracción sobre la porción negativa o positiva, respectivamente,
de las moléculas de agua. Éstas llegan a formar verdaderas capas alrededor de
los iones, que realmente están separados y es así como se intercalan con el
agua. Cosa semejante sucede con otras moléculas polares, como los azúcares.
Las moléculas tienen porciones polares que pueden interactuar y atraerse mutuamente
con el agua. Ambos casos se representan esquemáticamente en la Figura 8. Las
soluciones acuosas de sustancias polares son el tipo más común de soluciones
que hay, y como ejemplo ya mencionamos el caso del agua del mar. Pero esto también
es cierto para las soluciones que encontramos en los seres vivos, como nuestros
líquidos corporales, lágrimas, saliva, jugo gástrico, orina, etc.; los líquidos
que ingerimos, como el café, té, aguas frescas, etc., en su mayor parte son
soluciones acuosas en las que los solutos son polares.
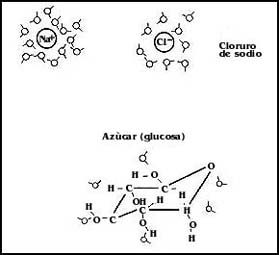
Figura 8. Representación esquemática de las interacciones de un compuesto iónico, el cloruro de sodio, y uno polar, un azúcar, con el agua, cuando están en solución.
¿ES LA GASOLINA MEJOR SOLVENTE QUE EL AGUA?
Las sustancias que se disuelven en la gasolina deben ser las apolares; entonces, para decidir la pregunta planteada, basta hacer un recuento de las sustancias que conocemos y clasificarlas entre las polares o las apolares. El ejercicio puede ser largo, pero si enumeramos las sustancias que conocemos, podremos ver fácilmente que es mucho mayor el número de las polares, que deberían ser solubles en agua, que el de las apolares, que serían solubles en gasolina. No hay siquiera punto de comparación; por esta razón el agua es considerada como el solvente universal.
En resumen, las interacciones de las moléculas se dan en gran parte debido a la distribución electrónica que poseen y que puede permitir la relación de los compuestos polares o iónicos con los de su mismo tipo. Por otra parte, hay también interacciones hidrofóbicas, pero éstas no son más que atracciones débiles entre moléculas apolares. La gasolina se separa del agua, no porque haya una atracción importante entre sus moléculas, sino porque la fuerte atracción entre las moléculas de agua rechaza y expulsa a las de gasolina. Así de simple. Este es un concepto de gran importancia, pues determina las interacciones de las moléculas que constituyen a los seres vivos y define con frecuencia estructuras.