I. ALGO SOBRE LA TERMODINÁMICA. ¿QUÉ ES EL CALOR ESPECÍFICO?
UNA experiencia muy común ocurre cuando ponemos al fuego una olla que contiene agua: después de cierto tiempo, el agua se calienta. Esto quiere decir que su temperatura aumenta. Se puede verificar fácilmente esta afirmación poniendo dentro del agua un termómetro. Nos daremos cuenta de que, efectivamente, la temperatura aumenta. También sabemos, de nuestra experiencia, que mientras más tiempo dejemos el agua sobre la llama, más aumentará su temperatura.
¿Cómo se puede describir este experimento que nos es tan familiar? En este caso hay una transferencia de calor de la llama al agua. Esto significa que la llama transfiere energía al agua. Claramente, mientras más tiempo dejemos el agua sobre la llama, más energía se transferirá, es decir, habrá mayor transferencia de calor. En estas circunstancias, el agua absorbe esta energía y como consecuencia, responde aumentando su temperatura.
Supóngase ahora que hacemos lo siguiente. Tomemos la misma cantidad, por ejemplo, un kilogramo, de dos sustancias distintas, digamos agua y aluminio (figura 1); las colocamos sobre una llama el mismo intervalo de tiempo, digamos quince minutos y ponemos cada una de las sustancias en contacto con un termómetro. Al principio ambas sustancias tienen la misma temperatura, por ejemplo, la ambiente (figura 1(a)). Al finalizar el intervalo de tiempo leemos los termómetros (figura (b)) y observamos dos cosas:
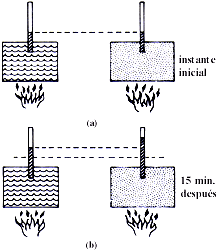
Figura 1. Distintas sustancias tienen distintas capacidades de absorber calor.
i) Las dos sustancias aumentaron sus temperaturas.
ii) Los aumentos que experimentaron cada una de las sustancias no fueron los mismos. Así, por ejemplo, el agua habría aumentado su temperatura en 12ºC, mientras que el aluminio en 55ºC.
Lo anterior nos indica que el agua y el aluminio absorbieron el calor que les transfirió la correspondiente llama. La cantidad de calor absorbida por cada una de las sustancias fue la misma, ya que estuvieron colocadas de la misma forma sobre llamas idénticas y durante los mismos intervalos de tiempo.
La segunda conclusión nos indica que cada una de las sustancias respondió de manera diferente a la misma cantidad de calor transferida. Una de ellas, el aluminio, experimentó un cambio de temperatura mayor que la otra sustancia, el agua.
La experiencia anterior nos hace ver que las sustancias tienen, entonces, una propiedad que es la de cambiar su temperatura a causa de una absorción de calor. Esta propiedad se mide por medio de la capacidad calorífica. Por tanto, la capacidad calorífica del agua es distinta a la del aluminio.
Por otro lado, nos damos cuenta que si colocamos en estufas idénticas, durante el mismo intervalo de tiempo, dos cantidades distintas de la misma sustancia, por ejemplo agua, cada una de las muestras aumentará su temperatura en cantidades distintas. Así por ejemplo, si colocamos en la misma estufa de antes 1 kg de agua y en la otra, 20 kg de agua, después de quince minutos la primera muestra habrá aumentado su temperatura en 12ºC, mientras que la Otra habrá aumentado solamente 0.6ºC. Esto es claro, pues las mismas cantidades de calor fueron transferidas a cantidades distintas de agua. A pesar de haber encontrado dos aumentos de temperatura distintos, no podríamos decir en este caso que las dos muestras de agua tienen distintas capacidades de absorber calor, pues ambas están formadas de la misma sustancia. Para poder hablar, sin riesgo de confusión, sobre la propiedad de absorber calor que tiene una sustancia se define el calor específico como la cantidad de calor que es necesario que absorba un gramo de una sustancia para aumentar su temperatura en 1ºC.
De lo anterior se puede afirmar que cada sustancia tiene un calor específico bien determinado. Los valores numéricos del calor específico de distintas sustancias son distintos. Así, por ejemplo, el calor específico del agua es
| Calor específico del agua
= 1caloría / gramo (°C) |
Esto quiere decir que para que un gramo de agua aumente su temperatura un grado centígrado es necesario transferirle una caloría de energía térmica. El calor específico del aluminio es 0.219 caloría/gramo (*C), o sea, que para que un gramo de aluminio aumente su temperatura en 1ºC se tienen que transferir 0.219 calorías. De manera análoga, cada sustancia tiene un valor particular del calor específico.
Hasta este punto hemos hablado solamente del caso en que se transfiere calor de una fuente, como por ejemplo una llama, a una sustancia. En este caso la sustancia absorbe calor. También puede ocurrir que una sustancia transfiera calor a otra, por ejemplo, si se tiene un vaso con agua caliente y lo dejamos a la intemperie, sabemos que el agua se enfría. Es decir, el agua disminuye su temperatura. En este caso, el agua transfiere calor a la atmósfera. Se dice que el agua emitió calor. Al igual que en el caso de la absorción, se puede llegar al concepto de calor específico para la emisión, que sería el calor necesario que debe emitir un gramo de una sustancia para disminuir su temperatura en 1ºC. Pues resulta que los calores específicos tanto de absorción como de emisión de una sustancia son iguales. En consecuencia solamente se habla de calor específico sin especificar si es de absorción o de emisión.