XII. MÉTODOS PARA LA COLECTA Y EL ESTUDIO DEL PLANCTON
SEGÚN la definición del científico alemán Víctor Hensen, el plancton es el conjunto de organismos que flotan a merced de los movimientos del agua en el mar, independientes de la ribera y del fondo.
Este conjunto de seres vivos es muy heterogéneo, ya que reúne organismos animales y vegetales, pero a la vez es homogéneo con respecto a su incapacidad de moverse o de poder hacerlo únicamente en pequeña medida, es decir, carecen de la fuerza necesaria para luchar contra las corrientes marinas; además, al encontrar a su disposición, en su medio ambiente, los elementos nutritivos que les son indispensables, permanecen agrupados. Existe pues, una interdependencia vital entre todos estos organismos y el medio que los rodea.
Hensen logró entender al plancton como un modelo de comunidad biótica, de gran importancia en la fertilidad de la masa de agua, y desde entonces su estudio ha proporcionado conocimientos básicos en el campo de la ecología.
Las investigaciones sobre el plancton sólo se remontan al año de 1828, cuando John Vaughan Thompson, cirujano inglés y naturalista aficionado, al estar estudiando las primeras etapas de la vida de los cangrejos se dio cuenta de que en el mar vivían flotando una gran variedad de pequeñas criaturas. Thompson cubrió un frasco con una red de gasa muy fina y lo arrastró en el agua; luego, a través de su microscopio, descubrió la riqueza de la vida planctónica; no sólo había pequeños cangrejos, sino también organismos maduros de muchas clases.
En 1885 otro investigador alemán, Johannes Müller, estudiando el ciclo vital de la estrella de mar utilizó una red de malla fina, como las que usaban en los molinos para cribar la harina, la remolcó por el agua en un intento de capturar larvas del animal y le llamó la atención la gran cantidad de vida flotante compuesta de organismos desconocidos de forma extraña y especial que habían pasado por alto los naturalistas de la época.
Müller contagió su entusiasmo a Haeckel, el cual, junto con otros ecólogos contemporáneos, se apasionó grandemente con este nuevo mundo de vida que podía obtenerse arrastrando "redes de Müller" en el agua.
Los oceanógrafos del siglo XIX dedicaron gran parte de sus esfuerzos a perfeccionar redes rastreadoras que les permitieran obtener muestras de plancton en varios niveles del mar. En un corto tiempo se hizo popular la ciencia del plancton y se puso de moda su investigación.
El desarrollo metódico de la investigación sobre el plancton se ocupó principalmente de dos problemas: la toma cuantitativa de muestras representativas, y la identificación o determinación y descripción de todos los organismos recolectados en ellas.
La recolección de muestras siempre ha representado un problema para los investigadores, debido a la diversidad de características de los individuos que forman el plancton, los cuales miden desde milésimas de milímetro hasta dos metros; por lo tanto, es muy difícil diseñar un método que permita colectar una muestra que reúna a todos estos tipos de organismos. La toma de muestras y su preparación posterior son diferentes para el plancton animal y el vegetal.
Uno de los métodos más sencillos para el estudio del zooplancton es la observación directa desde el bote, o buceando, con lo cual, al distinguir las concentraciones de estos organismos, se puede determinar su distribución. Se cree que los métodos sencillos son primitivos y no dan, por ello, buenos resultados, pero el investigador alemán Schroder ha publicado observaciones realizadas de esta manera, descubriendo la distribución desigual del zooplancton y las diversas nubes de organismos en el lago de Constanza.
Estas observaciones directas no permiten una identificación de las especies plantónicas desde el punto de vista cualitativo y cuantitativo, pero son muy apropiadas para detectar cambios rápidos de la distribución del plancton y para programar las colectas con otros métodos.
En la actualidad estos métodos directos para detectar su distribución se basan en el empleo de la cámara de televisión y de la ecosonda.
Para recolectar muestras que permitan su estudio posterior en el laboratorio existen varios métodos, siendo uno de ellos la captura por medio de botellas, utilizada para organismos muy pequeños, como por ejemplo cocolitofóridos y cianofíceas.
La muestra se toma con una botella de tipo oceanográfico en la profundidad deseada, después se coloca en un vaso de precipitados, se le agrega un líquido fijador, por ejemplo formol o soluciones a base de iodo, y se centrifuga concentrando a los organismos para las observaciones posteriores. Estas botellas generalmente tienen un litro de capacidad, aunque han sido utilizadas por los biólogos otras mayores.
Otros métodos para capturar plancton son: las redes, los tomamuestras y las bombas de agua. En la captura con red, el plancton es sacado por filtración separándolo del agua donde vive; en los otros dos métodos se obtiene junto con el agua que actúa de sustrato, con la ventaja de que se puede establecer directamente la relación entre la cantidad de plancton y el volumen de agua.
La red funciona como filtro y suele hacerse de gasas de seda, perlón y nailon de cedazo, cuyas hebras se mantienen firmes, retorciéndolas. Actualmente sólo se utiliza el nailon o el perlón; la seda ha sido desechada porque los hilos se hinchan en el agua con el tiempo, haciéndose más pequeño el ancho de la malla, lo que no ocurre con los tejidos artificiales.
Las redes presentan diferentes clases de finura, que se registran con base en el diámetro de los poros o por el número de mallas por centímetro cuadrado. La dimensión de las mallas de las redes utilizadas varía según el plancton que se desea recoger.
Para este registro ha sido adoptada una escala estándar internacional que comprende 29 dimensiones diferentes, las que van desde el número 0000, que corresponde a un diámetro de 1.3 milímetros, hasta la número 25, o sea la que presenta un diámetro de milésimas de milímetro.
Con redes de malla grande se recogen, principalmente, organismos zooplanctónicos adultos, pero no sus estados larvarios y plancton pequeño como rotíferos, fitoplancton, etcétera. Para capturar organismos de menor talla se deben utilizar tejidos con malla más pequeña.
Con aberturas superiores al milímetro se puede colectar macroplancton, que generalmente es visible a simple vista, como las medusas. Con redes de abertura menor a un milímetro y superior a 76 milésimas de milímetro se colecta el microplancton, como los copépodos.
El nanoplancton, formado por organismos pequeños de 76 a cinco milésimas de milímetro, o sea, cinco micras, como diatomeas y flagelados, y el ultraplancton, organismos más pequeños de cinco micras, como las bacterias, no pueden quedar detenidos en estas redes, y el único medio para recogerlos es el método de la botella oceanográfica.
La red está formada por un cono de tela cuya base se fija en un aro de metal que la mantiene abierta y en él se sujetan tres cabos que se unen al cabo de arrastre; su extremidad posterior puntiaguda se cierra con un bocal formado por un cilindro metálico, que se obtura mediante un trozo de tela idéntico a la red y se fija al cilindro por un círculo movible. También se puede utilizar un frasco de vidrio sujeto a una abrazadera metálica apretada por un tornillo.
Para estudios generales sobre el plancton, la red más utilizada es la llamada red normal, con superficie total de filtración de un metro cuadrado y un cuarto de metro cuadrado de superficie de poros. Esta red generalmente la fabrican los investigadores, y los tres cordeles de suspensión están atados al anillo de la red a igual distancia y unidos a la tela.
Las redes están sometidas, durante la captura, a una creciente obturación y filtran menos agua de la que podría entrar teóricamente en la red, por lo que recogen cuantitativamente menos organismos. Esta obturación de la red depende de la composición del plancton y del tiempo que dura la operación y básicamente no se puede calcular este efecto, ni prevenir su extensión. Este defecto de las redes es importante sobre todo para estudios cuantitativos debido a que no se puede tener control de los errores.
La clásica red de plancton se ha ido perfeccionando agregando dispositivos que mejoran su control; en el comercio existe una amplia gama de redes con diferentes características, tamaños y anchos de malla.
Las redes pequeñas, kosmos, son muy útiles, especialmente para trabajos en aguas interiores y zonas costeras; se fabrican con diferentes clases de finura.
El plancton puede recolectarse por medio de redes, en sentido horizontal y vertical. Para recogerlo en sentido horizontal y en la superficie, se lanza la red al agua, mientras la embarcación avanza lentamente. La red es arrastrada por medio del cabo y el agua penetra por la abertura de la boca y se escapa por las mallas, mientras que los organismos son retenidos en la extremidad del cono.
En el cabo se cuelga una pesa que hace que la red llegue a cierta profundidad, la cual se puede conocer utilizando un aparato llamado clinómetro, que consiste en un medio círculo graduado que lleva una aguja fija en el centro y marca la inclinación del cable, que indica la profundidad a que se está penetrando.
Para trabajar en el sentido vetical, que es importante para determinar la distribución exacta del plancton entre el fondo y la superficie, a una profundidad deseada, se ideó la red de cierre, que se abre y se cierra debajo del agua con ayuda de un peso hecho de latón, llamado mensajero, que permite arrastrar la red abierta a la profundidad requerida, sin que se mezcle mientras la red se baja o se sube.
Investigaciones importantes se han realizado empleando la llamada red calcofi, diseñada por los investigadores de la institución California Cooperative Fisheries; ésta es una red cónica con una boca de 50 centímetros de diámetro y con malla de 333 micras; es una de las más empleadas en la actualidad.
Otra red muy utilizada últimamente es la red bongo, que tiene la ventaja sobre la calcofi de no tener bridas al frente, ya que esto produce que las larvas de mayor tamaño "sean avisadas" y escapen de la red.
La red bongo se compone de un par de redes colocadas una al lado de la otra
(de ahí su nombre), de 60 centímetros de diámetro; la primera tiene una malla
de 505 micras, y la otra de 333 micras, lo que permite la captura de larvas
grandes en la primera, y huevos y larvas pequeñas en la segunda, además de la
fauna acompañante que no es retenida por la primera.

Figura 26. La red de plancton y red tipo bongo.
Todas las redes pueden ser equipadas en su boca con un dispositivo que permita medir, de manera aproximada, el volumen de agua que ha pasado por la red, llamado medidor de flujo o contador de paletas, que consiste en una hélice que gira al paso del agua midiendo la cantidad de agua filtrada.
La red se arrastra a la profundidad deseada, durante el tiempo requerido y a la velocidad que se programó, de acuerdo con los objetivos del estudio que se esté realizando, y al terminar el arrastre se lavan las paredes de la red para concentrar el plancton que se coloca en un frasco de colecta que contenga agua del mar, a la que se le agrega formol para su fijación, conservación y estudio posterior.
Otro método de captura del plancton es por medio de tomamuestras de agua, que se utiliza para la investigación del fitoplancton y en la colecta para estudios cuantitativos de plancton, porque toma un volumen exacto de agua junto con el de organismos que viven en ella, con la ventaja de que la relación entre el volumen de agua y el contenido de plancton se da directamente; los más utilizados son los del tipo friedinger, que tienen tapas verticales que se cierran por mensajero, evitando turbulencias en las capas de plancton.
El agua colectada con el tomamuestras, cualquiera que sea su construcción, se pasa a través de un embudo, que lleva en la boca una pieza de gasa que retiene al plancton, y éste se coloca en una botella y se fija.
La mayoría de los tomamuestras tienen un volumen pequeño, dando por ello valores no muy seguros, de modo que se deben introducir varias veces en la misma profundidad. El más común es el de dos litros de capacidad. Estos aparatos no son muy utilizados de ordinario por los oceanógrafos porque los organismos de mayor movilidad del plancton escapan con este sistema de captura; sólo son recogidos los organismos poco móviles e inactivos, proporcionando, por lo tanto, una imagen planctónica inexacta.
El tercer método para capturar plancton es el de las llamadas bombas de agua, las cuales consisten de un tubo que se sumerge a la profundidad deseada y por acción de la bomba se succiona el agua y se filtra una cantidad determinada a través de una tela, quedando retenidos la totalidad o la mayor parte de los organismos del plancton. Después de la colecta se concentran los individuos contenidos en una cierta cantidad de agua por medio de una centrífuga, pudiéndose estudiar este plancton cuantitativa o cualitativamente. Las mejores bombas son las activadas por electricidad.
Con respecto al fitoplancton, en una investigación cuantitativa en general no se utilizan redes, sino exclusivamente tomamuestras y bombas, porque con menos agua que se filtre para concentrarlo es suficiente, al contrario de cuando se estudia zooplancton.
En cambio, para estudios cualitativos se emplea la red de zeppelin, que consta de un cono de gasa de red que se alarga hacia adelante en forma cilíndrica para obtener una mayor superficie para la filtración. Tiene dos anillos de metal cosidos a la red: uno entre la parte cilíndrica y cónica, y el segundo en la mitad de la parte cilíndrica, los que aseguran que la red permanezca siempre abierta cuando se sube lentamente.
La red zeppelin sirve especialmente para capturas cualitativas, con el fin de cultivarlos y clasificarlos para demostraciones, etcétera, ya que al tener una rápida obturación no alcanza a capturar a los organismos más grandes para obtener estudios cuantitativos.
Según los objetivos de la investigación, una vez recolectado el plancton se puede cultivar en el laboratorio, utilizando diferentes medios de acuerdo con el organismo que interese, pero cuando se colecta para estudios posteriores se fija con reactivos especiales, es decir, se mata con la mayor rapidez posible tratando de dejar a los individuos lo más semejante al estado vivo. Uno de los reactivos más comunes es una solución de formol neutro al 4%, también se utiliza el reactivo fijador de Bouin o el de Zencker, preparados con agua de mar para prevenir efectos osmóticos.
Como es muy difícil que los estudios se realicen en la embarcación, después de fijar las muestras se tienen que conservar o preservar, colocándolas en un frasco de vidrio con una solución de formol neutro al 3% preparado con agua destilada; el recipiente debe ser llenado totalmente para evitar burbujas en los organismos. Las muestras se almacenan en la oscuridad para la preservación del color a temperaturas entre los 5º y los 20º C.
Lo más recomendable es que la fijación se realice inmediatamente después de que la muestra subió a bordo, porque los organismos se deterioran fácilmente, sobre todo en climas cálidos. Todas las muestras tienen que ser etiquetadas, con el mayor número de datos de la colecta, ya que esta información va a ser necesaria antes de decidir el método de análisis que se va aplicar.
Ya en posesión de una muestra planctónica, el biólogo debe proceder a su estudio, que es la parte más laboriosa reservada a los especialistas no solamente del plancton en general, sino de ciertos grupos en particular. La determinación de las especies se lleva a cabo por medio de la lupa o de los diferentes tipos de microscopios.
Si una pesca de plancton suficiente exige unos minutos, su estudio microscópico requiere mucho más tiempo de los diferentes especialistas. En estas condiciones, no hay por qué extrañarse si los resultados tardan varios años en ser publicados después de la colecta de las muestras. Para facilitar a los investigadores el análisis de los diferentes grupos que forman el plancton, algunos países han creado los llamados Centros de Preclasificación Oceanográfica, en donde además de registrar los datos, número de estaciones, fecha, hora, tipo de redes, profundidad de colecta, volumen de agua filtrada, también se separa por grupos a los ejemplares, para ser enviados a los especialistas.
El análisis de las muestras de plancton se puede orientar para distinguir a los individuos que lo forman o para determinar las proporciones relativas de los diferentes organismos.
Para conocer a las especies se estudia la muestra revisándola por partes que se colocan en cajas de petri y se observan al microscopio, se hacen esquemas de los organismos o se toman fotografías y se identifican consultando las claves.
Para determinar las proporciones existentes en la muestra se cuentan los organismos
contenidos en ella, pero como el recuento de toda la muestra generalmente es
muy difícil porque contiene cientos de miles de individuos, éste se fracciona
utilizando el aparato de Folsom, en el cual se coloca la muestra diluida
hasta un volumen conocido y se agita para que los organismos se distribuyan
uniformemente, se gira el aparato y la muestra queda dividida en dos mitades
iguales, el proceso se repite hasta tener la cantidad deseada.

Figura 27. Aparato de Folsom para dividir las muestras de plancton.
El recuento del plancton se puede llevar a cabo con perfección con un microscopio fotónico común, ya que la muestra se cuenta en las llamadas cámaras tubulares al sedimentarse en el fondo del cristal después de un tiempo determinado; trabajando con este microscopio se tendrían que sumergir los objetivos de mayor aumento en el agua, produciéndose imágenes con poca claridad. Para evitar esto se emplea el microscopio invertido de Utermohl, inventado por éste en 1928, en el cual los objetivos están dirigidos desde abajo al fondo de la cámara de recuento; así se observan los organismos planctónicos sedimentados sin dificultades, incluso con el objetivo más potente, llamado de inmersión.
También es importante conocer el volumen y peso del plancton los cuales proporcionan información aproximada de la cantidad total de plancton presente, aunque no permiten determinar la composición y las proporciones de los diferentes tipos de organismos que lo forman.
El conocimiento de su volumen permite estimar la abundancia de plancton en un área determinada. Para hacerlo se coloca la muestra en una probeta graduada y se deja sedimentar durante 24 horas, midiendo la cantidad de sedimento en el fondo de la probeta; los valores que se obtienen son aproximados y limitados.
La medición del peso se puede hacer de dos formas: midiendo el peso húmedo (también llamado biomasa), para lo cual se tiene que separar el agua de los organismos filtrando la muestra por gravedad o al vacío, pesando los residuos sólidos; los resultados dependen del tipo de organismos que predominan tomando precauciones en su interpretación. La otra forma es medir el peso seco, para lo cual después de filtrar y de lavar rápido en agua destilada con el fin de quitar los cristales de sal que pueden alterar la muestra, se coloca en un secador o en un horno para eliminar el exceso de agua y el residuo es el que se pesa; estos resultados pueden indicar con mayor exactitud la cantidad real de materia orgánica.
Con los avances de la tecnología moderna se están aplicando nuevos métodos
para el estudio cualitativo y cuantitativo del plancton. Uno de los más recientes
es la aplicación del rayo láser para obtener una placa fotográfica que
permite estudiar el que vive en un litro de agua. Este método, conocido como
holografía con láser, se está perfeccionando para tratar de obtener el
holograma en el lugar donde el plancton vive, sin necesidad de recolectarlo.
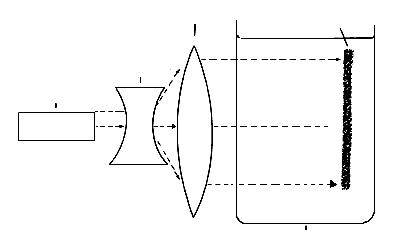
Figura 28. Observación del plancton mediante rayo láser.
También el microscopio acústico, que utiliza ondas sonoras para establecer las imágenes de los microorganismos, combinado con la ecosonda, puede dar gráficas del plancton en el área donde vive y permitir conocer su cantidad y su tipo, lo cual proporcionará grandes ventajas a los investigadores.
Para otros estudios del plancton es importante conocer los componentes químicos de las estructuras de los organismos, así como la proporción en que se encuentran; para ello se utilizan los métodos de cromatografía, con objeto de determinar en el fitoplancton los tipos y cantidades de los pigmentos que intervienen en la fotosíntesis, lo que ha permitido obtener progresos notables en el conocimiento de la productividad oceánica.
Para estudiar la productividad primaria los métodos más utilizados son los que se basan en la medición del oxígeno producido durante la fotosíntesis o en la cuantificación del carbono radiactivo fijado en este proceso.
Para esta técnica se emplean frascos de vidrio de 100 a 500 mililitros de volumen: uno se pinta de negro y el otro se deja transparente. Se llenan con fitoplancton evitando la producción de burbujas, pudiéndose separar el zooplancton por filtración previa o separando únicamente los animales de mayor tamaño y se determina el contenido de oxígeno del agua de la muestra por el método de Winkler.
Ambos frascos se vuelven a colocar en el mismo lugar donde fue tomada la muestra para tratar de medir el fenómeno en condiciones parecidas de temperatura y de luz, por un periodo de incubación de 6 a 24 horas.
Después del tiempo de exposición, se sacan las botellas y se vuelve a determinar, en cada una de ellas, la cantidad de oxígeno.
Comparando la cifra inicial de la botella transparente con la nueva cifra registrada se obtiene la cantidad de oxígeno producido durante la fotosíntesis, lo que indica la productividad de estos vegetales. La botella oscura sirve como testigo: los cambios que se presentan son mínimos e indican el consumo de oxígeno por respiración y por acción de las bacterias.
El método de carbono 14 se basa en medir la actividad fotosintética de acuerdo con la cantidad de carbono fijado durante el proceso. Este método es semejante al anterior, con la diferencia de que se mide el carbono existente en la muestra y se le añade una pequeña porción de carbono 14 radiactivo. Después del periodo de incubación se mide el gasto del carbono con un contador Geiger, el cual indica la productividad.
Estos métodos son más fáciles de aplicar en aguas continentales que en el mar abierto, debido a la dinámica ocasionada por el oleaje, las corrientes, etcétera.
El estudio del plancton se ha ido modificando constantemente gracias al avance en la tecnología científica que ha permitido establecer nuevos medios. No sólo es importante para la investigación básica en ciencias del mar, sino que tiene gran trascendencia para la investigación aplicada como la que se realiza para las pesquerías; por ejemplo, para calcular una población pescable se estudian los huevos y larvas de las especies presentes en el plancton.
La necesidad para ciertas investigaciones de pesca industrial, como la del arenque, de adquirir rápidamente una imagen cualitativa y cuantitativa del plancton del que depende la presencia y densidad de los bancos de peces, condujo al biólogo inglés Hardy a inventar, en 1936, una máquina registradora de pesca continua del plancton, que funciona durante la marcha del barco.
Así se observa que la información planctónica permite estudios de la dinámica de poblaciones como fluctuación de las existencias de un pez que desova; predicción de las clases anuales; estimación de la abundancia de estas existencias sobre su producción de desove, y discriminación entre las de la misma especie.
Los biólogos marinos desarrollan programas de investigación cada vez más amplios y especializados, tratando de resolver los misterios que estos bellos e interesantes organismos planctónicos les presentan.