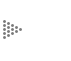II. EL ÁTOMO DE CARBONO, LOS HIDROCARBUROS, OTRAS MOLÉCULAS ORGÁNICAS, SU
POSIBLE EXISTENCIA EN LA TIERRA PRIMITIVA
Y EN OTROS CUERPOS CELESTES
LA TEORÍA de la gran explosión como origen del Universo concibe la formación del átomo de carbono (peso atómico = 12) en el interior de las estrellas mediante la colisión de tres átomos de helio (peso atómico = 4).
La generación del carbono y de los átomos más pesados se dio en el interior de las estrellas antes de la formación de nuestro Sistema Solar, cuyo nacimiento, a partir de materiales cósmicos, polvo y gas provenientes de los restos de estrellas que explotaron, se remonta a un pasado inimaginable: algo así como 4 600 millones de años.
Cuando la tenue nube de polvo y gas fue comprimida por la onda de choque producida por la explosión de una estrella de las llamadas supernovas, se formó la nebulosa en cuyo centro la materia se concentró y calentó hasta producir nuestro Sol.
Rodeando al Sol, la materia fue siendo cada vez mas fría y sus elementos constitutivos más ligeros. Con este material se formaron los planetas y sus lunas.
La diferente composición química del cuerpo de los planetas y de su atmósfera se debe en parte a que se formaron en regiones de la nebulosa con distintas temperaturas, por lo que los planetas interiores, Mercurio, Venus, Tierra y Marte, son rocosos, con gran proporción de metales, óxidos y silicatos. En cambio, los planetas exteriores contienen más gases. Así, los planetas interiores han perdido alrededor de 98% de su peso original por haber estado formados de material volátil como hidrógeno y helio, mientras que los planetas lejanos conservan enormes cantidades de hidrógeno y helio.
La Tierra, el tercer planeta del Sistema Solar, tuvo la fortuna de no ser tan caliente como Mercurio y Venus, ni tan frío como los planetas más alejados del Sol. Contiene agua en abundancia y carbono en cantidades también relativamente abundantes, además del resto de los elementos estables, es decir todos los elementos de la tabla periódica hasta el número 92, metal conocido con el nombre de uranio (Figura 1).
Los elementos del 93 al 109, llamados transuránicos, han sido preparados artificialmente por el hombre, mediante colisiones entre distintos átomos.
Cuando la colisión se efectúa entre átomos y neutrones se obtienen átomos con idéntico número atómico, pero diferente peso molecular, a los que se les llama isótopos. El primero de ellos, el fósforo 30, fue preparado por Frédéric e Irene Joliot Curie en 1935.
Desde entonces, el hombre ha preparado más de 1 900 isótopos de diferentes elementos, muchos de ellos radiactivos.
Cualquier elemento natural o sintético es identificado por su número atómico Z, que corresponde al número de protones que lleva en su núcleo. Cada elemento puede tener un número variable de isótopos. El hidrógeno, que posee un protón y un electrón, tiene además un isótopo estable, cuyo núcleo está formado por un protón y un neutrón. A este isótopo con peso atómico de dos se le llama deuterio.
El uranio, que tiene número atómico de 92, posee 92 protones en su núcleo. Si además contiene 143 neutrones, estaremos en presencia del isótopo uranio 235 (143 + 92 = 235); cuando el número de neutrones es de 146, el isótopo de uranio será el 238.
Los diferentes isótopos (del griego, mismo lugar) de un elemento se llamarán, en general, de la misma manera y ocuparán el mismo lugar en la tabla periódica de los elementos, además de que tendrán idénticas propiedades químicas dado que su configuración electrónica permanece estable.
El carbono, elemento base de la vida, se encuentra en la corteza terrestre en una proporción de 0.03%, ya sea libre o formando parte de diversas moléculas. Como era de suponerse, el carbono se encuentra también en los demás planetas de nuestro Sistema Solar, ya que todos fueron formados a partir de la misma nebulosa. Se ha comprobado su existencia en meteoritos y en las muestras de piedras traídas de la Luna.
En la Tierra se le encuentra: libre en forma de diamante o de grafito; combinado, formando parte de diversas moléculas orgánicas como la celulosa de la madera, el algodón y el azúcar; formando parte de sustancias inorgánicas como el mármol, que químicamente es el carbonato de calcio (CaCO3), el bicarbonato de sodio o polvo de hornear (NaHCO3) y, en la atmósfera terrestre, como bióxido de carbono (C02), de donde las plantas lo toman y lo transforman, con la ayuda de la energía solar, en sustancias orgánicas que incorporan a su organismo. Estas sustancias serán posteriormente utilizadas por algunos de los seres del reino animal como alimento.
Éstos, a su vez, oxidarán la materia orgánica, liberando bióxido de carbono (CO2) para completar el ciclo de la vida.
EL CARBONO EN ESTADO LIBRE
El diamante es un cuerpo duro y transparente en el que cada átomo de carbono
se encuentra unido a otros cuatro, localizados en los vértices de un tetraedro
(Figura 5(A)). El grafito (Figura 5(B)) es otra forma alotrópica del carbono.
Alotropía es una palabra griega que significa variedad. El diamante es, por tanto, uno de los alótropos del carbono. Debido a las diferencias que existen en las uniones entre los átomos del diamante y los del otro alótropo del carbono, el grafito, ambos tienen propiedades completamente diferentes. Así, mientras el primero es el más duro de los materiales conocidos, el segundo es un material blando que se usa como lubricante y para escribir o dibujar, es decir, es el material de que está hecho el corazón de los lápices.
De la misma forma, el diamante es más pesado que el grafito, pues la densidad del primero es de 3.5 g/cm3 y la del segundo de 2.3 g/cm3.
Como ambas sustancias están formadas tan sólo por átomos de carbono, como antes veíamos, la diferencia en propiedades físicas se debe al modo de unión entre sus átomos.

Figura 5.
En el diamante, cada átomo de carbono está rodeado por otros cuatro átomos acomodados en los vértices de un tetraedro (Figura 5(A)). En el grafito, en cambio, los átomos de carbono están fuertemente unidos a tres átomos vecinos, formando capas de hexágonos. En este último caso las diferentes capas se encuentran unidas entre sí por fuerzas débiles (fuerzas de Van der Waals), lo que hace que una capa pueda deslizarse sobre la otra, dándole al grafito la propiedad de lubricante, propiedad que es aprovechada para evitar el rozamiento entre dos superficies duras que se deslizan una sobre la otra. Por tanto, las marcas que deja un lápiz al escribir están formadas por las capas horizontales de hexágonos ilustradas en la figura 5(B).
Por otra parte, a diferencia del diamante, el grafito es un buen conductor de la energía eléctrica.
Esta propiedad, rara para un elemento no metálico, se puede deducir de su estructura
(Figura 5(B)), en la que cada una de las tres uniones entre átomos (representados
en la figura por líneas) están formadas por un par de electrones, es decir cada
átomo ha empleado tres de sus cuatro electrones de valencia, quedándole por
lo tanto un electrón libre que puede moverse a través de la molécula favoreciendo
la conducción de la electricidad.
Como hemos visto, el átomo de carbono, por tener cuatro electrones de valencia,
tiende a rodearse por cuatro átomos, ya sean del propio carbono, como en el
diamante, o de diferentes elementos, con los que comparte cuatro de sus electrones
para así completar su octeto, que es lo máximo que puede contener en su capa
exterior.
La Tierra, al igual que los demás planetas, tuvo en su primera época una atmósfera
rica en hidrógeno (H2), por lo que el carbono (C) reaccionó
con él formando moléculas de hidrocarburos (carbono hidrogenado). Como el hidrógeno
contiene un solo electrón de valencia, cada átomo de carbono se une a cuatro
de hidrógeno formando el más sencillo de los hidrocarburos, el metano (CH4).
El metano es una molécula estable en la que las capas electrónicas de valencia,
tanto del hidrógeno como del carbono, están saturadas, el primero formando un
par como en el helio y el segundo un octeto como en el neón.

Figura 6. (a) Formación del metano, orbitales atómicos y moleculares.
(b) representación de hidrocarburos con modelos.
En el metano, los cuatro átomos de hidrógeno se encuentran acomodados en los vértices de un tetraedro (Figura 6), arreglo similar al ya mencionado para el diamante.
Debido a que el carbono tiene la propiedad de unirse entre sí formando cadenas lineales, ramificadas o cíclicas, sus compuestos forman una serie muy grande de sustancias con fórmulas precisas (Figura 7), de las que se conocen ya más de dos millones de diferentes sustancias orgánicas y cada año se suman muchos nuevos compuestos orgánicos de origen natural o sintético.
Los hidrocarburos lineales tendrán la fórmula CnH2n +2. Así, por ejemplo, el hidrocarburo lineal de 5 átomos de carbono o pentano CH3 - CH2 - CH2 - CH2 - CH3 será C5H(2 X 5) +2 o sea C5H12. Si el hidrocarburo es ramificado, como por ejemplo el isobutano, su fórmula es también
No así en los hidrocarburos cíclicos como en el ciclopentano en que se pierden dos hidrógenos para poder usar la valencia vacante en la unión C—C que cierra el ciclo. Los hidrocarburos cíclicos se representan esquemáticamente por medio de polígonos: el ciclopentano por medio de un pentágono, y el ciclohexano por un hexágono, y cada ángulo representa un CH2.
Los cuatro primeros hidrocarburos lineales se llaman: metano (CH4), etano (C2H6), propano (C3H8) y butano (C4H10), y son gases inflamables. Los siguientes tres: el pentano (C5H12), el hexano (C6H14) y el heptano (C7H16) son líquidos inflamables con bajo punto de ebullición. Los hidrocarburos gaseosos mencionados forman parte del gas doméstico, mientras que los líquidos constituyen las gasolinas.
Los hidrocarburos con mayor número de átomos de carbono son líquidos de punto de ebullición cada vez más elevado hasta llegar a 14 átomos de C, que es el primer hidrocarburo sólido. Todos los hidrocarburos con más de 14 átomos de C serán sólidos a temperatura ambiente. Simplemente recordemos, como ejemplo, las velas de parafina, que están formadas por hidrocarburos con un número elevado de átomos de carbono.
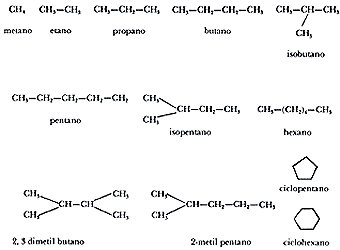
Las cuatro valencias del átomo de carbono pueden también ser satisfechas de manera diferente a las ya vistas: dos átomos de carbono pueden unirse entre sí, usando no sólo una valencia, sino dos y aun tres. En el primer caso tendremos las moléculas llamadas olefinas o alquenos, entre las que la más sencilla es el etileno:
Estas moléculas son muy útiles en química orgánica, ya que al existir la tendencia
de los átomos de carbono a quedar unidos entre sí por una sola valencia, quedan
disponibles las valencias extras para unirse a un hidrógeno u otros átomos,
dando hidrocarburos saturados, o hidrocarburos sustituidos, como alcoholes,
éteres o aminas, etc. (Figura 8).
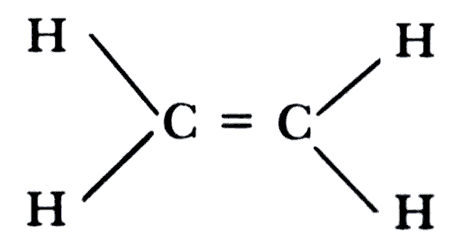
Existe también la posibilidad de que dos átomos de carbono unan tres de sus cuatro valencias, formando así sustancias llamadas alquinos, entre las que la más sencilla es el acetileno:
 |
 |
El acetileno se ha encontrado en meteoritos y muestras de la Luna, en donde se halla combinado con metales formando sustancias duras, llamadas carburos.
Los carburos metálicos se forman por interacción entre el átomo de carbono
y un óxido metálico a elevadas temperaturas. Los metales alcalinos (como Sodio)
forman carburos que pueden representarse como M2C2
(M = metal) y los alcalino térreos (como calcio) forman carburos representados
por MC2. Ambos producen acetileno, CH![]() CH,
por reacción con agua. En cambio, los carburos de berilio o aluminio producen
metano (CH4) por hidrólisis.
CH,
por reacción con agua. En cambio, los carburos de berilio o aluminio producen
metano (CH4) por hidrólisis.
El más conocido de los carburos es el carburo de calcio, CaC2. Esta sustancia se prepara por reacción entre cal (CaO) y carbón a alta temperatura.
El carburo de calcio es el hidrocarburo más simple en el que cada átomo de carbono intercambia tres valencias formando lo que se conoce como triple ligadura. El carbono de calcio reacciona con agua desprendiendo acetileno.
El acetileno se usa en combinación con el oxígeno en el soplete oxiacetilénico, el cual sirve para soldar o cortar objetos de hierro. Debido a que arde con luz brillante, el acetileno se usa también en lámparas de alumbrado.
Los átomos de carbono no solo se pueden combinar entre sí y con el hidrógeno para dar hidrocarburos, sino que también pueden combinarse con muchos elementos, principalmente con oxígeno y con nitrógeno, para transformarse en los compuestos orgánicos que son la base de la vida.
Esta habilidad del carbono de combinarse entre sí y con otros átomos, explica el porqué 9 de cada 10 entre los cientos de miles de sustancias conocidas contengan carbono.
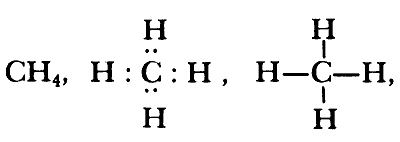
El metano, el más simple de los hidrocarburos, es el resultado de la unión de
un átomo de carbono con cuatro hidrógenos. En éste, como en el diamante, las
cuatro valencias van dirigidas hacia los vértices de un tetraedro (Figura 6).
El metano es un gas volátil e inflamable que, por su alto contenido de calor, 13.14 Kcal/g, es un combustible eficaz. Es el principal componente del gas natural, en donde se encuentra junto con otros hidrocarburos gaseosos como etano, propano y butano. Este gas, también llamado gas de los pantanos, por formarse debido a la acción de microorganismos sobre la materia orgánica, también se produce en el estómago de los mamíferos cuando éstos tienen una mala digestión.
EL METANO Y OTROS COMPUESTOS QUÍMICOS EN LOS CUERPOS CELESTES.
El metano formó parte de la atmósfera primitiva de la Tierra, donde se generó por la acción reductora del hidrógeno sobre el carbono. Era el gas predominante en la atmósfera terrestre de aquel entonces.
Actualmente el metano forma parte de la atmósfera de los planetas fríos que se encuentran más allá de Marte en nuestro Sistema Solar, es decir Júpiter, Neptuno, Urano y Plutón.
Las naves espaciales Pionero y Viajero I revelaron un mundo fascinante en que las capas de distintos colores se suceden en este enorme planeta, cuyo diámetro es 11 veces el de la Tierra. Como el metano se conserva en estado gaseoso, aun a 160° bajo cero, y solidifica sólo a -182°, se encuentra en forma de gas en la atmósfera de Júpiter, donde se transforma químicamente con la ayuda de la radiación ultravioleta del Sol. Las nuevas moléculas de hidrocarburos superiores más pesadas que el metano se licuan y llegan a solidificar precipitándose en forma de lluvia o nieve durante las tormentas eléctricas que se suceden con frecuencia en ese gigante del Sistema Solar. Los hidrocarburos superiores, constituidos por cadenas de átomos de carbono, al caer sobre el océano de hidrógeno líquido que cubre la superficie de Júpiter, son reducidos nuevamente al hidrocarburo más simple y más estable que es el metano, el que vuelve a incorporarse a la atmósfera joviana.
Saturno
El Viajero I llegó a Saturno en noviembre de 1980, después de su inspección por Júpiter y sus satélites, mostrando un enorme planeta, aunque algo menor que el anterior. Este planeta, que se distingue de los demás por su bello e impresionante sistema de anillos, posee una atmósfera en la que predomina el hidrógeno, aunque es rica también en metano, etano y amoniaco. Debido a la baja temperatura del planeta, el etano y el amoniaco se encuentran en estado sólido, y el helio se condensa cayendo como lluvia sobre la superficie del planeta.
Titán. Con este nombre se conoce a la mayor luna de Saturno, un cuerpo celeste con tamaño comparable al de la Tierra.
De gran importancia fueron los hallazgos de la primera misión del Viajero I,
pues su espectrofotómetro de infrarrojos encontró que la atmósfera de este cuerpo
celeste está formada por 80% de nitrógeno y por sustancias orgánicas como metano
(CH4), etano (CH3 — CH3),
acetileno (H — C![]() C—H) y ácido cianhídrico (HC
C—H) y ácido cianhídrico (HC![]() N).
N).
Debido a las bajas temperaturas que se alcanzan en Titán, 93°K (-l80°C) o menos, el metano puede existir en sus tres estados: sólido, líquido y gaseoso. En las capas superiores de Titán desciende la temperatura y el metano se congela formando pequeñas partículas sólidas. El metano produce en Titán algo similar a nuestras lluvias y nevadas.
Química del metano en las condiciones de Titán. Debido a que la atmósfera de Titán contiene también sustancias orgánicas provenientes de la reacción entre el metano y el nitrógeno, Titán se convierte en un excelente laboratorio químico extraterrestre donde se llevan a cabo reacciones químicas por medio de las cuales se forman ácido cianhídrico (HCN), ciano acetileno, etanopropano, etileno y metil acetileno. Muchas de estas sustancias, como el ácido cianhídrico, no habían sido detectadas en la atmósfera de otros planetas, aunque sí en el espacio interestelar.
La presencia de sustancias orgánicas nitrogenadas como el ácido cianhídrico y el ciano acetileno son de gran importancia científica, dado que son los intermediarios clave en la formación de los aminoácidos y ácidos nucléicos que son los precursores de la vida en la Tierra. Las demás lunas de Saturno no tienen atmósfera.
Urano y Neptuno
Son gigantescos planetas de color verde azulado, más fríos y densos que Saturno. La atmósfera de estos planetas contiene, además de hidrógeno, metano, identificado por su espectro de infrarrojo.
Urano. Es un gran planeta de color verdoso, con 51 000 km de diámetro (4 veces el de la Tierra), que circunda al Sol cada 84 años terrestres. Se encuentra a una distancia del Sol de 2 868 600 000 km (dos mil ochocientos sesenta y ocho millones seiscientos mil kilómetros), o sea 19 veces más alejado de lo que lo está la Tierra. Por tanto, a diferencia de los ocho minutos que tarda en llegar la luz solar a la superficie de la Tierra, a Urano llega después de poco más de dos horas y media. Esta enorme distancia convierte a Urano en un planeta difícil de estudiar.
Urano es un gigante gaseoso con un corazón rocoso, con 3 o 4 veces la masa de la Tierra, cubierto de una capa de agua, amoniaco y metano (H20, NH3 y CH4) de unos ± 8 000 km de espesor. Sobre este vasto océano existe una atmósfera de hidrógeno y de helio, con una considerable cantidad de metano.
Es precisamente el metano el que da un aspecto verdoso al planeta, ya que las ligaduras C—H absorben la luz roja. Las capas superiores de esta atmósfera se encuentran a —213 °C. La duración del día es aproximadamente de 114 horas terrestres.
Urano, a semejanza de Saturno, está rodeado de anillos, aunque éstos están constituidos por un material oscuro que refleja muy poco de la luz solar que reciben, por lo que quizá estén formados por sustancias derivadas del carbono.
Neptuno. Es, como Urano, un gigante verdoso con aproximadamente las
mismas dimensiones y con una composición química parecida.
Plutón
Además de ser el más lejano y más pequeño de los planetas del Sistema Solar,
es también el menos denso. Su composición química, según las últimas observaciones,
queda así: agua sólida 74%, metano 5% y roca 21%.
Plutón, a pesar de ser tan pequeño, tiene una luna. Sin embargo, la gran lejanía impide hacer deducciones de la química de este pequeño y apartado cuerpo celeste.
La posibilidad de reacciones químicas entre las moléculas que forman la atmósfera de estos planetas es, debido al frío, muy restringida. El hidrógeno, que forma 90% de las atmósferas de Urano y Neptuno, no puede arder por la falta de oxígeno. Tampoco el metano, que se asemeja al gas de nuestras estufas, puede arder, pues falta el oxígeno necesario para que se efectúe la reacción de oxidación que sucede cuando encendemos nuestra estufa o el calentador de nuestro baño.
El otro elemento que se encuentra en la atmósfera de Urano y Neptuno es el helio, del que ya sabemos que es inerte. Es un elemento que por más que lo calentemos en presencia de oxígeno no arde, pues por tener completa su órbita de valencia no reacciona ni consigo mismo; es por esto que siempre se encuentra como átomo solitario (He).
En la atmósfera de Plutón se ha detectado metano, además de los gases nobles, argón y neón, razón por la cual su atmósfera es inerte. Por tanto, el metano en esas condiciones no podrá arder dando bióxido de carbono, agua, luz y calor, como lo hace en la Tierra.
LOS COMETAS
En los helados confines del Sistema Solar existen congelados millones de pequeños cuerpos celestes formados de hielo, gas y polvo. Cuando alguno de ellos es perturbado por el paso de una estrella, se pone en movimiento y, al recibir el calor del Sol, cobra vida, libera gases y polvo e inicia un viaje describiendo una órbita elíptica alrededor del Sol. A veces invierte miles de años en terminar este viaje. Mientras más se acerca al Sol en su recorrido, el cometa libera más materia, átomos y moléculas que, arrastradas por el viento solar, constituyen su cauda, la que, debido a dicho impulso, siempre se verá opuesta al Sol. Si en un camino alguno de los cometas se acerca demasiado al Sol, toda su materia se evapora, dando un espectáculo de luz antes de que sus átomos y moléculas pasen a formar parte de la materia invisible del Universo.
Las órbitas de algunos de ellos son alteradas por influencia de los grandes planetas, convirtiéndose en cometas de periodo corto, como es el caso del cometa Halley, que pasa por las cercanías de la Tierra cada 76 años.
Los cometas, después de haber sido observados a simple vista o por medio de telescopios y estudiados espectroscópicamente, se han descrito como pequeños cuerpos de hielo que mientras brillan a la luz del Sol emiten gases y polvo, y cuyas moléculas se descomponen en iones y radicales por acción del viento y radiación ultravioleta solares.
Aprovechando la ocasión en que el cometa Halley pasó por las cercanías de nuestro planeta en marzo de 1986, los científicos de todo el mundo unieron sus esfuerzos para estudiarlo, tanto para poder confirmar o rectificar los anteriores conceptos, como para desentrañar muchos de los misterios que aún lo rodean.
EL COMETA HALLEY
Las naves espaciales enviadas para su exploración y estudio por japoneses, soviéticos
y europeos confirmaron muchos de los conceptos previamente establecidos, pero
además revelaron datos sorprendentes, muchos de los cuales aún no han sido suficientemente
estudiados.
De gran interés fue descubrir que su núcleo es alargado, con la forma de un cacahuate ennegrecido; que sus dimensiones son mayores de las que se habían supuesto. Tiene 15 kilómetros de largo por 10 de ancho en los lóbulos y siete en la parte más angosta, y que la superficie es intensamente oscura, una de las más oscuras que se conocen en cuerpos celestes, comparable a los anillos de Urano (tan solo refleja 4% de la luz solar que ilumina).
Así, ahora se sabe que el núcleo no es una brillante bola de hielo, sino una oscura bola de hielo y polvo cubierta de una delgada capa de un material oscuro constituido probablemente por derivados de carbono.
El espesor de la película es de solo 1 cm, según los científicos soviéticos que se basaron en datos enviados por las naves Vega 1 y Vega 2. Esta capa, aunque delgada, es suficiente para evitar en gran medida el reflejo de los rayos solares y al mismo tiempo la evaporación del agua.
Los sensores infrarrojos del Vega 1 detectaron una temperatura de 59°, temperatura más que suficiente para que el hielo sublime.
La costra tiene perforaciones por donde salen chorros de gas y polvo que se proyectan al espacio. Cuando menos siete chorros grandes y algunos pequeños se detectaron en la superficie del cometa.
Vega 1 determinó que se eliminan 10,000 kg de polvo cada segundo durante el máximo de la intensidad.
Los chorros de gas y polvo están constituidos principalmente por vapor de agua (80% en volumen), por lo que por este concepto se eliminan 5 000 kg de agua por segundo. Se encontró que junto con el agua se eliminan grandes cantidades de amoniaco (NH3, 10%) y metano (CH4, 7%), así como bióxido de carbono (CO2, 3.5%).
Los espectrómeros de masa instalados a bordo de la nave europea Giotto detectaron la presencia de una gran cantidad de partículas cargadas provenientes de la ruptura de moléculas tales como H — O., H+, H — O-, H· También detectaron la presencia de iones de carbono, oxígeno, sodio, azufre y fierro.
La nave japonesa Susei, que pasó el 8 de marzo a una distancia de 100 000 kilómetros
del núcleo, encontró que el cometa respira hidrógeno: cada 53 horas sube la
intensidad de hidrógeno debido al periodo de rotación, ya que en un momento
dado presenta la cara que es sensible al Sol, pero al girar muestra la otra
cara, dejando de eliminar hidrógeno.
COMPUESTOS OXIGENADOS DEL CARBONO
Conforme la atmósfera de la Tierra fue adquiriendo oxígeno, éste se fue consumiendo en la oxidación de los distintos elementos y moléculas que existían en ella. Al no haber suficiente oxígeno atmosférico, no había posibilidad de combustión; tanto el hidrógeno como los hidrocarburos podían calentarse a elevadas temperaturas sin producción de fuego.
Fueron necesarios muchos millones de años para que la cantidad de oxígeno atmosférico se elevara lo suficiente para poder sustentar la combustión. Ésta es una reacción de oxidación en la que el hidrógeno se combina con el oxígeno del aire produciendo su óxido, que es el agua. En esta reacción violenta se produce, además, luz y calor.
Cuando prendemos fuego a un hidrocarburo líquido o mezcla de hidrocarburos como
la gasolina vemos que el líquido desaparece totalmente. Lo que sucede en realidad
es que, al combinarse con el oxígeno atmosférico, sus átomos de carbono producen
el gas bióxido de carbono, mientras que sus átomos de hidrógeno forman vapor
de agua, y ambos óxidos en que se transformó el hidrocarburo ascienden a la
atmósfera sin dejar huella del líquido combustible.
La oxidación de un hidrocarburo no es siempre total; existen estados intermedios
con incorporación parcial de oxígeno. Las moléculas provenientes de estas oxidaciones
parciales son de gran importancia para la vida.
Los pasos sucesivos en la oxidación del gas etano serán las siguientes:

Analicemos algunos de los compuestos oxigenados del carbono.
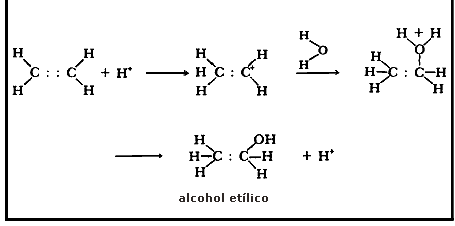
Cuando se sustituye uno de los hidrógenos de un hidrocarburo por un grupo oxhidrilo (OH) se obtiene un nuevo grupo de sustancias a las que se llama alcoholes.
Los alcoholes, cuyo grupo característico es el oxhidrilo (OH), poseen propiedades parecidas a las del agua (HOH), sobre todo en los de más bajo peso molecular. Son miscibles con agua y tienen alto punto de ebullición, que con frecuencia es varios cientos de grados superior al del hidrocarburo del que derivan.
Por ejemplo, el metano, CH4, es gas aún a 162 grados bajo cero, mientras que su alcohol correspondiente, el metanol (CH3OH), es un líquido con punto de ebullición de 64.5°, es decir los puntos de ebullición de ambas sustancias difieren en 226.5°.
La diferencia entre el etano (CH3CH3) y el alcohol etílico (CH3CH2 OH), aunque sigue siendo muy grande (166°), disminuye sensiblemente con respecto a la del par metano/metanol. A medida que aumenta el peso molecular de los alcoholes, las diferencias de punto de ebullición con respecto a sus hidrocarburos van siendo menores (cuadro 1). Puesto que al aumentar el número de átomos de carbono, la molécula va teniendo cada vez más características de hidrocarburo y diferenciándose cada vez más del agua, es por esto que los alcoholes con muchos átomos de carbono y un solo oxhidrilo no son solubles en agua.
La explicación de los altos puntos de ebullición en los alcoholes es la misma que se ha dado para el agua, es decir existen puentes de hidrógeno que ligan varias moléculas entre sí.
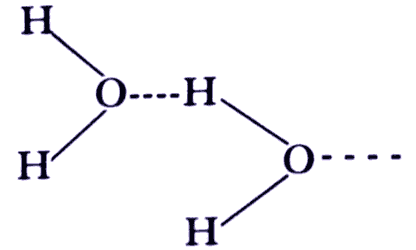
De la misma manera, los átomos de oxígeno de una molécula de alcohol atraen
a los hidrógenos de una segunda molécula de alcohol. Esta asociación entre moléculas
explica tanto la solubilidad en agua de los alcoholes de bajo peso molecular,
como su relativamente alto punto de ebullición.
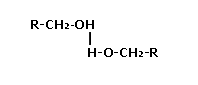
METANOL, ALCOHOL METÍLICO O ALCOHOL DE MADERA
El alcohol metílico, el más sencillo de los alcoholes, tiene un solo átomo de
carbono, y su preparación difiere un poco de la correspondiente a los demás
alcoholes. El método más antiguo consiste en una destilación seca de la madera,
por lo que se le conoce como alcohol de madera.
Este procedimiento es el empleado por los fabricantes de carbón vegetal, sólo que ellos lanzan a la atmósfera todos los componentes volátiles como el metanol y la acetona. En la actualidad existen métodos más baratos y eficientes para su preparación.
El alcohol metílico es venenoso. Si se ingiere, se respiran sus vapores o se expone la piel a su contacto por un periodo prolongado, puede provocar ceguera y aun la muerte, por lo que es necesario ser muy cuidadosos para no confundirlo con el alcohol etílico.
El alcohol metílico se usa ampliamente como disolvente en química orgánica, es decir como medio en que se llevan a cabo muchas reacciones químicas.
ALCOHOL ETÍLICO
Es quizá el primer disolvente químico preparado por el hombre. Se produce en la fermentación de líquidos azucarados. Es usado como disolvente para pinturas, barnices, lacas y muchos otros materiales industriales. También se utiliza ampliamente como desinfectante.
Debido a que también se emplea ampliamente como ingrediente de bebidas alcohólicas, cuando se vende para usos industriales se le agrega una sustancia que le comunica mal olor o mal sabor. Al alcohol así preparado se le llama alcohol desnaturalizado. El alcohol industrial contiene normalmente 95% de alcohol y tiene un punto de ebullición de 78°. La eliminación del 5% de agua restante para llegar a obtener el alcohol absoluto es muy difícil.
Como dijimos anteriormente, conforme aumenta el número de átomos de carbono en un alcohol sus propiedades se asemejan cada vez más a las de un hidrocarburo. Así, por ejemplo, su solubilidad en agua va diminuyendo a medida que su punto de ebullición más se va acercando a la del hidrocarburo (Cuadro 1).
CUADRO 1. Propiedades físicas de hidrocarburos y de sus correspondientes alcoholes.
|
|
Hidrocarburo | P.eb. | Alcohol | P.eb. | Diferencia en. p.eb. |
| metano | CH4 |
-162°
|
metílico | +64.5 | 226.5° |
| etano | CH3-CH3 |
-88
|
etílico | +78.3 | 166 |
| propano | CH3CH2CH3 |
-42
|
propílico | +97 | 139 |
| butano | CH3(CH2)CH3 |
0
|
n-butílico | +118 | -118 |
| pentano | CH3(CH2)3CH3 |
36
|
n-penílico | +138 | 102 |
| hexano | CH3(CH2)4CH3 |
69
|
n-hexílico | +156 | 87 |
| heptano | CH3(CH2)5CH3 |
98
|
n-heptílico | +176 | 78 |
| octano | CH3(CH2)6CH3 |
126
|
n-octiílico | +195 | 69 |
| n-decano | CH3(CH2)8CH3 |
174
|
n-decílico | +228 | 54 |
Uno de los casos extremos que podemos observar en el cuadro es el del metano:
mientras que éste es un gas incluso a una temperatura extremadamente baja (-l62°),
su alcohol correspondiente, el alcohol metílico, es líquido a temperatura ambiente:
hierve a 64.5° a nivel del mar. Existe por lo tanto una diferencia
de 226.5° entre los puntos de ebullición. Esta diferencia, en cambio,
ya no es tan impresionante en caso del hidrocarburo de ocho átomos de carbono,
pues entre el octano normal que hierve a 126° y su alcohol que lo
hace a 195° se presenta una diferencia de tan sólo 69°.
Lo mismo sucede cuando se comparan las solubilidades en agua: mientras el metanol y el etanol son totalmente miscibles con el agua, del alcohol octílico sólo se disuelven 0.5 g en 100 de agua.
No sólo existe la posibilidad de inserción de un átomo de oxígeno entre un
carbono y un hidrógeno para dar un alcohol, sino que también existe la posibilidad
de inserción de oxígeno entre dos átomos de carbono, lográndose así la formación
de las sustancias llamadas éteres. El más sencillo de ellos es el éter metílico
CH3OCH3, siguiéndole
el metil etil éter CH3OCH2CH3
y el éter etílico CH3CH2OCH2CH3.

Figura 9.
El éter etílico es una sustancia líquida de bajo punto de ebullición de mucha importancia, ya que se usa en medicina como anestésico y en los laboratorios de química como disolvente volátil e inmiscible en el agua. Precisamente debido a su insolubilidad en agua se emplea para extraer sustancias que se encuentran disueltas o suspendidas en agua. Para ello se usa un embudo de separación, como se muestra en la figura 9.
Para lograr una buena extracción, se agita el embudo para que ambos líquidos no miscibles se pongan en contacto, y luego se coloca el embudo en un soporte para que, al reposar, el agua y el éter se separen. El agua ya agotada que queda en la parte inferior del embudo es eliminada, quedando el éter con la sustancia disuelta. Para recuperar la sustancia que originalmente estuvo en el agua lo que se hace es evaporar el éter, de esta manera la sustancia quedará como residuo.
OTROS COMPUESTOS OXIGENADOS DEL CARBONO: ALDEHÍDOS,
CETONAS, ÁCIDOS
Los alcoholes se dividen en tres clases: primarios (1), secundarios (2) y terciarios
(3).
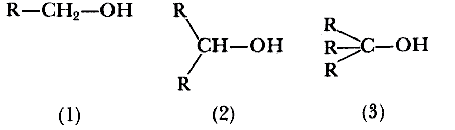
Los alcoholes primarios pierden por oxidación dos átomos de hidrógeno dando
un aldehído. Así, por ejemplo, el alcohol metílico al perderlos dará el metanal
o formol.

El formol es un gas cuya solución acuosa al 37% se usa para conservar los cadáveres.
A su vez, el formol es susceptible de ser oxidado para dar el ácido fórmico, que es el ácido que tienen las hormigas y que contribuye a causar la irritación que provocan sus mordeduras.
Los aldehídos en la formación de un espejo de plata
Para la formación de un espejo de plata por deposición de plata sobre un vidrio limpio primero se prepara nitrato de plata amoniacal. Esto se hace agregando suficiente amoniaco disuelto en agua (NH4OH) a una solución de nitrato de plata hasta que el precipitado de hidróxido de plata que se forma al principio se disuelva.
Ag+ NO3- + NH4OH
Espejo. Cuando ya se tiene preparado el nitrato de plata amoniacal, contenido en un tubo de ensaye muy limpio, se agrega formol. Al hacerlo, de inmediato se depositará una capa de plata metálica en las paredes formando un espejo. Si las paredes del tubo no estuviesen suficientemente limpias, la plata se precipitará como un polvo café oscuro.
2 Ag(NH3)+ NO3-HCH = O + H2O ![]() 2
Ag0 + HCOONH4 + 2 NH4NO3+ NH3
2
Ag0 + HCOONH4 + 2 NH4NO3+ NH3
Tollens observó que la sensibilidad de la reacción aumenta cuando se agregan pequeñas cantidades de hidróxido de sodio.
Preparación de urotropina
La urotropina es una sustancia sólida que se usa como desinfectante de las vías urinarias. Se prepara mezclando formalina (solución acuosa de formol en agua al 37%) con una solución diluida de hidróxido de amonio.
La mezcla se deja reposar por bastante tiempo y luego se evapora calentando a 100°. La urotropina se depositará como un sólido de sabor dulce.
La urotropina o hexametilentetramina se forma de acuerdo con la siguiente ecuación:
6HCH=O+4NH3![]() (CH2)6+6H2O
(CH2)6+6H2O
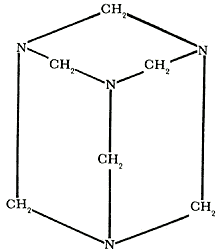
El formaldehído forma dos tipos de polímeros (poli, muchos; meros, parte). Uno de ellos es cuando los átomos de carbono de una molécula se unen con los átomos de oxígeno de otra; el segundo tipo, cuando las moléculas se unen por medio de los átomos de carbono.
Los polímeros del primer tipo incluyen al paraformaldehído y al polioximetileno, y los del segundo, a los azúcares.
Etanal o acetaldehído
El etanal o acetaldehído es el producto de la oxidación suave del etanol. Es un líquido que hierve a 20.2°, incoloro y soluble en agua.
El acetaldehído al ser tratado con cloro produce el aldehído dorado llamado
cloral, que es materia prima para la preparación del insecticida DDT.
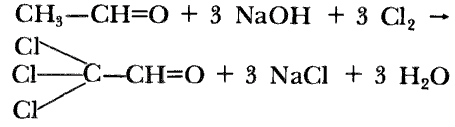
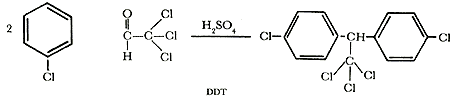
Preparación del insecticida DDT
El tricloroacetaldehído o cloral, obtenido por tratamientos de acetaldehído con cloro, es la materia prima para la obtención del insecticida DDT.
Cuando el cloral se hace reaccionar con clorobenceno en presencia de ácido sulfúrico, el producto es la sustancia clorada DDT, cuyas propiedades insecticidas son ampliamente conocidas.
Efectos contaminantes. Mucho se ha hablado de los efectos contaminantes
del DDT. Y en efecto, se sabe que uno de los principales productos de
descomposición del DDT en la naturaleza es el para-dicloro-fenil-eteno,

una de cuyas acciones nocivas es la inhibición de la enzima anhidraza carbónica,
que es la que controla la participación del calcio en la formación del cascarón
de los huevos de las aves. Debido a esta inhibición, los cascarones son débiles
y se rompen con facilidad, disminuyendo por lo tanto la reproducción de muchas
aves.
Cuando el alcohol no es primario, es decir cuando el OH no se encuentra al final de la cadena como sucede en el etanol, sino que se encuentra sobre un átomo central, la oxidación da origen a sustancias llamadas cetonas. Así, por ejemplo, la oxidación del isopropanol o alcohol isopropílico,
da origen a la dimetil-cetona, más conocida como acetona.
Esta sustancia es un disolvente muy apreciado en los laboratorios de química
y muy conocido entre las damas, quienes lo usan constantemente para eliminar
el colorante de sus uñas cuando se ha dañado.
Oxidaciones más avanzadas
Cuando la oxidación de un aldehído continúa, se llega a un ácido carboxílico.
De esta manera del metanol se pasa a formaldehído y de éste a ácido fórmico.
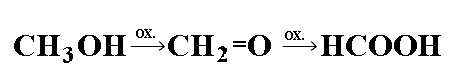
En el caso del etanol, los pasos serán, primero, la obtención de acetaldehído, y después, por medio de una oxidación más avanzada, ácido acético.
CH3CH2OH![]() CH3CHO
CH3CHO ![]() CH3COOH
CH3COOH
Y así seguiremos con los otros alcoholes. El siguiente paso después del ácido
es la formación de bióxido de carbono (CO2), representando
el grado máximo de oxidación de cualquier sustancia orgánica. El CO2
liberado en esta oxidación total se incorpora a la atmósfera, de donde será
utilizado por organismos terrestres y acuáticos para la formación de nuevos
compuestos orgánicos.
REFERENCIAS
1. S. Mason, "Biomolecular handedness", en Chem. in Brit 21 (6) 538 (1985).
2a). J. D. Wilson y 1 K. Hamilton, "Wood cellulose as a chemical feedstock for the cellulose esters industry", en J. Chem. Ed. 63, 49 (1986).
2b). R. Gray y R. A. Parham, "Wood Chemistry", en Chem. Tech. 232 (1982).
3. C. Gay García, "Atmósferas planetarias", en Naturaleza 12, 353 (1981)
4. J. Pfeifer "From Galaxies to Man", en Random House, Nueva York 1959.
5. N. Henbest "Halley's Comet, more dirt than snow" New Scientist, marzo de 1986, p. 37.
6. R. Dagani "Studies of Halley's comet yield a huge scientific bonanza": Chem. and Eng. News, agosto, 25, p. 7 (1986).