I. ÁTOMOS Y MOLÉCULAS EN EL UNIVERSO. LA TABLA PERIÓDICA DE LOS ELEMENTOS
ASTRÓNOMOS y físicos han postulado como origen del Universo una gran explosión, que a partir de un gas denso formó las innumerables galaxias que ahora pueblan el Universo. Una de dichas galaxias es la Vía Láctea, formada por más de 100 mil millones de estrellas, entre las que se encuentra nuestro Sol.
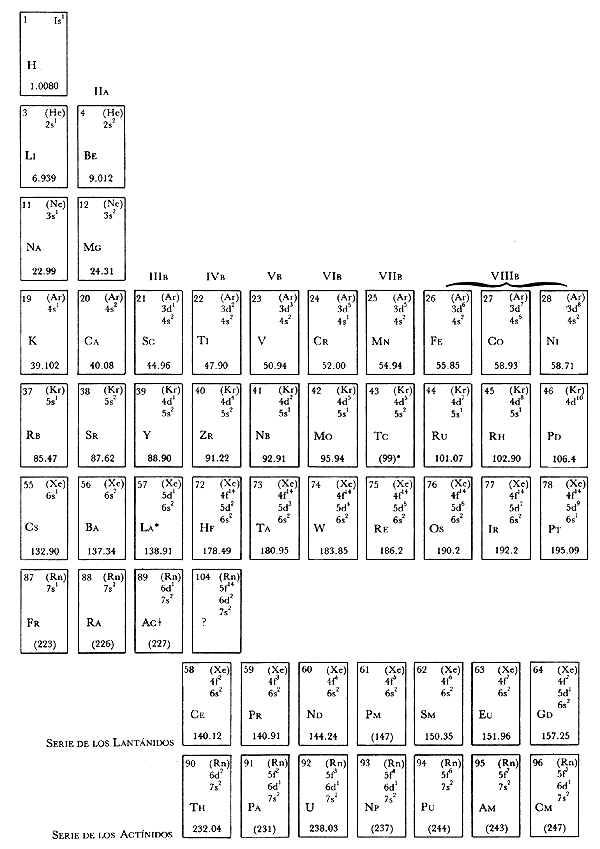
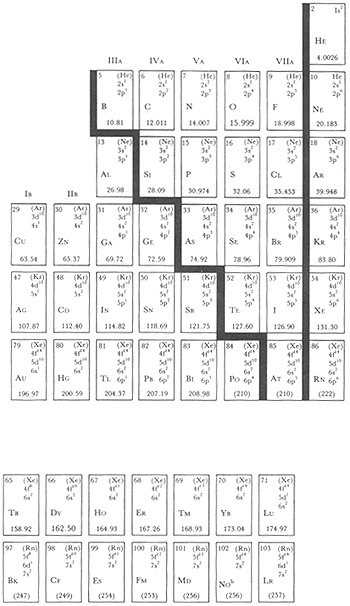
Cuando la temperatura del Universo era de alrededor de mil millones de grados, se comenzaron a formar los núcleos de los elementos. Primero se formaron los más simples, el hidrógeno (H) y el helio (He); posteriormente, en el interior de las estrellas se fueron formando los núcleos de otros elementos, hasta llegar a un número cercano a 100. Los químicos los han ido descubriendo poco a poco y han encontrado que se pueden clasificar de acuerdo con sus propiedades físicas y químicas en lo que se ha nombrado la tabla periódica de los elementos (Figura 1).
Más tarde, el Universo se fue enfriando paulatinamente hasta llegar a una temperatura de 3°K, que es la que tienen en la actualidad los espacios interestelares.
Los primeros elementos formados, que son también los más ligeros, el hidrógeno
(H) y el helio (He), siguen siendo los principales constituyentes
del Universo. El hidrógeno se encuentra en una proporción superior a 90% y el
helio en alrededor de 8%. Estos elementos son más abundantes en el Sol y en
las otras estrellas.
El hidrógeno, el elemento más sencillo y más abundante en el Universo, es un gas más ligero que el aire, por lo que, al llenar un globo con él, habrá necesidad de sujetarlo, o de lo contrario, se elevará por los aires. Esta propiedad fue aprovechada por el hombre para viajar por la atmósfera. Desde finales del siglo XVIII se construyeron máquinas voladoras para transportar hombres y equipo. Estas naves, llamadas dirigibles, eran peligrosas por el carácter inflamable del hidrógeno con el que se habían llenado.
El átomo de hidrógeno (H), como hemos dicho, el elemento más sencillo del Universo, está formado por un núcleo, llamado protón, que posee una carga positiva, la cual se encuentra neutralizada por un electrón (carga negativa).
El hidrógeno se combina con otros elementos formando moléculas. Cuando se mezcla con oxígeno en un soplete y se le prende fuego, arde produciendo flama de color azul pálido, liberando tal cantidad de calor que funde al hierro con facilidad, por lo que el soplete oxhídrico se usa para cortar láminas de acero. En esta reacción el oxígeno y el hidrógeno se combinan produciendo agua, que se escapa en forma de vapor.
Cuando en un recipiente cerrado se pone una unidad de peso de hidrógeno por 8 de oxígeno y se produce en su interior una chispa eléctrica, se provoca una explosión con formación de agua (Figura 2) sin gases sobrantes, pero si la cantidad de uno de los gases excede a las proporciones antes dichas, quedará el exceso sin reaccionar. A esto se le llama Ley de las proporciones constantes e indica que dos átomos de hidrógeno, cada uno de peso atómico 1, reaccionan con un átomo de oxígeno, con peso atómico de 16, produciendo una molécula de agua, con peso molecular de 18.
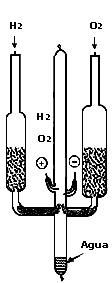
Figura 2. Síntesis de agua partiendo de hidrógeno y oxígeno mediante una chispa
eléctrica.
PROPIEDADES DEL AGUA
El agua, producto formado en la combustión del hidrógeno, es la molécula más abundante en la Tierra, donde se le encuentra en sus tres estados físicos: como líquido, cubriendo las 3/4 partes de la superficie del planeta, constituyendo mares, ríos y lagos; como vapor, en grandes cantidades en la atmósfera, de donde se precipita como lluvia o nieve, y en su estado sólido (hielo), formando depósitos sobre las altas montañas y cubriendo las regiones polares y en este caso en tal cantidad, que si este hielo se fundiera, el nivel del océano subiría de tal manera que inundaría la mayor parte de las ciudades costeras y gran parte de las tierras bajas, incluyendo países enteros como Holanda, que quedaría totalmente bajo las aguas.
Esta molécula tan singular y abundante es la base de la vida; constituye más de la mitad del peso de los seres vivos. En los organismos marinos se le encuentra en una proporción de más de 90% en peso.
El agua, en estado puro, es un líquido incoloro, inodoro e insípido. Las propiedades físicas de tan importante sustancia a menudo se toman como tipo: su punto de fusión es de 0° su punto de ebullición a nivel del mar es de 100° la mayor densidad del agua se alcanza a 4°, siendo de 1 g/ml, es decir que cada mililitro pesará un gramo y por lo tanto un litro pesará un kilogramo.
Su calor específico es de 1.00 caloría por grado, por gramo, o lo que es lo mismo, un gramo de agua elevará su temperatura en un grado centígrado cuando se le suministra una cantidad de energía en forma de calor equivalente a una caloría. Por ejemplo, para elevar la temperatura de un litro de agua de 20 a 21° se necesitará suministrar una cantidad de calor equivalente a 1 000 calorías.
Como se ve, las propiedades físicas del agua son casi siempre la unidad. Esto no es accidental, pues siendo el agua el líquido más abundante y accesible y teniendo propiedades tan singulares, no es de extrañar que se le tome como referencia para medir las de otras sustancias, sobre todo si son líquidas.
El agua en estado sólido es menos densa que en forma líquida.
El hecho de que el hielo sea menos denso que el agua líquida tiene gran importancia en el mantenimiento de la vida en las regiones frías del planeta: cuando un lago se congela, sólo lo hace en su superficie, ya que el hielo, por ser menos denso que el agua, flota sobre ella y, por ser mal conductor del calor, aisla las capas más profundas impidiendo su congelación, con lo que se logra mantener las condiciones apropiadas para la conservación de la vida. Este hecho afortunado para la vida en el planeta tiene, sin embargo, consecuencias negativas para lo que llamamos progreso de nuestra civilización, ya que los grandes témpanos de hielo (icebergs) son un peligro para la navegación en aguas frías y han destruido muchas embarcaciones.
Más aún, el agua de las tuberías, que la conducen a nuestras ciudades, se expande al congelarse, rompiendo las tuberías; lo mismo sucede con muchos recipientes rígidos que se rompen cuando se congela el agua que contienen.
LAS GRANDES RESERVAS DE AGUA COMO REGULADORAS DEL CLIMA
Como el agua se calienta o enfría más lentamente que el suelo, sirve para regular
la temperatura. Es por eso que en las regiones alejadas del mar se tienen climas
más extremosos que en las regiones marítimas.
El agua no sólo es abundante en la Tierra, también se ha detectado en otros cuerpos celestes. Por ejemplo, en Marte, aunque ha desaparecido de su superficie dejando vacíos los lechos de lagos y ríos, ya que la escasa gravedad del planeta (40% de la terrestre) no la pudo retener, existe agua congelada en los polos, donde se encuentra mezclada con hielo seco (CO2 sólido). También debe existir debajo de la corteza marciana, ya sea como hielo en invierno o líquida en verano. El cometa Halley la contiene en forma de hielo, como revelan los últimos informes.
AGUA OXIGENADA, PERÓXIDO DE HIDRÓGENO H2O2
El agua no es la única combinación que puede obtenerse entre hidrógeno y oxígeno.
Existe además un compuesto que tiene un átomo de oxígeno más que el agua. La
sustancia así formada es conocida como agua oxigenada, llamada con más
propiedad peróxido de hidrógeno, cuya estructura es H2O2
o HO-OH. Esta sustancia, por tener un átomo de oxígeno extra, es inestable,
es decir, libera oxígeno con facilidad para quedar como agua común. El agua
oxigenada, por su facultad de liberar oxígeno, mata a muchos microbios por lo
que se emplea como desinfectante de heridas, en cuyo contacto se puede ver al
oxígeno desprenderse en forma de burbujas.
El agua oxigenada que se consigue en la farmacia como agente desinfectante es muy diluida, contiene sólo tres partes de agua oxigenada por 97 de agua común. El agua oxigenada que se emplea como oxidante en laboratorios químicos es más concentrada, pues contiene 30 partes de H2O2 por 70 de agua ordinaria. Esta solución tan concentrada es peligrosa, puesto que causa quemaduras al ponerse en contacto con la piel.
El agua oxigenada se emplea como decolorante, por lo que se utiliza, entre otras aplicaciones, para aclarar el color del pelo.
2 H2O2 ![]() 2
H2O + O2
2
H2O + O2
PREPARACIÓN DE HIDRÓGENO
El hidrógeno se puede liberar de las moléculas en las que se encuentra combinado con otros elementos. Ya que el agua es el compuesto de hidrógeno más abundante y accesible, será la materia prima en que primero se piense para preparar hidrógeno. Como el agua está formada por átomos de hidrógeno (H.), cuyo único electrón se pierde con cierta facilidad para dar iones positivos (H+) al pasar una corriente eléctrica a través del agua, es de esperarse la generación de protones que, por tener carga positiva, serán atraídos hacia el polo negativo (cátodo), donde se descargarán, liberando, por tanto, hidrógeno gaseoso (H2)
Sin embargo, existe el problema de que el agua pura es mala conductora de la
corriente eléctrica, por lo que es necesario disolver en ella una base o un
ácido fuerte que la hagan conductora. Disolvamos, por ejemplo, ácido nítrico
(HNO3), cuyo protón se separa con facilidad (HNO3![]() H + NO3-) de los iones
nitrato (NO3-). En esta solución, que ahora es
conductora, los protones, por tener carga positiva, viajarán hacia el cátodo
o polo negativo, donde se descargan generando dos volúmenes de gas hidrógeno,
mientras que en el polo positivo o ánodo se desprenderá un volumen de oxígeno
gaseoso (Figura 3).
H + NO3-) de los iones
nitrato (NO3-). En esta solución, que ahora es
conductora, los protones, por tener carga positiva, viajarán hacia el cátodo
o polo negativo, donde se descargan generando dos volúmenes de gas hidrógeno,
mientras que en el polo positivo o ánodo se desprenderá un volumen de oxígeno
gaseoso (Figura 3).
A esta reacción se le conoce como electrólisis, es decir, ruptura de una molécula por medio de electricidad. Tan útil reacción no sólo se emplea para romper la molécula de agua, sino que se usa también para liberar los metales de sus sales.
Los iones metálicos (positivos) viajarán al cátodo en donde se descargan y se depositan, pudiéndose de esta manera recubrir un metal con otro. Por ejemplo, si la sal utilizada es sulfato de níquel, el ión de este metal viajará hacia el cátodo, y si éste es una pieza de hierro perfectamente limpio, se recubrirá con una capa homogénea de níquel que le dará un bonito aspecto y lo protegerá de la oxidación.
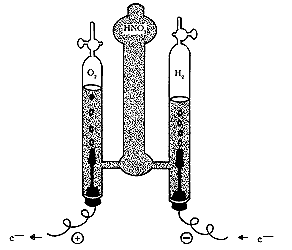
Figura 3. Descomposición del agua por electrólisis.
Por este procedimiento, entonces, se pueden recubrir metales con otros metales
que tengan el aspecto o las propiedades físicas o químicas deseadas. Si el recubrimiento
se efectúa con cromo, se tendrá el cromado; si es la plata el metal que se usa
para recubrir, se tendrá el plateado; y así como estos ejemplos existen otras
muchas posibilidades de usar la electrólisis para recubrir un metal con otro.
La electrólisis tiene múltiples aplicaciones prácticas, entre otras, la obtención
y purificación de metales. Por este procedimiento se purifica el cobre y se
obtiene el aluminio.
OBTENCIÓN DE HIDRÓGENO POR DESCOMPOSICIÓN DEL AGUA CON
METALES
Cuando se arroja un pequeño trozo de sodio metálico sobre agua se efectúa una
reacción violenta, se desprende hidrógeno y se genera calor. En ocasiones la
reacción es tan violenta, que el hidrógeno liberado se incendia.
2Na + 2 H2O![]() 2 NaOH + H2
2 NaOH + H2
PREPARACIÓN DE H2 EN EL LABORATORIO.
Una forma más moderada y fácil de controlar la reacción para preparar hidrógeno
es la descomposición de un ácido fuerte por medio de un metal como fierro o
zinc (Figura 4).

Figura 4. Descomposición de un ácido fuerte por medio de un metal.
En esta reacción el metal desplazará al hidrógeno formando la sal llamada cloruro
de zinc. Si el hidrógeno liberado se hace arder en presencia de aire, se podrá
condensar el agua formada por la combinación con el oxígeno del aire, justificando
así su nombre que en griego significa "el que forma agua".
LA ELECTRÓLISIS EN LA OBTECIÓN DE METALES
Aluminio
El aluminio es el tercer elemento más abundante en la corteza terrestre. Se
le encuentra formando parte de minerales tan comunes como el granito y la mica,
las arcillas con las que se hacen los ladrillos, y el caolín con el que se fabrica
la porcelana y se recubren los utensilios de cocina para proteger al hierro
de la oxidación (peltre).
La bauxita es un óxido de aluminio muy abundante. De él se obtiene el aluminio metálico mediante un proceso electrolítico muy ingenioso, descubierto simultáneamente en los Estados Unidos por Charles M. Hall, joven de 22 años, y en Francia por un joven, también de 22 años, llamado P. L. T. Heroult.
El procedimiento descubierto por ambos jóvenes nacidos en 1863 fue idéntico; ambos se hicieron ricos, disfrutando de ello hasta el fin de sus vidas, que curiosamente aconteció, también en ambos casos, en 1914.
Para obtener aluminio a partir de bauxita, ésta es previamente purificada, y disuelta posteriormente en un baño de criolita fundida. La solución caliente de bauxita (óxido de aluminio o A12 O3) en criolita es colocada en una tina de carbón, se insertan en ellas barras de grafito y se hace pasar corriente eléctrica a través del mineral fundido. Como resultado de este proceso, el óxido se descompone y el aluminio se deposita en el fondo de la tina, de donde es posible recuperarlo.
Con este descubrimiento, el aluminio se abarató, y como llegó a ser tan común
y sus usos tan variados, hoy en día se le puede ver en todas las cocinas y formando
parte de las fachadas de la mayoría de los edificios.
Helio
El helio, segundo elemento más abundante en el Universo y en el Sol, es también
un gas ligero que, a diferencia del hidrógeno, es inerte, es decir, no se combina
con otros elementos. Como no es inflamable, se usa con plena confianza en el
llenado de dirigibles. El helio es tan poco reactivo, que no se combina ni consigo
mismo, por lo que se encuentra como átomo solitario He, en vez de encontrarse
en forma de moléculas diatómicas como el oxígeno (O2) o el
hidrógeno (H2).
El helio, primero de los gases nobles, tiene en su núcleo dos protones y su
única capa electrónica se encuentra saturada con dos electrones, razón por la
que es un elemento inerte.

Los demás elementos que existen en el Universo van siendo cada vez más pesados y se encuentran ordenados en la tabla periódica (Figura 1).
Los únicos elementos que no reaccionan y permanecen siempre como átomos solitarios
son los gases nobles. Estos elementos se les encuentra, encabezados por el helio,
en la última columna de la tabla periódica. Como ya vimos en el caso del helio,
son inertes por tener saturada su última capa electrónica; por lo tanto, ni
reciben ni dan ni comparten electrones con otros átomos.
LA ATMÓSFERA PRIMITIVA DE LA TIERRA
Cuando en el planeta Tierra aún no se iniciaba la vida, debió de existir una
atmósfera muy diferente a la actual.
El científico ruso Oparin supone que estaba compuesta por vapor de agua (H20), amoniaco (NH3) e hidrocarburos, principalmente metano (CH4), conteniendo también ácido sulfhídrico (H2S).
Tal mezcla de gases, sometidos a las altas temperaturas y a la radiación ultravioleta que llegaba del Sol sin obstáculos, debieron dar origen a nuevas moléculas orgánicas, como los aminoácidos.
En 1953, el científico estadounidense Miller dio apoyo a la teoría de Oparin mediante un experimento bastante sencillo: puso en un recipiente cerrado vapor de agua (H20), metano (CH4), hidrógeno (H2) y amoniaco (NH3), y sometió esta réplica de la atmósfera primitiva a descargas eléctricas durante una semana; al cabo de ese tiempo se habían formado en su interior ácidos orgánicos, distintos aminoácidos y urea. Reacciones como la mencionada debieron realizarse continuamente en la atmósfera de aquel entonces. Más aún, es muy probable que el vapor de agua contenido en ella se disociara por acción de los rayos ultravioleta, dando lugar a la generación de oxígeno. Éste, en ese momento, debido a su reactividad, no llegó nunca a concentraciones apreciables, pues se combinaba con los elementos de la corteza terrestre para dar óxidos. De esta manera oxidó al amoniaco (NH3), que abundaba en la atmósfera de la Tierra joven, dando como producto agua y nitrógeno. Con el tiempo, la cantidad de este último aumentó gradualmente hasta llegar a predominar en la atmósfera. Por su parte, una cierta cantidad del O2 que quedaba se combinó entre sí, debido a la acción de la radiación ultravioleta que llegaba del Sol sin encontrar ningún obstáculo, dando lugar a la formación del ozono (O3), el cual, al formar una capa en la atmósfera superior, impidió posteriormente, en gran medida, la entrada de este tipo de rayos, con lo que se facilitó de esta manera la aparición de la vida vegetal. Ésta, a su vez, por medio de la fotosíntesis, descompuso el CO2, con la consiguiente liberación de oxígeno, el que gradualmente se fue acumulando en la atmósfera hasta propiciar la vida animal. La atmósfera de la Tierra, así, poco a poco se fue acercando a la composición que tiene actualmente y de la que disfrutamos los habitantes de la Tierra, compuesta por 78% de nitrógeno (N2), 21% de oxígeno (O2), 0.9% de argón (Ar), vapor de agua (H2O), bióxido de carbono (CO2), además de otros elementos y moléculas en pequeñas proporciones. En nuestros días el O2 ha ido en aumento hasta llegar a ser el elemento más abundante de la corteza terrestre: ±50 por ciento.
Todos los átomos y moléculas mencionados, excepto los gases nobles helio (He) y argón (Ar), son constituyentes indispensables de los seres vivos.
El resto de los planetas de nuestro sistema solar no son tan afortunados como el nuestro, pues ninguno tiene agua en abundancia ni tiene atmósfera rica en oxígeno.
Las condiciones que existen en los planetas más cercanos al Sol, Mercurio y Venus, son impropias para la vida. En Mercurio existen temperaturas superiores a los 300° en el día e inferiores a 200° bajo cero por la noche. Su atmósfera, constituida por gases inertes como helio, argón y neón, la hace completamente irrespirable para el ser humano, quien moriría por asfixia en poco tiempo.
Venus, por su parte, tiene temperaturas también muy altas y una atmósfera muy ácida, donde predomina el bióxido de carbono, además de ácidos fuertes como el sulfúrico, el clorhídrico, el fluorhídrico y el sulfhídrico.
Los grandes planetas más alejados de la Tierra: Júpiter, Saturno, Urano y Neptuno,
además de ser muy fríos, tienen una atmósfera en que el principal constituyente
es el hidrógeno, aparte de cantidades apreciables de helio y metano. Tienen,
por consiguiente, atmósferas reductoras impropias para la vida humana.
COMPONENTES DEL CUERPO HUMANO
Los principales elementos de que está formado el cuerpo humano son carbono (C),
oxígeno (O), hidrógeno (H) y nitrógeno (N), elementos que son también los principales
componentes de otros seres vivos, desde los organismos unicelulares hasta los
enormes seres pluricelulares, como las ballenas y los grandes árboles, ejemplo
de los cuales tenemos el gran ahuehuete de Santa María del Tule, cuyo tronco
mide más de 50 metros de circunferencia.
La molécula más abundante en los seres vivos es el agua. En el ser humano llega a ser más de 70% de su peso. De manera que si un hombre de 100 kg de peso fuese desecado, su materia seca pesaría tan solo 30 kg. Ahora bien, si esta materia restante fuese incinerada, la mayor parte se convertiría en bióxido de carbono que regresaría a la atmósfera. Lo mismo sucede con el nitrógeno de sus proteínas, las que al ser convertidas en óxidos de nitrógeno pasarían a la atmósfera. Como material sólido quedarían las cenizas, que son óxidos provenientes de los componentes inorgánicos del cuerpo, entre los que encontraríamos el óxido de calcio o cal viva, además de óxidos de sodio, potasio, hierro y fósforo.
De esta manera, todos los elementos que fueron tomados de la Tierra y de la atmósfera para crear un ser vivo, regresan a su punto de origen, donde quedan en disposición de ser reutilizados.
Los elementos que forman parte de los seres vivos no sólo son importantes constituyentes
de nuestro planeta, lo son también de otros cuerpos celestes, encontrándose
incluso en los espacios interestelares.
REFERENCIAS
1. L. Estrada, "La Historia del Universo", en Naturaleza 13 (5), 217 (1982).
2. R. Carbó y A. Ginebreda, "Interestellar Chemistry", en J. of Chem. Ed. 62 (10), 832 ( 1985).
3. R. H. Gammon, "Chemistry of Interestellar Space", en Chem. and Eng. News 56 (40), 21(1978).
4. R. D. Brown, "The New World of Galactochemistry", en Chem. in Brit. 9, 450 (1973).
5. B. Mason, "Chemistry of the Moon's Surface", en Chem. in Brit. 9, 456 (1973).
6. R. Dagani, "The Planets, Chemistry in Exc dc Places", en Chem. and Eng. News, 10 de agosto de 1981, p. 25.
7. R. Ponamperuman y P. Molton, "Origen de la vida", en Información Científica y Tecnológica, CONACYF 3, 5 (1981).
8. P. Ambruster, "The Discovery of Element 108", en Endeavour 9, 77 (1985).
9. I. Asimov, "Building Blocks of the Universe", en Abelard-Shuman, Londres, Nueva York (1957).
10. A. Pisant, "La tabla periódica", en Naturaleza 15, 93 (1984).
11. I. Fierro, "El origen de las plantas", en Naturaleza 12,337 (1981).
12. J. Davis "Voyage to the Tilted Planet", en New Scientist,
23 de junio de 1986, p. 39.