III. POLÍMEROS Y SEMICONDUCTORES
COMO se mencionó en el capítulo anterior, el siglo XX
parece traer consigo la optimación de los productos de las industrias del carbón
y del petróleo. En este desarrollo, como en muchos otros o la totalidad, para
ser más precisos, es la propia naturaleza quien sugiere los pasos iniciales
y es el ingenio del hombre el que permite y da lugar a desarrollos que son realmente
impresionantes. En la naturaleza existe de manera abundante el elemento carbono,
que es la base de lo que denominamos materia orgánica. Este elemento tiene la
capacidad de combinarse con él mismo y con otros elementos en series continuas,
de modo que se crean moléculas muy grandes. De hecho, la vida misma no hubiera
sido posible sin esta capacidad del carbono, puesto que toda la materia viviente
está formada por moléculas gigantes. De hecho, cuando comemos, lo que hace nuestro
organismo es absorber moléculas gigantes de proteínas, disolverlas y transformarlas
en otras moléculas también gigantes para alimentarnos. Tratando de imitar a
la naturaleza, el hombre ha aprendido a crear moléculas gigantes en el laboratorio
y, de manera industrial, sustituir a las materias orgánicas que se utilizan
en la vida cotidiana. A estas cadenas de moléculas creadas en el laboratorio
se les denomina polímeros sintéticos, que han hecho posible que sustituyamos
en la actualidad materiales tales como la seda, la lana, la piel, la goma, la
madera y distintas fibras vegetales; materiales que inicialmente, de una u otra
manera, han sido provistos por la propia naturaleza.
Desde cierto punto de vista, hemos sustituido o acelerado el trabajo del gusano de seda, el proceso de trasquila del borrego y el trabajo de los telares.
Para poder comprender cómo el hombre ha llegado a reproducir algunas de las propiedades y características de la materia viviente, resulta indispensable el revisar aunque sea de una manera muy rápida el desarrollo de la química, esbozado en los párrafos anteriores.
A principios del siglo XIX, la humanidad contaba con los conocimientos
siguientes: en 1754, en Edimburgo, Joseph Black había logrado extraer bióxido
de carbono (gas) de la piedra caliza, quedando como residuo cal, la que al quedar
expuesta al aire reabsorbía el mismo gas, volviendo a transformarse en piedra
caliza. Aquí había, por una parte, un indicio de que el aire contenía bióxido
de carbono y, por otra, la evidencia de un proceso reversible. El propio Black
logró descomponer la molécula de carbonato de calcio (CaCo3) en dos
moléculas más pequeñas, —cal (CaO) y bióxido de carbono (C02)—,
para volverlas a unir y obtener de nuevo CaCO3.
Alrededor de veinte años más tarde Joseph Priestley obtuvo "un aire extraño" en presencia del cual las velas ardían vivamente y las brasas de leños o carbón desprendían llamas. Este aire extraño era el oxígeno.
Poco tiempo después Henry Cavendish descubrió el "aire inflamable", gas que se desprendía al atacar metales con ácido y que al combinarse con el "aire extraño" producía, en presencia de una chispa, una explosión y unas gotas de agua en las paredes del recipiente que había alojado a los gases. Este "aire inflamable" es lo que hoy conocemos por hidrógeno, y lo que ocurrió durante la explosión fue la síntesis de la molécula de agua (H20). Sin embargo, no se tenía aún conciencia de la existencia del hidrógeno y el oxígeno como elementos, y menos aún se sabía la manera en que se combinaban éstos para formar un compuesto: el agua.
Hubo de revisarse entonces lo que la humanidad había desarrollado y hablar
nuevamente de los átomos de Demócrito y de las teorías de Robert Boyle, que
sostenía que la materia podía estar compuesta de muchos "corpúsculos" en movimiento,
y volver a considerar las ideas de Newton acerca de que la materia podía estar
compuesta por "partículas sólidas, macizas, duras, impenetrables y móviles".
Así, en los albores del siglo XIX, John Dalton y Joseph Proust,
cada uno por su cuenta, lograron demostrar que algunos elementos químicos, al
combinarse con otro cualquiera, lo hacen de tal manera que las cantidades de
ambos intervienen siempre en proporción a sus pesos y serán siempre múltiplos
enteros uno del otro, lo cual, sugirió Dalton, es explicable sólo si se supone
que los elementos están formados por átomos.
Amadeo Avogadro establece claramente la diferencia entre átomo y molécula, siendo ésta la unión de varios átomos.
En esta época, se descubrieron muchos elementos hasta entonces desconocidos, realizándose todo tipo de reacciones químicas, pero siempre con materiales minerales, con lo no vivo: agua, sales, metales y gases, sustancias compuestas por moléculas pequeñas, formadas por pocos átomos. La mayoría de estas moléculas se podían descomponer en sus elementos, preparar compuestos con ellos y casi siempre hacerlas intervenir en procesos reversibles.
Mientras tanto, los materiales del mundo vivo, la madera, los azúcares, las grasas, aceites, etc., seguían en el misterio y apenas se sabía que lo que tenían en común era ser combustibles, carbonizar y tomar parte en procesos químicos irreversibles. Antoine Lavoisier se dio a la tarea de investigar estos productos de manera sistemática y en esa labor quemó sus objetos de experimentador dentro de una campana, encontrando que invariablemente se producía bióxido de carbono y agua, de lo que dedujo que deberían contener carbono e hidrógeno; pronto se descubrió que entre los residuos había oxígeno y nitrógeno. Más y más experimentos con sustancias orgánicas llevaron a la conclusión de que todas ellas, a pesar de sus notorias diferencias y sin importar su complejidad, estaban compuestas en lo fundamental sólo por un conjunto de cuatro elementos: carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N), los cuales ya habían sido aislados de los compuestos del mundo no vivo.
Puestas las cosas así, el camino a seguir estaba trazado; había que combinar, con los procedimientos adecuados, los cuatro elementos CHON para producir lo que la naturaleza ponía en nuestras manos: seda, madera, azúcares, etc. Mucho se intentó y poco o nada se obtuvo, incluso hasta llegó a pensarse en la existencia de algo extra, un elemento misterioso que recibió el nombre de "fuerza vital" y que poseían sólo los compuestos de los mundos animal y vegetal y del que la naturaleza había privado al mundo mineral. Esta tendencia llegó a cobrar tal importancia que hasta el propio Jacob Berzelius, a quien se debe la distinción entre la química orgánica y la inorgánica, la notación atómica por símbolos y el descubrimiento del selenio, llegó a compartir tal idea y a pensar que entre la química de la materia viviente (la orgánica) y la inorgánica existía un abismo infranqueable. Este fue tal vez el origen de un reto más para el intelecto humano: ¿sería posible franquear tal abismo?
DE LO INORGÁNICO A LO ORGÁNICO
Como suele suceder, fue un discípulo de Jacob Berzelius quien dio el primer paso para salvar el abismo que alguna vez mencionara su maestro. En 1828, Friedrich Wohler, trabajando con una solución de cianato de plata y cloruro de amonio, ambos compuestos inorgánicos, obtuvo cianato de amonio, el cual después de calentado, produjo cristales transparentes e incoloros que resultaron idénticos en su composición química a la urea, principal compuesto orgánico de desecho en la orina. De inmediato escribió a Berzelius: "Debo decir que puedo hacer urea sin la intervención de un riñón animal, sea de hombre o de perro." ¡Se había sintetizado el primer compuesto orgánico fuera de un organismo vivo! ¡La química y la biología se habían unido!
El abismo empezaba a ser salvado; la teoría de la fuerza vital se tambaleaba y los logros de los investigadores se sucedían uno a otro con mayor frecuencia. Adolph Kolbe sintetiza el ácido acético, que antes sólo se encontraba en el vinagre o en destilados de madera y, de pronto, como resultado del trabajo tenaz que caracteriza a los investigadores científicos, surgen los primeros compuestos artificiales. Marcellin Berthelot "fabrica" sustancias grasas parecidas a las grasas naturales, ninguna de las cuales se hallaba en la naturaleza.
Nuevamente se estaba frente a resultados espectaculares sin que se supiera bien a bien qué estaba sucediendo, es decir, sin tener una teoría que explicara lo obtenido. La respuesta la encontraron Joseph Gay-Lussac y Berzelius en lo que éste llamo "isómeros" ('partes iguales'), concepto que puede resumirse en lo siguiente: un grupo idéntico de átomos de los mismos elementos puede formar compuestos químicos muy diversos, dependiendo de la manera en que se encuentren colocados en la molécula. Consecuentemente, mientras mayor sea el número de átomos en un compuesto, mayor es el número de sus isómeros. De esta manera fue posible entender que el cianato de amonio y la urea, isómeros en fórmula CH4N2O, eran 10 mismo, de modo que lo observado por Wohler fue que el calor aplicado al cianato sirvió para reacomodar los átomos para producir urea.
Gay-Lussac hizo otra observación importante: en algunos compuestos (cianuro de hidrógeno (HCN), por ejemplo) hay conjuntos de átomos (la pareja carbono-hidrógeno en este caso) que ante determinadas reacciones químicas pasan de un compuesto a otro sin separarse, es decir, se comportan como si fueran un solo átomo. A estos conjuntos de dos o más átomos que permanecen fielmente unidos a través de las reacciones químicas les llamó "radicales" (raíz, en latín).
A Jean Baptiste Dumas le tocó encontrar la riquísima veta de los compuestos del carbono que aún continuamos explotando. Hizo reaccionar cloro con varias sustancias orgánicas y descubrió en el átomo de cloro la capacidad de sustituir átomo por átomo al hidrógeno. Intentó hacer lo mismo con los parientes directos del cloro, es decir con bromo y yodo y obtuvo resultados similares, de lo que concluyó que en los compuestos orgánicos los elementos pueden ser sustituidos por otros, produciéndose familias de compuestos de carbono que, a pesar de su parentesco, son muy diferentes entre sí.
Ilustremos estas ideas con un ejemplo muy simple. Uno de los hidrocarburos (compuesto de hidrógeno y carbono) más sencillos es el metano, conocido por la mayoría de las personas por ser el componente principal del combustible para calefacción en el hogar. Contiene un átomo de carbono y cuatro átomos de hidrógeno. Si se hace uso de la ley de sustitución de Dumas y se sustituye uno de los hidrógenos por un cloro, el metano (CH4) cambia a clorometano (CH3CI), que es útil como refrigerante y es totalmente inútil como combustible.
Si en vez de tres de los hidrógenos del metano se ponen tres cloros, se obtiene el triclorometano, que no es otra cosa que el cloroformo anestésico. Finalmente, si en vez de los cuatro átomos de hidrógeno del metano se colocan cuatro cloros, lo que resulta es un compuesto cuyas propiedades lo hacen útil para extinguir incendios, para quitar manchas y como poderosísimo solvente, cuyo nombre científico es tetracloruro de carbono (CCl4).
Este ejemplo pone en claro la trascendencia de la química del carbono en favor de la satisfacción de las demandas de la humanidad, pero la permanente inquietud y el quehacer científico ha ido más allá y no le ha satisfecho al hombre el que algo funcione, que le sea útil; quiere, necesita, exige conocer cómo ocurren las cosas, por qué suceden, para con estas respuestas continuar sirviendo a la humanidad, satisfaciendo sus demandas.
Las preguntas centrales por contestar en la segunda mitad del siglo XIX
eran: ¿Cómo se eslabonan los átomos de las moléculas orgánicas y qué reglas
siguen? ¿Cómo se reflejarán estas reglas en las propiedades? ¿Por qué es posible
ir sustituyendo hidrógeno por cloro y obtener compuestos con propiedades tan
diversas? ¿Se podrá continuar haciendo sustituciones?
Las primeras respuestas fueron proporcionadas por el entonces joven químico francés Friedrich August Kekulé, en un artículo publicado en la revista alemana Anales de Química en 1858. El artículo tiene como título: "Sobre la constitución y metamorfosis de los compuestos químicos y sobre la naturaleza química del carbono." Kekulé tomó como punto de partida las ideas expuestas en 1852 por Edward Frankland, en las que éste señalaba que cada especie de átomo sólo puede combinarse con un determinado número de otros átomos, según su "aptitud" (valencia) para combinarse.
Con esto, todo cobra sentido: un átomo de hidrógeno que tiene valencia uno, sólo puede combinarse con otro átomo más; el carbono con valencia cuatro puede combinarse con otros cuatro átomos, etc. Así, podemos imaginarnos al átomo de carbono como una esferita con cuatro brazos que le servirán para enlazarse (combinarse) con los otros átomos para formar compuestos. Veamos cómo funciona este modelo y demos comienzo por la molécula más simple de la que habíamos hablado párrafos atrás: el metano.
Como ya se mencionó, la molécula de metano está formada por un átomo de carbón y cuatro átomos de hidrógeno (CH4), y se encuentra representada en la figura 13, donde se aprecia que cada uno de los cuatro brazos del carbono se entrelaza con el brazo disponible del hidrógeno, no dejando posibilidad alguna de otra combinación. Los átomos de carbono pueden combinarse con cualquier otro átomo, pero tienen una cierta "predilección" por hacerlo con sus semejantes, con otros carbonos, de modo tal que cuando las condiciones les son propicias se unen a otros átomos de carbono haciendo cadenas larguísimas de este elemento.
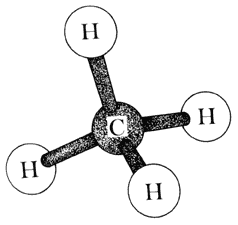
Figura 13. Metano.
Pensemos ahora en dos átomos de carbono. Estos utilizarán uno de sus brazos para unirse entre sí, quedándole a cada uno tres brazos libres para otras uniones (Figura 14).
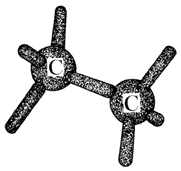
Figura 14. Unión de dos átomos de carbono.
Si estos brazos los ocupan para unirse con hidrógenos, se tendrá un esquema similar al de la figura 15, que en forma condensada se puede escribir como C2H6, fórmula que representa al etano, un gas que se encuentra en la naturaleza.
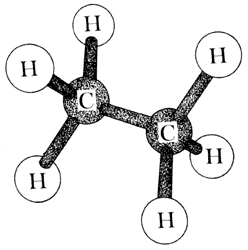
Figura 15. Etano.
Si agregamos ahora otro carbono, quedan 8 enlaces (brazos) libres, ya que el carbono del centro tendrá ocupados dos de sus brazos en ligarse con los carbonos vecinos. Al ocuparse los brazos restantes con hidrógenos, lo que resulta es el gas propano (C3H8), representado en la figura 16, que tal vez sea el más conocido de los hidrocarburos, pues forma parte de la mezcla gaseosa que generalmente se usa en las cocinas.
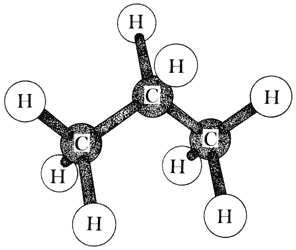
Figura 16. Propano.
De esta manera, se puede continuar con este proceso para formar innumerables hidrocarburos, pero el carbono es más versátil y no sólo se combina con él mismo y con el hidrógeno, sino que lo hace con muchos otros elementos y de maneras diversas. Un átomo de carbono, incluso, puede unirse con otro átomo de carbono utilizando dos o hasta tres de sus brazos, dando como resultado compuestos distintos. En la figura 17 se muestra el esquema de un enlace doble entre carbonos. Al saturarse cada brazo libre del carbono con hidrógeno, se obtiene el etileno, compuesto que proporciona la naturaleza en el petróleo y el gas natural.
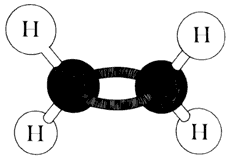
Figura 17. Etileno.

Figura 18. Acetileno.
En la figura 17 se muestra el esquema de un enlace doble entre carbonos. Al saturarse cada brazo libre del carbono con hidrógeno, se obtiene el etileno, compuesto que proporciona la naturaleza en el petróleo y el gas natural.
Cuando dos átomos de carbono ocupan tres de sus brazos para unirse entre sí y saturan el brazo que les queda libre con hidrógeno (Figura 18), se tiene un compuesto altamente explosivo que recibe el nombre de acetileno.
Antes de pasar a discutir algunos ejemplos de combinaciones con otros átomos distintos del hidrógeno, hagamos la siguiente pregunta: ¿Las uniones en los hidrocarburos, necesariamente harán cadenas lineales? La respuesta es NO y, de hecho, al establecerse cadenas no lineales las propiedades de los compuestos resultan harto distintas, a tal punto que se pueden distinguir claramente dos grupos o familias: la familia de las grasas, que comprende compuestos como ceras, jabones, glicerina, lubricantes, detergentes y alcoholes, denominados alifáticos, cuya unidad básica es el metano. La otra es la familia de los aromáticos, que son compuestos extremadamente volátiles, reactivos, muy olorosos y cuyo elemento básico es el benceno, molécula en forma de anillo con seis átomos de carbono que se ligan entre sí por enlaces simples y dobles en forma alternada, saturando sus brazos libres con hidrógenos (Figura 19), y cuya expresión condensada es C6H6
Es innegable que el mundo de las moléculas compuestas por átomos de carbón e hidrógeno (hidrocarburos) es amplio y de gran utilidad para la humanidad, pero en la naturaleza están presentes otros muchos elementos, de tal forma que cuando éstos se combinan con los hidrocarburos, el espectro de posibilidades de nuevos compuestos para emplearse en las más diversas aplicaciones es realmente enorme.
Para nosotros, habitantes del planeta Tierra en el final del siglo XX,
este mundo de los plásticos nos resulta harto familiar, al punto que ni siquiera
somos conscientes de la enorme cantidad de objetos y productos que tienen su
origen en el petróleo, y nos resulta sorprendente cuando nos enteramos de que
el acetato de rayón, el acrilán, el dacrón o el orlón usados en la fabricación
de prendas de vestir; el acetato de etilo o el alcohol etílico utilizados como
disolventes de lacas y la aspirina o las sulfas que alguna vez habremos tomado
para reestablecer nuestra salud son todos ellos derivados del etileno (C2H4),
el cual es un gas incoloro e inodoro.
Sin duda alguna todos y cada uno de nosotros hemos tenido entre nuestras manos recipientes de plástico para muy diversos usos y habremos observado que unos son mas rígidos que otros, característica que se aprovecha para su aplicación, pues mientras que los recipientes rígidos se utilizan generalmente para envasar líquidos muy ligeros, los que no lo son se destinan para sustancias un tanto "pastosas" como la salsa de tomate, la mostaza, el champú, etc., en los cuales el deformar la botella contribuye a que el contenido salga más fácilmente.
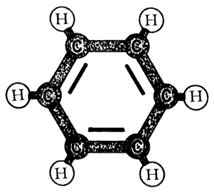
Figura 19. Benceno.
Pues bien, ambos recipientes están hechos de lo mismo: polietileno. Su composición química es la misma y, sin embargo, su comportamiento es distinto. Surge de inmediato la pregunta: ¿Qué es entonces lo que hace la diferencia en el comportamiento de este material?
En repetidas ocasiones hemos insistido en la importancia que en un material tiene la estructura, y este es un ejemplo claro. Lo que hace la diferencia en el comportamiento mecánico (y térmico también) entre ambos tipos de polietileno, es la manera en que se juntan sus cadenas moleculares, cada una de las cuales se forma por la unión de miles de monómeros de etileno. De aquí proviene su nombre: polietileno (poli: muchos).
Los polímeros son moléculas formadas mediante la repetición sucesiva de un mismo grupo de átomos. A este grupo de átomos se le denomina monómero.
El polietileno rígido tiene sus moléculas no ramificadas (Figura 20(a)), mientras que el polietileno que se presenta más flexible tiene sus moléculas en cadenas ramificadas (Figura 20(b)), lo cual impide que las moléculas gigantes se alineen en filas compactas, dando como resultado un plástico que, además de ser más flexible, es menos denso y más maleable al calor.
Con el ejemplo anterior, se pone en evidencia que en el comportamiento y características de un plástico en su presentación final no sólo es importante la composición química de los materiales que intervienen, sino también la forma de la cadena y el alineamiento de la misma.
En un polímero, los monómeros que lo constituyen se unen entre sí como los eslabones de una cadena y, como en ésta, existen posibilidades de ramificarse, cerrarse, enlazarse, alinearse, etc. Dependiendo de la manera como estén hechos los eslabones, la cadena puede ser flexible o rígida (Figura 21). Estas posibilidades de estructura de la cadena polimérica y las combinaciones que se obtengan es lo que dará las propiedades del polímero en su forma final.
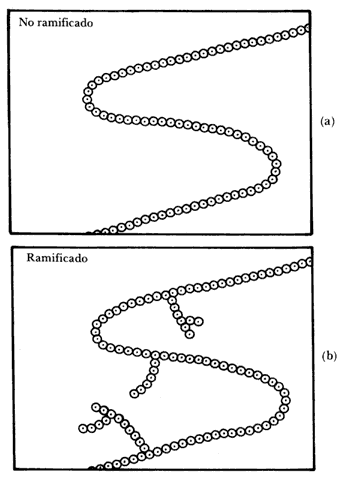
Figura 20.
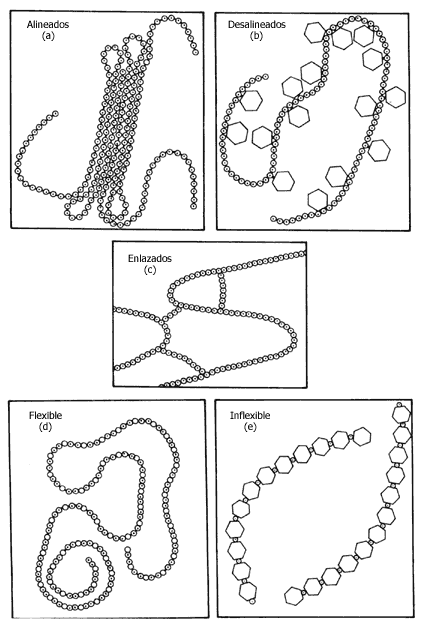
Figura 21.
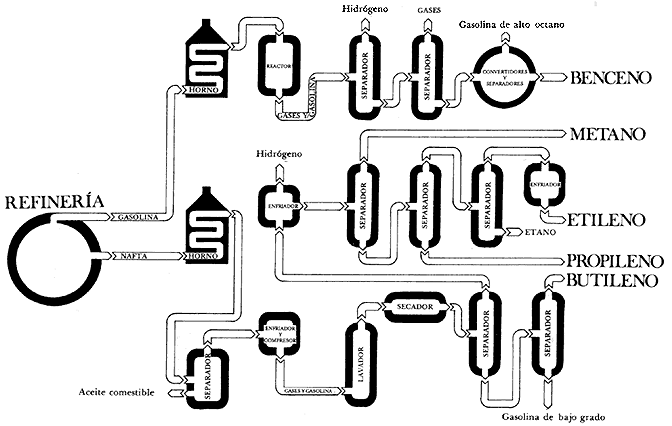
Figura 22.
Figura 23.
Esto da lugar a una verdadera ingeniería de moléculas y abre la posibilidad de diseñar y construir materiales (en este caso poliméricos) a la medida, al gusto del consumidor, adecuados a la demanda de la humanidad.
Ejemplifiquemos con el polietileno que, como mencionamos párrafos atrás, es una molécula de las más pequeñas y simples en el inmenso mundo de los hidrocarburos. Si con ella hacemos una cadena no ramificada como la que se muestra en la figura 20(a), obtendremos polietileno de baja densidad y flexible, cuyo punto de fusión se encuentra alrededor de los 134°C, ideal para ser utilizado en la fabricación de las bolsas que nos suministran en cualquier tienda de autoservicio.
Si a esta cadena le ponemos ramificaciones como las mostradas en la figura 20(b), pero sin permitir que éstas lleguen a unir una parte de la cadena principal con otra, entonces lo que se obtiene es un polietileno con punto de fusión ligeramente menor y, finalmente, cuando las ramificaciones llegan a unir dos regiones de la cadena, entonces se obtiene una elevación del punto de fusión hasta de 200°C aproximadamente. Pero aún hay otra posibilidad: si las moléculas de polietileno se alinean como lo muestra la figura 21(a), entonces lo que se obtiene es polietileno de alta densidad, con punto de fusión alto y mayor rigidez mecánica.
Resulta evidente que el espectro de aplicaciones es amplísimo y más aún si exploramos la posibilidad de incorporar otras moléculas y combinarlas entre sí. Tal es el caso de la mezcla poliestireno-polietileno que origina una cadena desalineada como la mostrada en la figura 21(b) y que por sus características resulta ideal para la fabricación de juguetes, implementos caseros y tantos objetos de uso común hoy en día.
Para finalizar este capítulo y con el propósito de mostrar la gran variedad de aplicaciones de los hidrocarburos, en la figura 22 se muestra un diagrama de los principales compuestos obtenidos de la refinación del petróleo.
La figura 23 muestra esquemáticamente algunos productos derivados del benceno. Obsérvese, por ejemplo, que la aspirina forma parte de ellos, al igual que la resina de fibra de vidrio.
Decíamos que en este siglo ha sido impresionante la manera en que se desarrollaron los polímeros, cuyos primeros productos tuvieron su origen en el siglo pasado. En forma prácticamente paralela se desarrollaron los semiconductores, que en la actualidad son dispositivos de uso totalmente generalizado. Podríamos decir que no existe un solo lugar en el mundo urbano o aun rural donde no estén presentes.
La primera observación importante sobre semiconductores se debe a Michael Faraday, quien observó, en 1833, que a diferencia de los metales, en general buenos conductores de la electricidad y cuya resistencia aumenta al aumentar la temperatura, el sulfato de plata presentaba un decremento en resistencia al aumentar la temperatura. Pocos años más tarde, en 1839, Becquerel observó que al iluminar la superficie de ciertos materiales aparecía un voltaje, lo que vino a complementarse con la observación de W. Smith en 1873 sobre la reducción de resistencia en el selenio al ser iluminado, fenómeno conocido como fotoconductividad. Un año más tarde se da a conocer el hecho de que en ciertos materiales la relación lineal entre el voltaje y la corriente, conocida como ley de Ohm, no se cumple, sino que ésta depende tanto de la magnitud como del signo del voltaje aplicado. Es decir, se está frente al fenómeno de rectificación. F. Braun lo observa en contactos entre metales y varios sulfatos o sulfuros como la galena y las piritas y A. Schuster lo encuentra en contactos entre conductores de cobre opacos y brillantes.
La conductividad eléctrica, en general, se ha logrado explicar en términos de la movilidad de los electrones en el material. Así, por ejemplo, en un cristal metálico, los electrones de valencia (los más externos de cada átomo) no están atados a un sitio particular en la red cristalina sino que son libres de moverse a través del cristal. Esto da cuenta del porqué los metales son buenos conductores eléctricos. Por otra parte, en los cristales covalentes como el diamante, por ejemplo, los electrones de valencia están ocupados en establecer las ligaduras que determinan la estructura del cristal y por tanto no están libres para moverse; consecuentemente, no hay cargas disponibles para la conducción y los materiales así formados son aislantes. Algo similar ocurre con los cristales iónicos como el cloruro de sodio (NaCl), por ejemplo, en el que no hay cargas libres de moverse y el NaCl sólido es un aislante. Sin embargo, cuando se funde la sal, los iones dejan de estar atados a los sitios del cristal y pueden moverse; entonces, el NaCl fundido es un buen conductor.
Otro hecho importante es la dependencia que observa la conductividad de todos los materiales con la temperatura. Para los aislantes aumenta con la temperatura, mientras que para los buenos conductores disminuye cuando la temperatura aumenta.
Como lo implica el nombre, la resistividad eléctrica de un semiconductor es intermedia entre la de un buen conductor y la de un buen aislante, pero como lo mencionamos, este es sólo uno de los aspectos interesantes de estos materiales.
Ejemplificaremos estos materiales con los casos más simples: el germanio y el silicio. Ambos elementos tienen cuatro electrones en su capa electrónica más externa y cristalizan en estructura de diamante (Figura 24). Como puede observarse, cada átomo está en el centro de un tetraedro regular ligado por covalencia con cuatro vecinos cercanos en las esquinas, de modo tal que sus cuatro electrones externos están ocupados y por tanto los materiales deberán ser aislantes.
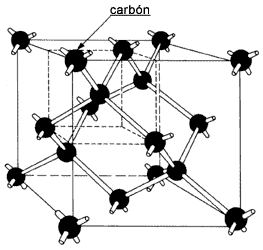
Figura 24.
Sin embargo, las ligaduras de estos átomos se rompen muy fácilmente, de modo que con una pequeñísima cantidad de energía es posible liberar electrones para que deambulen por la red cristalina. Al arrancar de la ligadura covalente uno de estos electrones, se genera un agujero de electrón que lucirá como una carga positiva, agujero que de inmediato será ocupado por otro electrón de un átomo vecino, generando de nuevo otro agujero y así sucesivamente, de modo tal que los agujeros viajarán por la red cristalina dando origen a una corriente de agujeros. Obsérvese que esta corriente se ha generado por medio de la adición de energía al sistema y no ha habido adición de cargas, de modo que el número de electrones es igual al número de agujeros y, no obstante, hay corriente eléctrica. Por ello, a esta conductividad se le denomina conductividad intrínseca.
Un símil útil para entender la conducción en un semiconductor es el siguiente: imaginemos un cristal sin ligaduras rotas, como un estacionamiento de automóviles completamente lleno. En sus pisos inferiores ningún auto (electrón) se puede mover pues no tiene a donde ir. De pronto, un automóvil del primer piso ocupado decide subir a alguno de los pisos superiores donde sí hay espacio, y puede moverse libremente. Entonces, se ha creado un hueco que pasará a ocupar otro automóvil, el que a su vez dejará un hueco. Si observamos los huecos, nos parecerá que son éstos los que se están moviendo. Si agregamos a nuestra analogía la condición de que los automóviles sólo pueden ocupar algunos niveles específicos en el estacionamiento debido a que, por ejemplo, ciertos pisos están reservados para el dueño del edificio y por tanto son niveles prohibidos, habremos añadido el concepto de cuantización del sistema, creando un modelo de bandas de energía que consta de grupos de niveles energéticos separados por "bandas prohibidas".
Esto fue, grosso modo, lo que propuso A. H. Wilson en 1931 como modelo para un sólido semiconductor intrínseco, que vino a ser la culminación de todo un conjunto de investigaciones anteriores.
En 1888, H. Hertz demuestra la existencia de las ondas de radio, descubrimiento que genera la demanda de detectores adecuados que, después de 16 años de búsqueda, son hallados en los semiconductores de contacto puntual, tales como galena, carburo de silicio, telurio, silicio, etc. Se encontró que los detectores de silicio eran los más estables, y los de galena los más sensibles.
Los tubos al vacío (bulbos), que también se desarrollaron en la misma época, tuvieron un progreso vertiginoso, relegando a los semiconductores hasta 1920, cuando surgieron los rectificadores de óxido de cobre y la fotocelda, que encontraron aplicaciones industriales inmediatas en cargadores de baterías, exposímetros para fotografías, moduladores y elementos no lineales en circuitos electrónicos. Sin embargo, no se tenía un conocimiento claro de su funcionamiento, lo que hubo de esperar hasta el advenimiento de la mecánica cuántica y las aplicaciones de ésta al estudio de los sólidos. Con esta poderosísima herramienta fue posible explicar que, por ejemplo, la rectificación y el fotovoltaje son fenómenos de superficie que ocurren en la interfase de dos semiconductores o entre un semiconductor y los contactos metálicos; mientras que el mecanismo de conductividad eléctrica da origen al coeficiente de resistividad de temperatura negativa y al cambio de resistencia bajo iluminación (fotoconductividad), que son propiedades que derivan del cuerpo como un todo y no sólo de la superficie.
Los experimentos de C. J. Davisson y L. H. Gerner y los de G. D. Thomson, que condujeron a demostrar la naturaleza ondulatoria de los electrones, los conceptos de niveles de energía con un electrón por nivel, espín electrónico, principio de exclusión de Pauli y estadística de Fermi-Dirac, fueron de gran ayuda para que A. Sommerfield y colaboradores lograran esclarecer la conducción eléctrica en los metales. El concepto de electrón como onda de Bloch en un cristal fue definitivo para entender el comportamiento de los electrones en todo tipo de sólidos.
LAS IMPUREZAS OTRA VEZ PRESENTES
En páginas anteriores vimos cómo una pequeña cantidad de carbón adicionada al hierro dio origen al acero, que resultó ser más versátil que el hierro mismo. Algo similar ha ocurrido con los semiconductores intrínsecos: una pequeña cantidad de un elemento ajeno aumenta la conductividad eléctrica en relación con la conductividad del elemento puro.
Si al germanio fundido se le agrega una cantidad pequeña de arsénico y se deja solidificar la mezcla, ocurre lo siguiente: el arsénico tiene cinco electrones en su capa más externa y una carga eléctrica de 33 veces la carga del electrón en su núcleo, mientras que el germanio tiene cuatro electrones externos y 32 veces la carga del electrón en su núcleo, de modo que, siendo tan similares los átomos, el arsénico puede sustituir al germanio en la red cristalina, ocupando cuatro de sus electrones de valencia en ligarse covalentemente a sus cuatro vecinos cercanos, quedando prácticamente suelto el quinto electrón disponible para participar en la conductividad eléctrica. Por supuesto que además existe la conductividad producida por los agujeros que describimos con anterioridad, pero ciertamente es minoritaria comparada con la de los electrones de la impureza y por esta razón se dice que el material es un semiconductor tipo n, de impurezas negativas o donadores.
Si en vez de utilizar arsénico para "envenenar" al germanio utilizamos galio, que tiene sólo tres electrones en su capa más externa, lo que ocurre es que le "roba" un electrón a su vecino más cercano, creando un agujero de electrón, generándose una situación completamente equivalente a la de la conductividad intrínseca, pero ahora generada por una impureza. A este tipo de semiconductores se les denomina tipo p, de impurezas positivas o aceptadores. La variación del contenido de impurezas se traduce en el control de la conductividad en un semiconductor, y la combinación de éstos hace posible la realización de muchas funciones que en el pasado se realizaban mediante tubos al vacío (bulbos), con las ventajas de reducción considerable de tamaño, mejor aprovechamiento de la energía y robustez mecánica.
Después del descubrimiento del transistor en 1948, la tendencia mundial ha sido la miniaturización de los componentes electrónicos, lo cual permite hacer cada vez más especializados los equipos. El ritmo al que se ha desarrollado esta miniaturización es realmente impresionante, como puede deducirse de los datos siguientes: para 1960, la línea más estrecha que podía trazarse en un circuito era de 30 micrómetros, es decir treinta millonésimos de metro. Veinticinco años después, es posible trazar un ancho de sólo medio micrómetro (.5 m) que equivale a una ciento cincuentava parte del grueso de un cabello humano. Esto ha permitido la construcción de chips que contienen más de 100 000 transistores para la realización a alta velocidad de operaciones lógicas en las computadoras, y chips para almacenar hasta 16 millones de bits de información (un bit o dígito binario es la unidad fundamental de información en computadoras y es equivalente al resultado de escoger entre dos alternativas excluyentes: "sí" o "no", "prendido" o "apagado").