II. DEL ACERO A LOS PRIMEROS POLÍMEROS
EN El capítulo anterior hemos descrito someramente cómo el hombre
fue satisfaciendo sus necesidades mediante el manejo de nuevos materiales, que,
en la inmensa mayoría de los casos, le eran proporcionados directamente por
la naturaleza. Como ya lo hemos mencionado, esto no quiere decir que los metales
en sí se encuentren en estado natural, pues salvo el mercurio, el oro y en ciertos
casos el cobre y la plata, la mayoría de los metales se encuentran en estado
combinado en forma de minerales. Los más importantes, en razón del papel que
han desempeñado en la obtención de cobre, plomo, cinc, estaño y hierro se muestran
en el cuadro 3.
En términos generales, se puede decir que de estos minerales es posible extraer los diferentes metales mediante el proceso llamado de reducción por carbón, y justamente gracias a ello fue que hacia el tercer milenio a.C., todos estos metales ya eran conocidos para el hombre.
|
Cuadro 3. |
|||
|
|
|||
|
|
|
|
|
|
|
|||
| Cuprita | Cu2O | Cerusita | PbCO3 |
| Malaquita | CuCO3Cu (OH)2 | Galena | PbS |
| Calcocita | Cu2S | Anglesita | PbSO4 |
| Calcopirita | Cu FeS2 | ||
|
|
|
|
|
|
|
|||
| Esfalerita | ZnS | Hematita | Fe2O3 |
| Calamina | Zn4(OH)2Si2O7·H2O | Magnetita | Fe3O4 |
| Cincita | ZnO | Limonita | Fe2O3H2O |
| Willemita | Zn2SiO4 | Siderita | FeCO3 |
|
|
|||
|
|
|||
|
|
|||
El proceso de reducción por carbón consiste, grosso modo, en lo siguiente: cuando un mineral que contiene oxígeno (hematita, cuprita o casiterita) es calentado en presencia de carbón, éste captura parte del oxígeno que se libera y ambos se combinan, produciéndose algún compuesto de oxígeno y carbono y dejando al metal libre de oxígeno, es decir, puro. En el caso de la hematita, por ejemplo, la reacción química que se lleva a efecto es la siguiente:
He aquí pues, una posible explicación de la manera casual en la que el hombre llegó a la Edad del Hierro. Ya hemos visto cómo el hombre aplicó el fuego para tratar los distintos materiales de que iba disponiendo, dando origen a lo que hemos denominado "artes pirolíticas". Cabe suponer que este fuego lo producía por la combustión de madera o incluso carbón de piedra, y muy probablemente en configuraciones tales que favorecían la mezcla de mineral con la fuente de calentamiento. El resultado empírico fue que el mineral resultaba beneficiado o reducido (términos actuales para describir este proceso).
Experiencias similares debieron dar por resultado el descubrimiento del cinc, estaño, plomo y plata. Resulta oportuno en este punto hacer la observación de que, salvo el hierro, ninguno de los metales que inicialmente conoció el hombre son de los que más abundan en la naturaleza. Más de la mitad de la corteza terrestre está constituida por sólo siete elementos, a saber: silicio (Si), 27.6%; aluminio (Al), 8.1%; hierro (Fe), 5.1%; calcio (Ca), 3.6%; sodio (Na), 2.8%; potasio (K), 2.6% y magnesio (Mg), 2.1%.
¿Cuál sería, entonces, la razón por la cual, siendo tan abundante el aluminio, no fue de los primeros en descubrirse? La respuesta la encontramos en los párrafos anteriores, pues resulta que no es posible reducir el aluminio por carbón y consecuentemente, el hombre no pudo realizar un descubrimiento casual de este proceso tan valioso.
Estos hechos dan pie para concluir que en el desarrollo de la humanidad ha resultado definitivo no sólo el que la naturaleza proporcione de manera más o menos directa un determinado material, sino también que el hombre realice el descubrimiento de los procesos para transformar los materiales.
En relación con la Edad del Hierro, son muchos los metalurgistas de la época actual que se han planteado y tratado de explicar una serie de dudas que surgen justamente ahora que disponemos de mayor información sobre lo que es el hierro y sus compuestos. Una de estas preguntas, tal vez de las más profundas, es la siguiente: actualmente sabemos que, en buena medida, las propiedades mecánicas del hierro puro son inferiores a las que presentan el cobre y el bronce. Así pues, ¿cómo es que el hierro pudo llegar a sustituir a esos materiales?; y, por consecuencia, ¿cómo es posible que se haya considerado que el paso de la Edad del Bronce a la Edad del Hierro fue un avance sustancial en la historia de la humanidad?
En primer lugar, cabe mencionar que la secuencia histórica Edad del Bronce a la Edad de Hierro no es universalmente aceptada y existen bastantes estudios que presentan hechos bien fundamentados que se oponen a ella. T. A. Wertime lo resume de esta manera: "... las 'edades' según los metales son clasificaciones útiles para una visión general de la historia, pero no dicen nada acerca de los verdaderos orígenes de la metalurgia."
En segundo lugar, y considerando como válida la sustitución del bronce por
el hierro, es posible explicarla de la manera siguiente: el hierro aparece inicialmente
como producto de reducción de sus minerales, proceso que requiere de una temperatura
menor que la del punto de fusión. El resultado de esto es una esponja metálica
que, al ser martillada, se libera de sus escorias y permite formar una masa
compacta y dúctil. Prueba de ello serían las muestras que se han encontrado
y a las que se les ha asignado, de acuerdo a técnicas actuales, un origen que
data del tercer milenio a.C. Pero además, y como lo mencionamos al iniciar este
capítulo, el proceso de reducción por carbón consiste precisamente en el calentamiento
en presencia de este elemento, y sabemos que si al hierro se le da un tratamiento
consistente en elevar su temperatura y en presencia de carbón, lo que se obtiene
es justamente el acero. Es decir, es altamente probable que lo que el
hombre del siglo XV a.C. conoció y manipuló haya sido lo que hoy
conocemos como acero al carbón y no el hierro. La figura 6 muestra una espada
corta del año 800 a.C., o aún más antigua. La hoja es de acero al carbón endurecida
por tratamiento térmico y el mango está formado por varias piezas de hierro.
Algunas de ellas son piezas forjadas.
No sería remoto que en este proceso de consecución del acero se hubiera tenido el convencimiento de que el simple calentamiento de los minerales seguido del enfriamiento consecuente diera por resultado un nuevo material, quebradizo a veces, más duro y menos maleable que el cobre, menos útil que el bronce pero más abundante y fácil de obtener.
Figura 6.
Pronto debió haberse observado que si el calentamiento se prolongaba, se mejoraba la condición de fragilidad y se aumentaba notoriamente su dureza. Esto no podía ser otra cosa que el "resultado obvio" de la purificación del material, es decir, se pensaba que el acero era una forma más pura del hierro.
Estas ideas prevalecieron hasta finales del siglo XVIII, cuando
el metalurgista sueco Swen Rinman, en 1774, logró establecer ya de una manera
científica que la diferencia entre hierro dulce, acero y hierro colado radica
fundamentalmente en la cantidad de carbón que entra como aleante con el metal.
Este descubrimiento empezó a dar luz sobre lo que por muchos años constituyó
un gran misterio, conocido como el misterio de los aceros de Damasco, sobre
los cuales existían consejas de todo tipo, como veremos en seguida.
Los aceros de Damasco son famosos por su resistencia, dureza y por la belleza de sus marcas. Las descripciones más antiguas sobre ellos datan del año 540 de nuestra era, pero seguramente se utilizaron desde la época de Alejandro Magno, es decir alrededor del año 330 a.C. Durante las Cruzadas, los europeos encontraron en Damasco espadas y dagas con propiedades excepcionales y por ello fue que se difundió este nombre a pesar de que el acero de que estaban hechas provenía de la India, donde se conocía con el nombre de wootz. Se cree que las mejores hojas de acero fueron forjadas en Persia con el wootz proveniente de la India, material que también se usó para hacer armaduras. Entonces, bien pudieron llamarse aceros de la India o de Persia.
Las propiedades excepcionales de este material se traducían en superioridad guerrera, pues influía de manera decisiva tanto en la protección como en la acción de ataque. Estos motivos fueron suficientes para alentar a los europeos a indagar sobre la fabricación de esos aceros, y fue en esa búsqueda que se encontraron con una serie de leyendas o consejas tan inverosímiles como las siguientes: "el acero debía ser templado", es decir enfriado bruscamente, "con los orines de un niño pelirrojo", o bien "con los orines de una cabra de tres años que hubiera sido alimentada por tres días sólo con helechos". Otros procedimientos igualmente fantásticos eran más detallados, como el siguiente: "el acero debe calentarse hasta que cese de brillar, justo como la salida del sol en el desierto; después de esto debe enfriarse hasta que llegue al color púrpura de rey y, en esta condición, insértese en el cuerpo de un esclavo lo más musculoso posible, así la fuerza del esclavo será transferida a la hoja de acero, lo que se traducirá en la resistencia del metal".
Por muchos años y con estos procedimientos o tal vez otros similares, muchos herreros, forjadores y aun científicos de renombre intentaron reproducir las propiedades de los aceros de Damasco. En 1819 el científico inglés Michael Faraday publicó un artículo, en el que proponía como solución al problema la adición al acero de pequeñas cantidades de sílica y alúmina. La propuesta no tuvo éxito pero consiguió inquietar a Jean Robert Breant, a la sazón inspector de ensayos de la casa de moneda de París, para que éste iniciara una serie de experimentos consistentes en añadir distintos y variados elementos al acero. Para 1821, Breant había llegado al meollo del asunto y pudo establecer que era el alto contenido de carbón el responsable de la resistencia y dureza poco comunes de los aceros de Damasco.
Breant logró producir espadas con propiedades muy similares a las de Damasco, pero nunca explicó en detalle los procedimientos y cabe también suponer que no fue capaz de discernir sobre la importancia de los distintos factores que intervenían en el proceso. De hecho, las bases sólidas para la comprensión científica de los aceros de Damasco se dieron hasta el presente siglo, al conocerse las transformaciones de fase que presenta el acero como función de la temperatura y el contenido de carbón.
Ante un misterio como éste, que duró más de 2 000 años, no queda otra cosa más que aplicar el viejo proverbio ruso que dice: "Frecuentemente lo mejor de lo nuevo resulta ser lo largamente olvidado del pasado".
En un intento por esclarecer en este libro el misterio de los multicitados aceros de Damasco a la luz de los conocimientos actuales, reproduciremos aquí la interpretación hecha por Sherby y Wadsworth de la patética receta que menciona el sacrificio del esclavo musculoso.
Caliéntese la hoja de acero a alta temperatura, pongámosla a 1 000°C ("sol naciente en el desierto"), después déjese enfriar al aire hasta una temperatura aproximada de 800°C ("púrpura de rey"). Finalmente témplese a temperatura del cuerpo humano, 37°C en un medio salobre ("entrañas de un esclavo fuerte"). De seguirse este procedimiento, muy probablemente se obtendrá un acero con la dureza requerida pero quebradizo, problema que se supera si en vez de calentársele hasta 1 000°C se hace sólo hasta unos 727°C, siempre que el contenido de carbón sea entre 1.5 y 2%. Con estas condiciones y procedimientos se habrán reproducido las propiedades de las misteriosas espadas de Damasco.
Desde el punto de vista formal, resulta esencial para reproducir las propiedades de resistencia y dureza de los aceros de Damasco lo siguiente:
Fundición. Lo importante es contar con un metal para el forjado con el contenido de carbón adecuado (1.5 a 2.0%). La figura 7 muestra esquemáticamente la manera de obtenerlo.
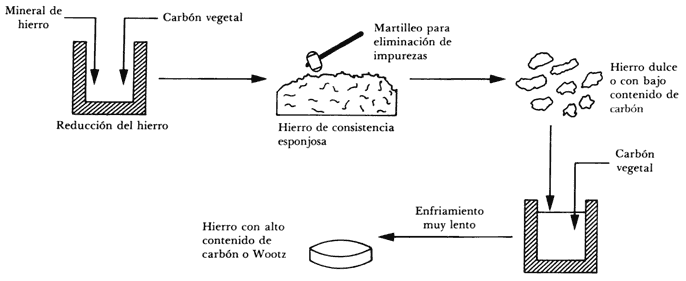
Figura 7.
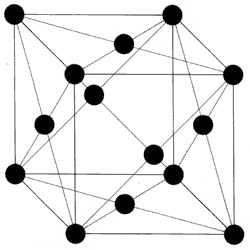
Figura 8.
El mineral de hierro mezclado con carbón se calienta hasta una temperatura de alrededor de 1 200°C, con objeto de extraer el oxígeno del mineral (reducción por carbón). Se obtiene entonces un hierro esponjado que mediante martilleo es liberado de impurezas. El resultado es pedacería de hierro dulce (hierro con bajo contenido de carbón), al cual se le agrega carbón para someter nuevamente la mezcla a una temperatura de 1 200°C en atmósfera inerte para evitar la oxidación. A esta temperatura, el hierro dulce permanece sólido y sus cristales presentan una estructura cúbica centrada en las caras (Figura 8), la cual consiste en una disposición de átomos de hierro en las esquinas de un cubo y en las caras de éste. Esta disposición de átomos deja huecos entre ellos, los que son llenados por átomos de carbón, dando origen a una aleación denominada "austenita". Una vez que se ha fundido el material se le deja enfriar muy lentamente, en un proceso que puede llegar a tardar varios días. Durante el enfriamiento, al pasar por los 1 000°C aproximadamente, el carbón que no ha intervenido en la formación de la austenita se combina con el hierro, formando carburo de hierro (Fe3C), también llamado "cementita". Este compuesto es resistente pero quebradizo, de tal modo que si en tal estadio se hiciera una espada, ésta resultaría muy resistente pero quebradiza a temperatura ambiente. Simultáneamente, en este mismo proceso de enfriamiento lento, la austenita se transforma en "perlita", que consiste en la alternación de capas de ferrita suaves (pobres en carbón) y capas de cementita. La estructura de la ferrita es una estructura cúbica centrada en el cuerpo, y consiste en la disposición de un átomo de hierro en cada una de las esquinas de un cubo y un átomo en el centro del mismo cubo (Figura 9). El proceso seguido garantiza una distribución homogénea de 1.5 a 2.0% de carbón en el acero. Ahora se pasa a la forja.
Forjado. Probablemente éste sea el paso crucial en el proceso que lleva a una "verdadera" espada de Damasco. He aquí el procedimiento. El material obtenido de acuerdo al paso anterior se somete a calentamiento hasta una temperatura entre 650°C y 850°C, entre rojo sangre y rojo cereza dirían los antiguos forjadores, causando su reblandecimiento al punto de poder ser conformado mediante martillo y yunque. Atendiendo al punto de vista microscópico, lo que está ocurriendo en esta etapa es el rompimiento de la red construida por la cementita, transformándola en simples cúmulos de este compuesto, de modo tal que aporta su característica de resistencia alta pero se disminuye su característica quebradiza al restringirse a cúmulos aislados.
Templado. Para terminar con la reproducción de una espada de Damasco, sólo nos resta revisar el proceso de templado.
Después del forjado, la hoja de la espada se encuentra ya conformada pero la estructura del material es de ferrita, lo cual quiere decir que es muy resistente pero no lo suficientemente dura. La dureza requerida se le dará mediante este procedimiento: se calienta la hoja hasta una temperatura ligeramente superior a 727°C y se le enfría bruscamente hasta llegar a la temperatura ambiente, para lo cual resulta ideal sumergirla simplemente en agua.
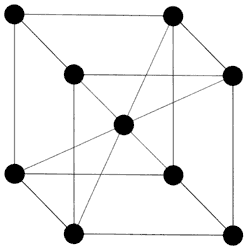
Figura 9.
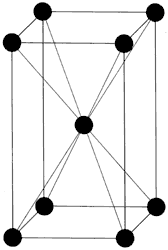
Figura 10.
Lo que ha ocurrido al elevar la temperatura a 727°C es que se ha alcanzado la temperatura a la cual la ferrita centrada en el cuerpo empieza a transformarse en "austenita" centrada en las caras (Figura 8), y al enfriarla bruscamente (templarla) se detiene la transformación hacia "perlita", quedando los cristales de hierro con estructura centrada en el cuerpo en forma tetragonal (Figura 10) en vez de cúbica.
Esta nueva estructura, llamada martensítica, contiene la resistencia de la ferrita (centrada en el cuerpo) y aloja a los átomos de carbón como la austenita. En consecuencia, dará origen a un material resistente y duro para satisfacer las necesidades humanas que exijan estas características. El misterio de las espadas de Damasco se ha despejado.
En un párrafo anterior, al seguir la receta del esclavo sacrificado, comentamos que de seguirse el procedimiento propuesto se obtendrá una espada resistente pero quebradiza, y esto tenía relación con la temperatura de templado (sol naciente en el desierto). Pues bien, lo que ocurre si se trabaja por encima de 850°C es que se propicia nuevamente una disolución de la cementita en la austenita, provocando que el material en conjunto sea muy quebradizo.
El conocer o no los más íntimos secretos de las espadas de Damasco no impidió o limitó siquiera que la humanidad diera uso al acero. Esta aleación, hija de la casualidad o del empirismo (lo mismo da), ha resultado ser uno de los materiales más utilizados por el hombre. El dominio de la tecnología para producirlo en forma controlada pronto se tradujo en cambios sociales profundos, pues sus características físicas permitieron la fabricación de maquinarias más complicadas, estructuras más resistentes, procesos en los que intervenían condiciones más difíciles de obtener, etcétera.
Lo que propiamente se puede llamar tecnología del acero tuvo sus inicios en
los albores del siglo XIX, y alcanzó su consolidación alrededor
de 1861, con la invención de hornos que permitieron su producción masiva y la
sucesión vertiginosa y abundante de nuevas aleaciones a base de este material.
La primera de ellas fue la obtenida a nivel experimental por Faraday, al fundir una mezcla de acero y níquel y una mezcla de acero y cromo, lo que ocurrió alrededor de 1819. Posteriormente se obtuvo el acero al tungsteno en 1858, y diez años más tarde, el acero al manganeso, que ha resultado ser una aleación con propiedades idóneas para la fabricación de herramienta. Ya en 1877, se obtiene el acero al cromo.
Cada una de estas aleaciones posee características que permiten su utilización de manera específica, y podríamos escribir muchísimo acerca del desarrollo que ha tenido este material, al punto de que aún en la actualidad, a más de un siglo de su surgimiento, se continúa trabajando intensamente en las aleaciones del acero. Existen programas de investigación tendientes a resolver el problema de la creación de aceros especiales, ya sea que se busque obtener mayor resistencia mecánica de éstos, mayor dureza o flexibilidad, o se busquen aleaciones que resistan temperaturas cada vez más elevadas con objeto de obtener materiales que vengan a resolver problemas en aeronáutica, en perforación de pozos petroleros o extracción de petróleo, o que se trate de producir materiales más resistentes a la corrosión por salinidad o acidez, etcétera.
El cuadro 4 muestra los elementos principales que se utilizan para realizar aleaciones con acero, y los efectos que se obtienen.
Para dar una idea de la rápida evolución e influencia que el acero y sus aleaciones tuvieron hacia finales del siglo pasado, cabe mencionar que entre 1870 y el fin de ese siglo, la producción mundial de acero aumentó de 500 000 a 28 000 000 de toneladas y, por otra parte, generó el surgimiento de un sinnúmero de tecnologías.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
º Desoxida eficazmente º Restringe el crecimiento del grano1 |
|
|
º Aumente la resistencia a la corrosión y a la oxidación º Aumenta la templabilidad º Añade resistencia a altas temperaturas º Resiste la abrasión y el desgaste |
|
|
º Contibuye a conservar la dureza a alta temperatura |
|
|
º Contrarresta la fragilidad debida al azufre º Aumenta la templabilidad |
|
|
º Eleva la temperatura del inicio del crecimiento del grano º Favorece el endurecimiento desde la superficie hacia el interior del material º Contrarresta la tendencia a la fragilidad º Aumenta las resistencias a alta temperatura, a la fluencia y la dureza a alta temperatura º Mejora la resistencia a la corrosión en aceros inoxidables º Forma partículas resistentes a la abrasión |
|
|
º Hace resistentes los aceros no templados o recocidos |
|
|
º Aumenta la resistencia del acero al bajo carbón º Aumenta la resistencia a la corrosión º Mejora la maquinabilidad en los aceros de cortado libre |
|
|
º Desoxidador de propósito general º Elemento de aleación para láminas eléctricas y magnéticas º Mejora la resistencia a la corrosión º Hace resistentes los aceros de baja aleación |
|
|
º Reduce la dureza y templabilidad en aceros al cromo |
|
|
º Forma partículas duras y resistentes a la abrasión en acero para herramientas º Promueve la dureza y la resistencia a altas temperaturas |
|
|
º Eleva la temperatura de inicio de crecimiento del grano º Aumenta la templabilidad º Produce endurecimiento |
|
|
|
1 Se entiende por "grano" la región de un sólido que tiene la misma orientación cristalográfica. De esta manera, el sólido estaría formado por muchos granos que difieren en orientación cristalográfica, y cuando todos los granos que constituyen un sólido tienen la misma orientación cristalográfica, se tiene un monocristal.
Como muestra, vale la pena mencionar la construcción del Crystal Palace en el año de 1854, y la construcción de la Torre Eiffel en 1889 (Figura 11), que trajo consigo el diseño y construcción de ascensores eléctricos y, por supuesto, el diseño y construcción de una nueva maquinaria que permitiría dar nuevas formas y encontrar aplicaciones novedosas a este material.
En la época en que el acero empezó a producirse masivamente, surge también el desarrollo vertiginoso de la química orgánica, que condujo al hombre a la explotación de uno de los recursos más importantes de nuestro tiempo: el petróleo.
A continuación revisaremos de manera muy breve la evolución de la química,
que ha hecho posible que estemos a finales del siglo XX viviendo
la "edad del plástico". Los orígenes más remotos de la química los encontramos
en la explotación de las salinas y la fabricación de colorantes, perfumes y
sustancias medicinales a partir de la extracción de sustancias activas de las
plantas.

Figura 11.
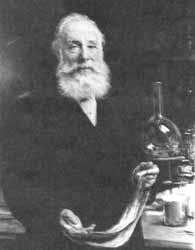
Figura 12.
Posteriormente se tiene la época alquimista, cuyo objetivo más conocido era encontrar la piedra filosofal, sustancia mágica que permitiría transmutar los metales, curar todas las enfermedades y rejuvenecer al individuo. Con esos fines, se hicieron algunas contribuciones importantes al conocimiento, como por ejemplo, el "aceite de vitriolo", el cual se obtenía de "vitriolo verde" —compuestos, que en el lenguaje actual, son ácido sulfúrico y sulfato ferroso, respectivamente (Figura 12).
Pero no se puede hablar de química propiamente dicha sino a partir de los experimentos
de Joseph Black y Joseph Priestley, entre 1754-1774, consistentes en la obtención
de bióxido de carbono y de oxígeno, respectivamente. (Este último, mediante
calentamiento del óxido rojo de mercurio.) Desde entonces, la evolución de la
química hasta nuestros días ha sido vertiginosa. En ella se pueden distinguir
tres etapas: la química mineral, que se inicia con la fabricación del ácido
sulfúrico concentrado y el carbonato sódico; la química orgánica, que tiene
como objeto de estudio el carbono, por lo que también se le denomina "carboquímica",
y cuyo desarrollo histórico se ubica en el siglo XIX; y ya en pleno
siglo XX, la petroquímica, que consiste en el estudio sistemático
del gas natural y el petróleo.
Como se mencionó antes, de la primera etapa se tiene la obtención del ácido
sulfúrico a nivel industrial, que se realiza mediante la quema de azufre y nitrato
de potasio en un recipiente suspendido en un gran globo de vidrio parcialmente
lleno de agua. Este procedimiento se ha venido modificando hasta llegar a un
proceso continuo de fabricación. El carbonato sódico necesario para la fabricación
de jabones inicialmente se obtenía de las cenizas de algas marinas y posteriormente
fue sujeto a un procedimiento a escala industrial, consistente en convertir
la sal común en sulfato sódico mediante el tratamiento con ácido sulfúrico concentrado.
Dicho procedimiento, desarrollado por Leblanc, no entró en operación hasta los
albores del siglo XIX (1807).
Paralelamente, se desarrolló la industria del vidrio, dando origen a la fabricación de vidrios para lentes, microscopios, etc., de modo que el vidrio pasó de ser un objeto de lujo a un objeto de uso común. La necesidad de nuevas composiciones de vidrios para funciones diversas obligó a que los silicatos se estudiaran de manera más sistemática.
En 1868 se inició la fabricación industrial de cloro a través del proceso ideado por el inglés Henry Beacon. En este proceso, el cloro se obtiene del ácido clorhídrico gaseoso.
La segunda etapa de la carboquímica nació a principios del siglo XIX,
con el surgimiento de la industria del gas para alumbrado, cuyos subproductos
más importantes fueron colorantes artificiales, fármacos y perfumes, que vinieron
a sustituir a los extraídos de la naturaleza.
La combustión incompleta de la hulla produce coque y alquitrán. Este último compuesto tiene una gran diversidad de derivados, que se emplean en aplicaciones igualmente variadas: el ácido fénico, de gran utilidad para desinfectar heridas e instrumental médico; la aspirina, la sacarina, sulfamidas y otras drogas de uso en medicina. La industria de los materiales plásticos y de fibras sintéticas utiliza derivados del alquitrán para producir baquelita, nylon, rayón, etc. El trinitrotolueno (TNT) es otro derivado del alquitrán.
La tercera etapa se mezcla con el final de la segunda, mediante la sustitución
progresiva de la carboquímica por la petroquímica, proceso en el cual el petróleo
surge como combustible alrededor de 1859, y hay que esperar hasta el siglo XX
para que a partir de su destilación se empiecen a obtener destilados como el
propano, del cual a su vez se obtiene la acetona. A partir de 1920, aproximadamente,
el petróleo sustituye al carbón como combustible y como materia prima en la
industria química orgánica.
Si la destilación fraccionada de la hulla proporcionó al hombre tantos y tan útiles compuestos, los procesos desarrollados en la petroquímica y las soluciones a las demandas humanas obtenidas de ellas son literalmente pasmosas, sobre todo cuando un análisis a las entrañas de estos compuestos nos muestra que estamos frente a moléculas gigantes o macromoléculas, y lo impactante, lo pasmoso y a la vez lo obvio es que justamente con ellas, con las moléculas grandes, es con las que la humanidad ha vivido y se ha desarrollado desde siempre. Los organismos vivientes trabajan con macromoléculas, la naturaleza misma se desarrolla mediante macromoléculas, de modo tal que parece que desde siempre nos ha estado diciendo, nos ha estado sugiriendo, que intentemos ese camino, del que nos ocuparemos en el capítulo siguiente.