II. EL PETRÓLEO Y SUS QUIMIDERIVADOS
LA VALENTÍA DE LA EXPROPIACIÓN
HACIA 1935 operaban en México alrededor de veinte compañías petroleras, todas ellas extranjeras salvo alguna excepción. Los primeros lugares en la producción eran ocupados por subsidiarias de la Royal Dutch Shell, la Standard Oil y la Sinclair.
El primer conflicto laboral de los trabajadores con las compañías extranjeras se presentó con la huelga de 1937, una vez que se había constituido el Sindicato de Trabajadores Petroleros de la República Mexicana. Durante esos días, en que dejó de surtirse combustible a todo el país, la población adquirió conciencia plena de la importancia del petróleo. Las fábricas sin suficientes reservas comenzaron a detener actividades. Las máquinas agrícolas no tenían forma de trabajar. Las calles de la ciudad de México empezaron a verse semidesiertas. La fuerza y necesidad del energético se hicieron sentir en toda su magnitud.
Don Eduardo Suárez, quien participara en la solución del conflicto y fuera firmante del decreto expropiatorio como Secretario de Hacienda y Crédito Público, cita un dato que revela el provecho injusto que esas compañías sacaban de sus operaciones en México:
... mientras el precio en Nueva York de un barril
de petróleo, en promedio, en el año de 1936, era de 3.19 dólares,
la compañía mexicana de petróleo El Aguila se lo entregaba a su filial
a 1.96 dólares. ¿Con qué objeto?, se preguntarán algunos. Sencillamente
con el propósito de ocultar aquí las utilidades para reducir el pago
del Impuesto sobre la Renta y trasladar parte de la contribución sobre
utilidades a otro país. Así, revisando la contabilidad encontramos
numerosas triquiñuelas. |
El dictamen de la Junta Federal de Conciliación y Arbitraje en diciembre de 1937, confirmado el 1º de marzo de 1938 por la Suprema Corte, obligaba a las empresas a cubrir 26 millones de pesos a los trabajadores. Las compañías se negaron a pagar y adoptaron una posición soberbia, intransigente y retadora frente a la máxima autoridad legislativa de la nación y ante el mismo Presidente, general Lázaro Cárdenas.
A pesar de las continuas y graves amenazas, y de las presiones económicas que las empresas impusieron sobre la paridad del peso con el dólar; que entonces se mantenía en 3.60 pesos, la expropiación se anunció por todas las estaciones radiofónicas el 18 de marzo de 1938. En el decreto, el gobierno se obligaba a pagar una indemnización a las empresas.
El hondo impacto que causó sobre la opinión pública no ha tenido repetición en los años subsecuentes. Puede decirse que todo México estuvo con el gobierno frente a las compañías petroleras. Cita Eduardo Suárez: .
.. el 12 de abril hubo una manifestación de mujeres
frente al Palacio de Bellas Artes. Miles de mujeres de todas las clases
sociales, desde la más humilde hasta las aristocratizantes, fueron
a entregar su contribución para pagar la deuda petrolera. Algunas
entregaron joyas valiosas, y otras objetos de valor escaso. Hubo una
viejecita de la clase humilde que llevó una gallina, la cual seguramente
representaba una buena parte de su exiguo patrimonio. Actos ingenuos
y conmovedores, pero de todos modos dan idea de lo que en momentos
difíciles somos capaces de realizar los mexicanos. |
EL PROBLEMA TÉCNICO DESPUÉS DE LA EXPROPIACIÓN
El 19 de marzo se presentó un problema esperado, pero no por ello menos pavoroso. Todos los técnicos de las compañías expropiadas habían abandonado el país y no existía un solo buque-tanque en nuestros puertos. En realidad, apenas se había iniciado la batalla de las empresas contra México.
El boicot establecido por las empresas extranjeras expropiadas fue de una magnitud enorme, pues pesaba una amenaza sobre todas las compañías que hubieran podido comprarnos petróleo o vendernos maquinaria, refacciones o materia prima (como el tetraetilo de plomo, que ya citamos en el capítulo anterior), indispensables para la industria petrolera.
Fue necesario un esfuerzo titánico para no dejar al país sin combustible. Los actos heroicos se dieron tanto en las fábricas como en la distribución de los productos. Afortunadamente, las dificultades técnicas fueron vencidas con gran oportunidad. Mucho tuvieron que ver en ello los profesionales de la química que habían empezado a formarse en el país desde 1916. A los 22 años de su creación, la Escuela Nacional de Ciencias Químicas empezaba a cubrir con eficiencia la necesidad de químicos e ingenieros químicos que la nueva industria nacionalizada requería.
FORMAS ALOTRÓPICAS DEL CARBONO
Un mismo elemento puede presentarse de diversas formas en la naturaleza, y no nos referimos precisamente a que pueda encontrárselo gaseoso, líquido o sólido, sino a las diferentes formas que adquiere un elemento aun en un mismo estado de agregación —por lo general el sólido—. A éstas se las denomina formas alotrópicas y este fenómeno se conoce como alotropía.
De nuestro formador de cadenas, el carbono, existen dos alótropos ampliamente conocidos: el diamante y el grafito. La existencia de ambos demuestra que las propiedades de las sustancias no dependen sólo de los átomos que las constituyen, sino también de cómo se encuentran arreglados.
El grafito de un lápiz y el diamante de una joya sólo contienen átomos de carbono, pero ¡qué diferentes son ambos sólidos! El grafito es negruzco, brillante, quebradizo y buen conductor de la electricidad, mientras que el diamante es transparente, aislante eléctrico y tan duro que permite cortar vidrio o bloques de granito. A pesar de las diferencias tan notables, si se calienta un diamante hasta 1 800°C, lentamente se convierte en grafito, que es el alótropo más estable. A la inversa, al aplicar presiones enormes, pequeñísimas muestras de grafito han podido transformarse en diamante.
Recientemente se han detectado otras dos formas alotrópicas del carbono, no tan conocidas como las anteriores: el carbón VI y los fullerenos. El primero está constituido por una larga cadena de átomos de carbono en los que se alternan triples enlaces y se lo ha encontrado en meteoritos y en almacenamientos terrestres de grafito. Por su parte, los fullerenos han sido la novedad científica de la segunda mitad de los años ochenta; su síntesis se logró en 1985 mediante la evaporación del grafito por medio de un rayo láser. Uno de los fragmentos formados tenía 60 átomos de carbono y se encontró que poseía una estructura simétrica cuasiesférica, muy parecida al balón de fútbol, con pentágonos y hexágonos alternados. Más tarde aparecieron otras moléculas con 28, 32, 50, 70, 76 y 84 carbonos. Al alótropo más abundante, el C60, se lo conoce de manera informal como futboleno, aunque formalmente todas estas formas llevan el nombre de fullerenos en honor a Buckminsterfuller, arquitecto inventor del domo geodésico, que tiene una estructura similar.
EL DILEMA SOBRE LA TRANSFORMACIÓN QUÍMICA DEL PETRÓLEO O SU EMPLEO COMO ENERGÉTICO
Desde que México tuvo en sus manos las decisiones sobre la industria petrolera fue factible aprovechar esta materia prima en forma más racional y eficaz. No obstante, parece que aún se debate cómo hacerlo con el mayor provecho para la nación. Leopoldo García-Colín, uno de los científicos más destacados de nuestro país; ha dicho que "la tragedia más grande que le puede ocurrir a un país productor de petróleo es pensar que éste debe destinarse esencialmente a satisfacer sus demandas energéticas".
En efecto, resulta un desperdicio no transformar los componentes del petróleo para generar otros materiales, con mucho más valor agregado. La venta masiva de petróleo crudo sin procesar sigue el esquema que caracteriza a los países subdesarrollados: exportar materia prima e importar productos elaborados. En un libro de esta misma colección, Petroquímica y sociedad, Susana Chow compara elocuentemente el aprovechamiento energético del petróleo con el de la madera: ¿Qué pensarían si se les propusiera talar todos los bosques del mundo, para transformar sólo el 7% de la madera en muebles y papel, y el resto convertirlo en leña y carbón? ¡Pues esto es lo que se está haciendo actualmente con el petróleo y el gas natural!
Ya veremos que este problema no es privativo de México. En esencia, la utilización del petróleo es de orientación energética. Este mundo nuestro es un consumidor empedernido de energía. En este sentido, urge desarrollar fuentes alternas energéticas de consumo generalizado y guardar el petróleo para emplearlo en mejores fines, ya que pronto será escaso.
A pesar de los esfuerzos ya realizados, algunos de los cuales comentamos a lo largo de este capítulo, nuestro país debería adoptar un programa más enérgico de desarrollo e investigación de la petroquímica, la ciencia de las transformaciones químicas del petróleo.
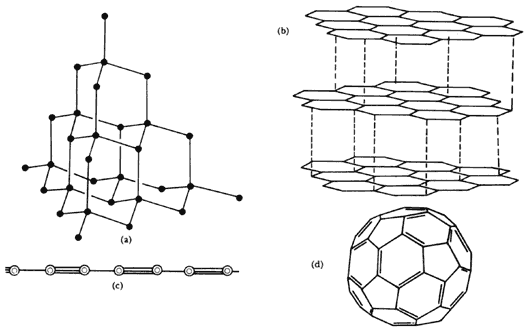
Fórmula 5. Cuatro alótropos del carbono y sus estructuras cristalinas: a)
diamante; b) grafito; c) carbono VI, y d) futboleno, C60.
PEMEX, FRUTO DE LA EXPROPIACIÓN
PEMEX, la industria estatal del petróleo desde 1940, orienta actualmente sus recursos a cuatro zonas prioritarias:
a) Chiapas-Tabasco.
b) Sonda de Campeche
c) Paleocañón de Chicontepec
d) Cuenca de Sabinas
En la actualidad, más de la mitad de la extracción se logra en la Sonda de Campeche, en la que los pozos están montados en más de cien plataformas sobre la superficie marina. Como dato curioso, el descubrimiento de esa enorme riqueza petrolífera tuvo lugar cuando un pescador, Rudecindo Cantarell, mientras pescaba camarón, vio unas manchas aceitosas en la superficie, que provenían de una chapopotera que liberaba petróleo en el mar, a cincuenta metros de profundidad.
Las reservas probadas del petróleo mexicano ascienden a cerca de 65 mil millones de barriles, según se informó en marzo de 1993, a 55 años de la expropiación.
PEMEX es la industria más importante del país, pues su contribución a la economía es esencial. Sus autoridades han informado que el petróleo surte 90% de la energía, más de 40% de las divisas que se captan del extranjero, y aporta alrededor de 30% de los ingresos fiscales. A 55 años del decreto expropiatorio, su mayor ingreso sigue siendo, con mucho, la venta de petróleo crudo. La producción en 1992 fue de casi 2 700 000 barriles diarios (un barril equivale a 159 litros), de los cuales exportó casi 1 400 000. De dicha exportación más la de gas y productos petroquímicos, PEMEX generó ingresos por 11 700 millones de dólares, y egresos por 4 900, de tal manera que su balanza de divisas fue positiva por un total de 6 800 millones de dólares.
Desde 1992, PEMEX es un corporativo que se compone de cuatro organismos descentralizados:
PEMEX-Exploración y Producción
PEMEX-Refinación
PEMEX-Gas y Petroquímica Básica
PEMEX-Petroquímica
PEMEX cubre buena parte de la producción petroquímica mexicana.
Actualmente produce 45 petroquímicos, de los cuales comercializa 35, que obtiene
en 19 centros productivos. En 1992, la producción de PEMEX-Petroquímica
fue de 13 700 000 toneladas, o sea, ¡unos 170 kilogramos por habitante!
LOS PRODUCTOS PETROQUÍMICOS, COMO SI FUERAN JOYAS
Imagine el lector que el carbón pudiera transformarse a bajo costo en diamante, lo cual es factible desde el punto de vista técnico, pues ambos están constituidos exclusivamente por átomos de carbono. E imagine también que ello no alterara el valor del diamante, y que México se dedicara sistemáticamente a exportar carbón para que fuera procesado por otros países para fabricar diamantes y obtener estratosféricas ganancias. ¿Habría algún argumento para hacerlo y no montar aquí inmediatamente plantas productoras de diamantes?
Algo así sucede con el petróleo. Su transformación química permite obtener una enorme diversidad de productos muy valiosos: los petroquímicos. No obstante, por diversas razones económicas, casi 1 500 000 barriles de petróleo crudo salen diariamente de nuestros puertos. ¿Puede el amable lector imaginar el diámetro de una tubería y el flujo volumétrico que son necesarios para que circulen diariamente a través de ella 240 millones de litros? Tal vez baste decir que se requeriría llenar unas ¡6 000 pipas! para contener todo este líquido. Si éste fuera el mecanismo de transporte del petróleo de exportación, estas 6 000 pipas se tendrían que llenar diario con el crudo del subsuelo, formar una fila india de 60 kilómetros de largo, y ser vertidas en los buque-tanques que viajan hacia otros países.
Resultado de la crisis económica de los años ochenta fue también la disminución de las inversiones productivas. Sin embargo, en años recientes PEMEX ha vuelto a invertir, principalmente en la instalación de plantas para reducir problemas ecológicos. Por ejemplo, PEMEX-Refinación estuvo desarrollando en 1993, 17 nuevas plantas con una inversión cercana a los 1 100 millones de dólares.
Si bien es cierto que en 1982 México llegó a depender en 77.6% de las exportaciones de crudo (que resultaba una cifra escandalosa), no obstante, debido a la caída de los precios del barril y al crecimiento de las exportaciones manufactureras, esa relación se ha modificado (71.8% en 1983, 68.6% en 1984, 68.2% en 1985, 39.3% en 1986 —al entrar México al GATT— y en la actualidad se encuentra por debajo del 30%). Afortunadamente, las exportaciones se han diversificado. Los ingresos por concepto de petróleo crudo se redujeron drásticamente de 16 600 millones de dólares en 1984, a 6 300 en 1986 y fueron de 7 400 en 1992. Tal vez ahora que se reduce la tendencia a la monoexportación sea un buen momento para procesar el crudo que somos capaces de extraer.
A continuación, como este libro pretende informar y divulgar la ciencia central y crear conciencia de su necesidad, iniciamos un somero relato sobre cómo se obtienen y para qué son útiles los materiales petroquímicos.
La palabra petróleo es una castellanización del latín petroleum (de petra piedra y oleum aceite). Nuestros antepasados aztecas y chichimecas lo conocieron y lo denominaron chappotli o chapopoctli (del náhuatl chiahuatl = grasa y poctli humo).
La formación del petróleo se entiende hoy como una serie compleja de procesos geoquímicos ocurridos a lo largo de una centena o dos de millones de años. Su origen se debe a la lenta descomposición de la materia orgánica acumulada en cuencas marinas y lacustres, en un pasado remoto. El proceso de sedimentación y enterramiento propició los procesos químicos a altas presiones y temperaturas que dieron como resultado el aceite crudo y el gas natural, dentro de un ambiente rocoso. En ocasiones, estas acumulaciones profundas de petróleo adquieren altísimas presiones y encuentran fracturas o grietas por las cuales el aceite emigra hacia la superficie.
Originalmente, en México se encontró petróleo a flor de tierra, en las llamadas chapopoteras naturales u ojos de aceite. Los usos que los nativos dieron al aceite crudo son bien conocidos. Sin embargo, es hacia fines del siglo XVII cuando la humanidad se percata de su valor real y se inicia su explotación en formas diversas y rudimentarias. El primer pozo petrolero del mundo se perforó en Estados Unidos en 1859.
A partir de esa fecha se inicia la etapa de la exploración en México. Los pioneros desarrollaron sus esfuerzos basándose en la presencia de chapopoteras, pero les faltó el equipo necesario para seguir adelante. Los ojos de aceite volvieron a llamar la atención desde el inicio del siglo XX, cuando la primera compañía extranjera compró un terreno de 118 000 hectáreas que abarcaba parte de los estados de San Luis Potosí, Tamaulipas y Veracruz. El dueño de la hacienda quería venderla "porque esos ojos de petróleo resultan un problema para la ganadería". Curiosamente, por la venta le ofrecieron el triple de la suma que pedía (300 000 pesos), por lo que accedió inmediatamente a ese "buen negocio". Desde luego, una fuerte compañía era la que había hecho esta oferta, la Huasteca Petroleum Company. En abril de 1904, después de una perforación de poco más de 500 metros, el pozo La Pez Núm. 1 lanzó el primer gran chorro de petróleo y empezó a producir unos 1 500 barriles diarios.
Los componentes esenciales del petróleo son los hidrocarburos. Reciben el nombre genérico de hidrocarburos las sustancias químicas compuestas solamente por dos tipos de átomos: carbono e hidrógeno. A pesar de esta limitante, el número de los hidrocarburos existentes es enorme. Son los compuestos orgánicos más sencillos.
Debido a que están constituidos por esos dos elementos, su fórmula general puede escribirse como:
donde los números enteros n y m representan el número de átomos de cada elemento que contiene la molécula de un hidrocarburo dado.
Los químicos pioneros del siglo pasado, basados en el análisis químico —que permite conocer los elementos presentes en un compuesto, así como la proporción en que se encuentran— fueron capaces de reconocer que el carbono tenía una capacidad de combinación de cuatro. Es decir, que en muchos compuestos de carbono este átomo se enlaza químicamente con otros cuatro átomos vecinos. En la jerga química se dice que el carbono es tetravalente, o que su valencia es cuatro.
La razón por la que existen tantos hidrocarburos es la facilidad que tienen los átomos de carbono para enlazarse entre sí, formando cadenas moleculares. De esta manera, por lo menos uno de los cuatro enlaces de cada carbono se establece con otro átomo de carbono vecino. En los hidrocarburos, el resto de los enlaces corresponde a uniones carbono-hidrógeno.
Por tratarse de un elemento excepcional que fácilmente se enlaza consigo mismo, la química del carbono merece estudio aparte: la química orgánica. El número de compuestos orgánicos conocidos es enorme (véase el cuadro 5).
|
CUADRO 5. Crecimiento del número de compuestos orgánicos conocidos. |
|||
|
|
|||
|
|
|
||
|
|
|||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|||
|
|
|||
LA EXTRACCIÓN DEL PETRÓLEO CRUDO
El petróleo es una endemoniada mezcla de multitud de hidrocarburos gaseosos, líquidos y sólidos. Aunque en menor proporción, puede contener también otros compuestos con elementos diferentes del carbono e hidrógeno, tales como oxigeno (O), azufre (S), nitrógeno (N) y hasta algunos metales, como vanadio (V), níquel (Ni) o hierro (Fe).
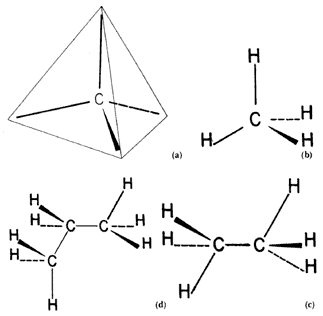
Fórmula 6. a) Tetravalencia del carbono. Este átomo se liga con otros cuatro por medio de enlaces que apuntan hacia los vértices de un tetraedro. Se acostumbra colocar una cuña al enlace que apunta hacia fuera del plano del papel y una línea punteada para el que sale hacia atrás.
El petróleo no existe en el interior de la corteza terrestre como en una alberca,
sino que llena los poros de ciertas rocas.
Debido a la presión a la que se encuentra sometido el petróleo, en cuanto la perforación del pozo llega al manto petrolífero fluye a través de los poros de las rocas y sube por la tubería. Conforme se extrae el petróleo, la presión disminuye en el interior y, al cabo de los años, deja de fluir.
En ese momento el pozo se tapa o se intentan otros procedimientos de recuperación del petróleo, el cual aún moja todo el interior rocoso del pozo. Por ejemplo, al inyectar vapor dentro de un pozo aparentemente agotado se logra volver a levantar la presión y, como el petróleo es menos denso que el agua que se condensa, éste vuelve a fluir por la boca del pozo. En 1992, casi 30% de la producción nacional de crudo se obtuvo mediante esta técnica. Actualmente se realiza mucha investigación en esta dirección de recuperación secundaria o terciaria, como se la ha llamado.
Frecuentemente, la parte superior del entrampamiento está ocupada por los hidrocarburos gaseosos más ligeros, el denominado gas natural. La composición del gas natural es variable, pero el componente más abundante siempre es el metano (entre 70 y 90%), seguido del etano (entre 5 y 20%) y del propano (entre 5 y 1%) —véanse sus estructuras moleculares en la fórmula 6.
El aceite líquido por debajo del gas natural está formado por hidrocarburos que tienen entre 5 y 20 o más átomos de carbono. En él están disueltos otros hidrocarburos sólidos con mayor número de átomos de carbono, así como parte de los hidrocarburos gaseosos, que se disuelven debido a la alta presión del pozo. El aceite crudo tiene un color que varía entre café oscuro o verde hasta casi incoloro.
|
CUADRO 6. Los primeros productores mundiales de crudo en 1986. |
|||
|
|
|||
|
|
|
||
|
|
|||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|||
Tal cual es, el petróleo crudo tiene poco uso. Tiene que ser refinado para obtener de él productos útiles. Como toda mezcla, sus propiedades varían de pozo en pozo. Es más preciado el petróleo que contiene una mayor proporción de hidrocarburos con pocos átomos de carbono, o crudo ligero, ya que permite obtener mayor cantidad de gasolina y de productos petroquímicos.
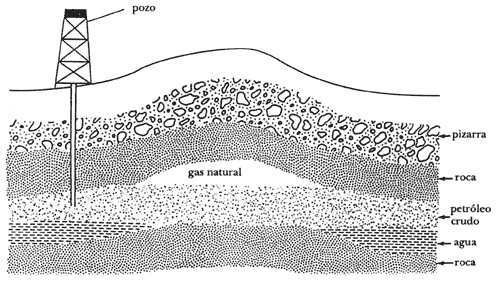
Figura 8. Esquema de un pozo de petróleo.
Su precio siempre es mayor que el del crudo pesado, el cual es un poco más difícil de procesar. En México contamos con ambos tipos de crudo, y aquí reciben el nombre de crudo istmo, el ligero, y crudo maya, el pesado. Desde 1988 se han encontrado yacimientos de crudo super ligero, al que se ha denominado crudo olmeca. En 1992, las exportaciones de crudo alcanzaron los 7400 millones de dólares, 25% correspondió al tipo istmo, 60% al maya y 15% al olmeca. Los principales países de destino fueron Estados Unidos (58.3%), España (17.5%), Japón (6.6%) y Canadá (2.3%).
ENLACES DOBLES Y TRIPLES. LA SERPIENTE DE KEKULÉ
Cuando en una fórmula el químico coloca una raya entre dos átomos enlazados, está diciendo que una pareja de electrones los mantiene unidos. En los hidrocarburos de la fórmula 6 se presenta este tipo de unión, llamada enlace sencillo. A los hidrocarburos de cadena abierta como éstos se los llama alcanos. Sin embargo, ocurre también que cuatro o seis electrones sirvan de lazo de unión entre dos átomos de carbono, en cuyo caso hablamos de enlaces dobles o enlaces triples. A los hidrocarburos con estos enlaces reforzados se los llama alquenos y alquinos, respectivamente. La fórmula 7 muestra algunos ejemplos.
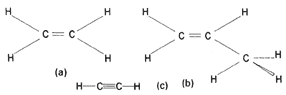
Fórmula 7. Los alquenos más simples son la base de productos poliméricos ampliamente utilizados: a) etileno, b) propileno, c) acetileno, el alquino con dos átomos de carbono. A este último se lo empleó para el alumbrado público antes de la aplicación de la electricidad.
Como seis electrones enlazan mejor que cuatro y éstos mejor que dos, la distancia
entre átomos de carbono es menor en un triple enlace que en uno doble y que
en uno sencillo (véase la fórmula 8).

Fórmula 8. Distancia carbono-carbono en los enlaces sencillo, doble y triple. Un picómetro (pm) es la billonésima parte de un metro.
Los hidrocarburos forman ciclos, de una manera parecida a como un perro se muerde la cola. Es cosa de que el último carbono de una cadena abierta se enlace con el primero. Un par de compuestos cíclicos de utilidad se muestran en la fórmula 9.
Un hidrocarburo muy especial es el benceno, que tiene la fórmula C6H6. Se dice que Friedrich August Kekulé, un notable químico alemán del siglo pasado, resolvió el problema de su estructura en 1866, cuando soñó a una serpiente que se comía su propia cola. En efecto, el benceno es un hidrocarburo cíclico, aunque su reducido número de hidrógenos habla de la presencia de enlaces múltiples.
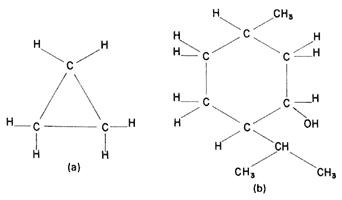
Fórmula 9. Hidrocarburos cíclicos. a) Ciclopropano, un potente anestésico empleado en cirugía. b) Mentol. El principio activo de la menta cuenta con un anillo de seis carbonos (ciclohexano).
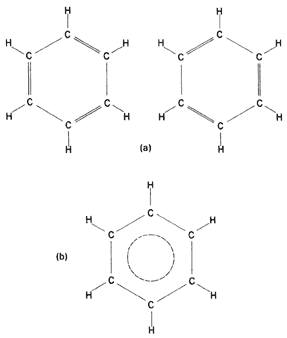
Fórmula 10. a) Estructuras del benceno según Kekulé. b) Concepción actual del benceno. Los electrones de los dobles enlaces propuestos por Kekulé no se hallan entre pares específicos de átomos de carbono. En realidad se encuentran deslocalizados alrededor de todos los átomos del ciclo, lo cual se representa por el círculo punteado.
En química orgánica es común representar las fórmulas de los compuestos en forma de una gráfica que condensa la información. Las reglas son: a) eliminar la escritura de los símbolos de carbono e hidrógeno, b) cada trazo lineal representará una unión carbono-carbono, y c) evitar la escritura de los enlaces carbono-hidrógeno.
Se han colocado tres ejemplos de esta taquigrafía en la fórmula 11.
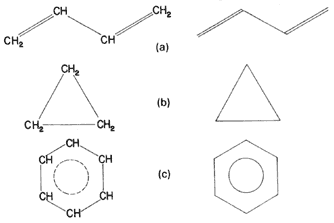
Fórmula 11. Fórmulas desarrolladas y gráficas de tres compuestos: a) Butadieno. B) Ciclopropano. C) Benceno.
Esta simplificación de las fórmulas, como se verá, es de mucha utilidad para ahorrar tinta y tiempo. Convierte además al químico en un experto trazador de figuras geométricas.
UTILIZACIÓN GLOBAL DEL PETRÓLEO
Del petróleo se aprovecha tanto el gas natural como el aceite crudo. En la figura 9 se presenta, a partir de datos de la ONUDI (Organización de las Naciones Unidas para el Desarrollo Industrial), el destino mundial anual (1980) de los 1 100 millones de toneladas producidas de gas natural y de los 3 000 millones de toneladas de aceite crudo.
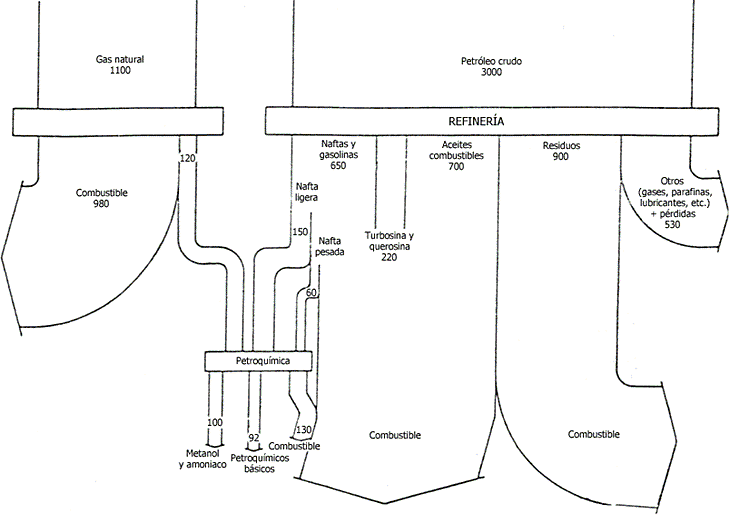
Figura 9. Destino de los hidrocarburos del petróleo en el ámbito mundial
(en toneladas por año). (Fuente: ONUDI, The Petrochemical Industry
in Developing Countries, 1985.)
Podemos observar que una proporción alta del destino final del petróleo es su combustión como energético. Unicamente alrededor de 7% se utiliza para la obtención de productos petroquímicos. Por lo visto, el mercado mundial no da para más.
Por lo pronto, vale la pena detenernos un poco en el cuadro de refinación. Más adelante nos ocuparemos tanto de la petroquímica que se deriva del gas natural (120 millones de toneladas al año, de acuerdo con la figura 9) como del aceite crudo (210 toneladas anuales). Pero antes de empezar veamos uno de los peligros existentes detrás de los hidrocarburos.
Con la industrialización de Europa en el siglo pasado se descubrió que los trabajadores del carbón y los deshollinadores de chimeneas desarrollaban cáncer en la piel. Hacia 1915, en el Japón, se demostró que bastaba pintar a un conejo con alquitrán (un derivado de la pirólisis del carbón de hulla) para que se le indujera cáncer.
Se estima que más de 50% del cáncer humano es producido por sustancias carcinogénicas que se hallan en el medio ambiente. Los ejemplos del párrafo anterior han ratificado que algunos hidrocarburos aromáticos policíclicos producen cáncer (véase la fórmula 12). Parece que el benceno también causa cáncer.
El benzopireno es uno de los carcinógenos más poderosos y se lo considera una de las principales causas del cáncer pulmonar. Se produce en la combustión de diversos productos orgánicos, como la gasolina, el diésel y, desde luego, los cigarros. Se lo ha encontrado incluso en alimentos preparados por combustión directa, como los famosos tacos al carbón.
No son del todo bien conocidas las razones por las que algunos hidrocarburos producen cáncer y otros no. Se manejan hipótesis relativas a la distribución de los electrones y otras relacionadas con el tamaño de las moléculas (para que se intercalen apropiadamente en el ADN).
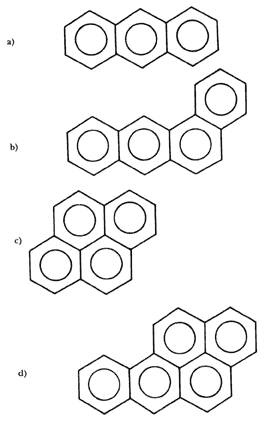
Fórmula 12. Reciben el nombre de aromáticos todos los compuestos derivados del benceno (véase la fórmula 10). Los aquí mostrados reúnen varios ciclos bencénicos en la misma molécula. Algunos de estos compuestos inducen cáncer por el contacto prolongado con ellos. a) Antraceno (no es carcinógeno). b) Benzo [a] antraceno (es carcinógeno). c) Pireno (no es carcinógeno) . d) Benzo [a] pireno (es un carcinógeno muy potente).
Como ya mencionamos, el petróleo crudo es una mezcla de miles de hidrocarburos y otros compuestos. La forma elemental de aumentar su valor es separar de él distintas fracciones de compuestos semejantes.
Para empezar, se eliminan los sólidos térreos suspendidos en el crudo y de inmediato se envía éste a la refinería. Allí el primer paso es la destilación del crudo. En este proceso se aprovecha que cada compuesto tiene una temperatura característica de ebullición. En el laboratorio bastan un mechero, un matraz y un refrigerante para separar una mezcla por destilación. Sin embargo, en la industria se requieren enormes equipos que se denominan torres de destilación. El diagrama de una torre de destilación primaria se muestra en la figura 10.
Antes de su ingreso a la torre, el petróleo crudo es precalentado en hornos que queman gas natural. Por motivos de ahorro energético, las mismísimas corrientes que salen de la torre, desde la menos hasta la más caliente, también se utilizan en el precalentamiento del aceite crudo, antes de entrar al horno. Ello implica un ahorro de gas natural. Así, en ocasiones el crudo se aprovecha para condensar el gas que sale por la parte superior de la torre (véase la figura 10) y para enfriar el resto de las corrientes de salida. En este trayecto el crudo se precalienta y está listo para entrar al horno, y finalmente a la torre.
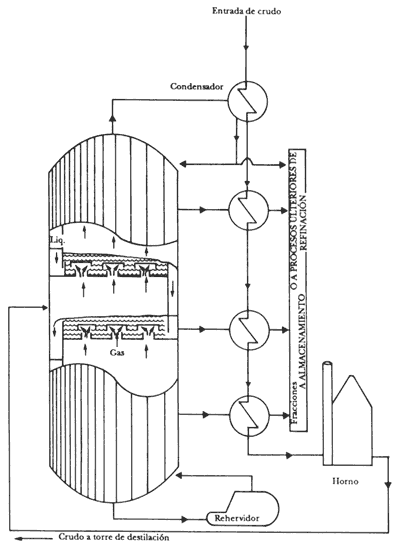
Figura 10. Torre de destilación primaria y tren de calentamiento de crudo. En el interior de la torre existen dos corrientes que fluyen en direcciones opuestas. Hacia arriba marcha la fase gaseosa, impulsada por el rehervidor de la parte inferior. Hacia abajo cae por gravedad la fase líquida, alimentada por el condensador de la parte superior. En cada plato de la torre el gas y el líquido entran en contacto íntimo. El resultado es que los compuestos más volátiles y ligeros pasan a la fase gasosa, con lo que continúan su ascenso hacia el plato superior, mientras que los menos volátiles se condensan como líquidos y acompañan esta fase hacia el plato inferior.
Para el ingeniero químico, el diseño de una torre de éstas es un problema clásico de su profesión. ¿Qué diámetro proponer para la torre? ¿Cuántos platos de contacto líquido-vapor hacen falta? ¿En qué plato alimentar el crudo? ¿A qué temperatura debe introducirse? ¿Cuánto vapor alimentar al rehervidor?
El arranque de la planta de destilación es otro bello problema: ¿cómo lograr que las corrientes destiladas, que antes constituían el crudo, sean las que lo precalienten? Pruebe el lector su ingenio para sugerir un procedimiento de arranque.
La temperatura cambia a lo largo de la torre. En la parte superior se tiene la más baja, donde se encuentran en equilibrio los componentes más ligeros (y de menor punto de ebullición). Por el contrario, en la parte inferior la temperatura es mucho más alta y lo es también la proporción de los componentes pesados y menos volátiles.
Como se colocan diversas salidas laterales en la torre, el petróleo crudo logra separarse en varias fracciones, cada una con un diferente intervalo de temperaturas de ebullición e hidrocarburos de diferente número de carbonos en su cadena (véase el cuadro 7).
|
CUADRO 7. Fracciones del petróleo que abandonan la torre de destilación. |
|||
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
En la figura 11 se muestra un cuadro sinóptico con los destinos principales de las fracciones del petróleo. Cada una de las corrientes que abandonan la torre primaria de destilación recibe tratamientos posteriores en la propia refinería o en plantas externas.
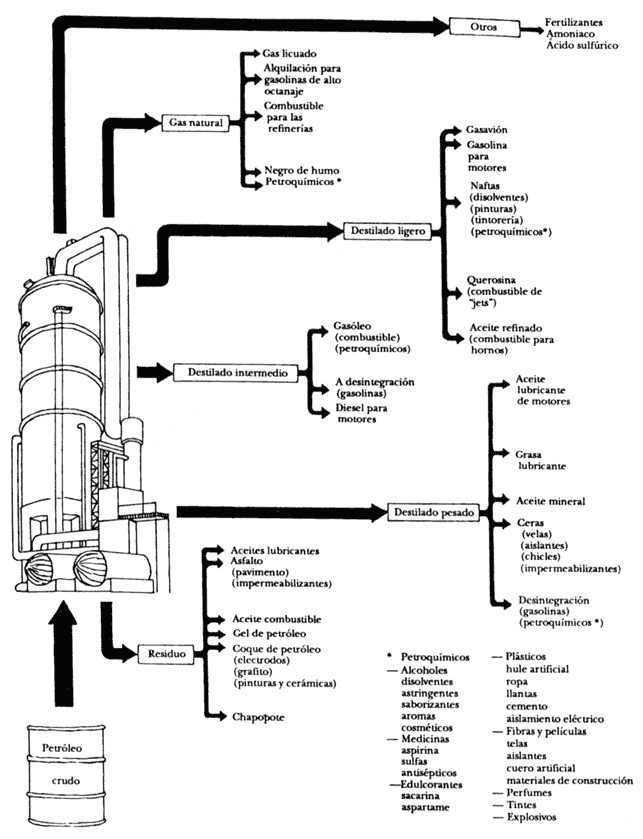
Figura 11. Destino de las diferentes fracciones del petróleo, después de la destilación primaria.
Cada uno de estos procesos posteriores a la destilación proporciona mayor valor agregado a los productos del petróleo y los transforma en bienes mucho más aprovechables directamente por la población. La industria del petróleo consiste en un frondoso árbol cuyo tronco es el petróleo (crudo más gas natural), sus ramas principales son los efluentes de la destilación primaria, y cada una de éstas se deriva hacia diversos procesos ulteriores.
Así, el largo camino que parte del petróleo en el pozo y que llega hasta la camisa que usamos, consta de toda una secuencia de pasos, conocida como cadena productiva. Se entiende por cadena productiva una estructura eslabonada de productos petroquímicos que, con base en los productos básicos de la refinería, establece una secuencia genealógica que pasa por los petroquímicos intermedios y llega a los de uso final, que sirven como materia prima de multitud de bienes de consumo.
En este libro tendremos oportunidad de conocer algunas de estas cadenas productivas.
En química se emplea el término isómero para designar a dos compuestos con la misma fórmula (lo cual implica la misma composición porcentual de cada elemento), pero cuyas moléculas muestran un ordenamiento espacial diferente de sus átomos. Por ejemplo, el éter metílico y el alcohol comercial son sustancias isoméricas. Sus fórmulas condensadas son C2H6O, pero sus fórmulas moleculares revelan diferencias (véase la fórmula 13).
Esa diferente posición del átomo de oxígeno es crucial. En ambos casos tenemos líquidos volátiles transparentes, pero uno es un potente anestésico (éter) y el otro un tóxico peligroso (es el bien conocido alcohol que encontramos en el vino, la cerveza, el pulque, el tequila, etcétera).
Fórmula 13. Dos moléculas isoméricas. Obsérvese que contienen el mismo número de átomos de cada elemento, esto es, seis hidrógenos, dos carbonos y un oxigeno: a) éter metílico; b) alcohol etílico.
En los hidrocarburos aparece frecuentemente el fenómeno de la isomería. Ello
es clave, por ejemplo, en el octanaje de una gasolina.
Las gasolinas mexicanas (Nova y Extra) se vendían con dos grados de octanaje hasta 1990. Hoy las gasolinas comerciales son la Nova y la Magna Sin, esta última para los automóviles fabricados desde 1991 que cuentan con un convertidor catalítico para reducir la contaminación, del que hablaremos más adelante. Por lo pronto respondamos a la pregunta, ¿qué es el octanaje?
Un motor está diseñado para que la gasolina gasificada sea admitida al pistón y, luego de ser comprimida, explote por la acción de la chispa de la bujía. No son adecuadas aquellas gasolinas que explotan por el solo hecho de comprimirlas, pues se queman prematuramente (el fenómeno se llama preignición). Esto produce que el pistón se extienda antes de que el cigueñal haya completado su ciclo. El resultado es un golpeteo constante, que se conoce como cascabeleo, que tarde o temprano acaba con los motores.
La mayor o menor tendencia a no producir cascabeleo se mide por el octanaje (o grado de octano) de cada gasolina. Las gasolinas con mayor octanaje son las que producen menor cascabeleo, mientras que las de menor octanaje son más susceptibles de preignición.
De forma arbitraria se ha asignado el octanaje de 0 y 100, respectivamente a dos hidrocarburos puros: el n-heptano, que trabaja pésimamente en los motores, y el 2,2,4-trimetilpentano (un isómero del octano C8H18), que se desempeña muy bien (véase la fórmula 14).
Por ejemplo, cuando decimos que una gasolina tiene un octanaje de 80, queremos indicar que, ante la combustión en el motor, se comporta igual que una mezcla de 80% de 2,2,4-trimetilpentano y 20% de n-heptano.
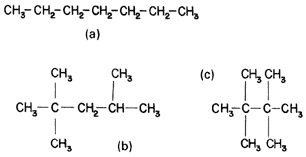
Fórmula 14. Conforme más ramificaciones hay en un hidrocarburo, el octanaje aumenta; a) n-heptano (0 octanos); b) 2,2,4-trimetilpentano (100 octanos); c) 2,2,3,3-tetrametilbutano (103 octanos).
Cada hidrocarburo tiene un octanaje característico en esta escala. La mayoría
se encuentra entre el 0 y el 100, pero pueden ocurrir los octanajes negativos
(para los hidrocarburos que se comportan todavía peor que el n-heptano) o los
mayores de cien (para los que son mejores que el 2,2,4-trimetilpentano). Los
isómeros lineales (como el n-heptano) poseen el peor octanaje, mientras que
aquellos con más ramificaciones son óptimos (véase el cuadro 8). Por ejemplo,
otro isómero del octano, el 2,2,3,3-tetrametilbutano de la fórmula 14 (c)
tiene un octanaje de 103. Asimismo, los hidrocarburos bencénicos, también llamados
aromáticos (derivados del benceno, el hidrocarburo de la fórmula 10)
son de alto octanaje.
|
CUADRO 8. Octanaje de algunos hidrocarburos puros. |
|||
|
|
|||
|
|
|
||
|
|
|||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|||
Esto no quiere decir que los hidrocarburos lineales no tengan utilidad. Son malos componentes de las gasolinas, pero resultan indispensables en otros procesos industriales (por ejemplo, para extraer aceites de semillas como la soya, el algodón, el maíz, el ricino, el cacahuate y el lino).
CATÁLISIS. LA FORMA QUÍMICA DE METER EL ACELERADOR
Cada cambio químico sucede a una velocidad característica, en función de una variedad de condiciones. Mientras que existen fenómenos químicos extraordinariamente rápidos, también los hay desesperantemente lentos. Una explosión es un ejemplo de un fenómeno químico veloz. Por contraste, los diamantes se convierten lentamente en grafito, en un proceso que dura millones de años.
Cuando se trata de un proceso químico para producir un bien determinado, el factor económico entra en juego y el químico debe idear formas de acelerar su ocurrencia. Para ello hace participar alguno de los siguientes parámetros:
| a) | La concentración de los compuestos que reaccionan. Si ésta aumenta, existe mayor probabilidad de que sus moléculas se encuentren y reaccionen. |
| b) | La temperatura. Por lo general, el calentamiento aumenta la velocidad de reacción. Los refrigeradores utilizan este principio, ya que al mantener fría la comida se reduce su velocidad de descomposición. |
| c) | El tamaño de las partículas. Si algún reactivo es un sólido, conviene molerlo finamente. |
| d) | Catalizadores. Son sustancias que aceleran la reacción, pero que quedan intactas al final de la misma (véase la figura 12). Por otra parte, se llama inhibidores a las sustancias que retardan la velocidad de las reacciones químicas. En la industria alimentaria, los conservadores, sustancias preservativas y antioxidantes son inhibidores que retardan la descomposición de la comida. |
Sin duda, la catálisis es clave en la industria del petróleo. Es más, cerca de 90% de todos los procesos químicos industriales incluyen la presencia de un catalizador.
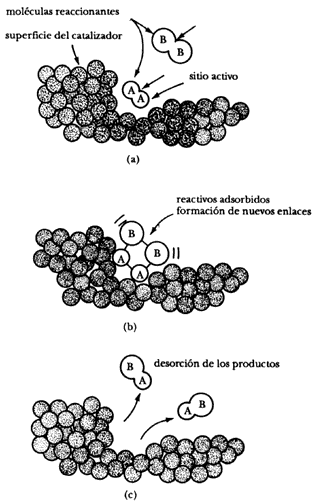
Figura 12. Ejemplo del efecto de un catalizador. a) La molecula A-A es absorbida en el llamado sitio activo del catalizador. b) La molécula B-B arriba también al sitio activo, en donde se rompen los enlaces A-A y B-B y se forman los nuevos enlaces A-B. c) Los productos abandonan el sitio activo.
Entre ellos, tal vez los más importantes sean, por su volumen:
- La producción de amoniaco, NH3, base de los fertilizantes nitrogenados;
- la síntesis de ácido sulfúrico, el producto químico más extendido (se producen anualmente unos 150 millones de toneladas en el mundo);
- la hidrogenación de aceites comestibles;
- la desintegración catalítica, y
- la reformación del petróleo.
Más adelante comentaremos algunos de estos procesos.
La catálisis no es privativa de la industria. Se presenta diariamente, en cada momento, en el interior de nuestros organismos. Las enzimas (proteínas globulares de las que nos ocuparemos al final del siguiente capítulo) controlan casi todas las reacciones químicas corporales, con lo que hacen posible la vida. De este tamaño es la importancia de la catálisis.
Ya que la ciencia central nos ayuda a modificar a voluntad el arreglo atómico en los compuestos, su acción puede utilizarse para transformar hidrocarburos de bajo octanaje en otros con alto índice de octano.
La participación de la química en las refinerías ha resuelto dos problemas graves:
a) que la gasolina natural que se obtiene por destilación sólo alcanza un octanaje cercano a 50 y no puede utilizarse tal cual, para los motores de combustión interna;
b) que la gasolina natural sólo constituye de 20 a 30% del petróleo crudo y esa cantidad es insuficiente para satisfacer la demanda.
Por lo menos, son tres los tipos de reacciones químicas que ayudan a obtener
artificialmente más y mejor gasolina:
1) Desintegración térmica y catalítica:
Mediante este proceso se rompen los hidrocarburos de cadenas muy largas en dos o más que cuentan con cinco a nueve carbonos, los cuales sirven como gasolinas. La desintegración térmica logra este efecto gracias a la elevación de la temperatura. Sin embargo, la presencia de un catalizador (acelerador de reacciones) puede servir para lograr el mismo efecto a bajas temperaturas y presiones.
2) Reformación:
La reformación es otro proceso catalítico que transforma
un isómero lineal en uno ramificado o en uno aromático, mediante el cual se
logra aumentar el octanaje de la gasolina.
3) Alquilación:
El proceso inverso a la desintegración es la reunión de dos hidrocarburos ligeros
para formar uno solo. Se conoce como alquilación. Esta síntesis puede lograrse
cuando uno de los hidrocarburos posee un doble enlace carbono-carbono. Los catalizadores
usados tienen especial atracción hacia este doble enlace, al cual debilitan
a cambio de formar el lazo de unión entre las sustancias reaccionantes.
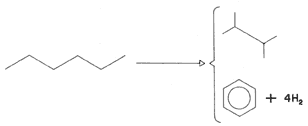
Fórmula 16. Reformación del n-hexano. Los productos pueden ser hidrocarburos ramificados o benceno (ambos son de alto octanaje).
Fórmula 17. Una reacción de alquilación que produce el hidrocarburo con 100 octanos.
Mediante la alquilación se obtienen hidrocarburos con ramificaciones, o sea, de alto índice de octano.
Este proceso también es útil para que las gasolinas no se evaporen fácilmente. Por ejemplo, un hidrocarburo de cinco carbonos —un pentano— tiene un punto de ebullición muy bajo. Si mediante alquilación se puede transformar en uno de seis o siete átomos de carbono, su tendencia a volatilizarse es menor.
Este aspecto está cobrando una importancia enorme, pues se sabe que la presencia de ozono contaminante en la atmósfera de las grandes ciudades se debe a ciertas reacciones entre hidrocarburos, óxidos de nitrógeno y el oxígeno del aire, que se llevan a cabo en presencia de la luz del Sol. Así, para reducir la presencia de ozono en la atmósfera resulta importante disminuir la concentración de hidrocarburos, en vista de lo cual PEMEX realiza actualmente varios proyectos de plantas de alquilación para que las gasolinas no sean tan volátiles, y así los hidrocarburos ligeros no se evaporen fácilmente al ambiente.
ANTIDETONANTES Y CONTAMINACIÓN POR PLOMO
Aunque no se sabe con certeza la forma en que actúa, la adición de una pequeña cantidad de tetraetilo de plomo basta para elevar en forma sustancial el octanaje de una gasolina. Si a un litro de gasolina con 100 octanos se agregan dos mililitros de tetraetilo de plomo, el resultado es una gasolina con 120 octanos. El tetraetilo de plomo eleva más el índice de octano si es añadido a hidrocarburos ramificados. Además, tiene un curioso efecto detergente y lubricante sobre los pistones.
Sin embargo, el plomo liberado después de la combustión de la gasolina Nova es un contaminante peligroso. El contacto prolongado con el plomo produce la enfermedad llamada saturnismo, que antes era característica de los mineros.
Una persona normal puede excretar alrededor de 2 000 microgramos de plomo al día. No obstante, si la entrada de plomo es mayor; este metal se acumula en el organismo y causa diversos problemas en el sistema nervioso central.
En 1985, la Organización Mundial de la Salud (OMS) realizó un trabajo que cubrió doce grandes ciudades. Allí se informó que los habitantes de la ciudad de México contábamos con el nada gratificante récord de poseer la mayor concentración de plomo en la sangre: 22 microgramos por decilitro, en promedio.
El plomo aparece en nuestra comida, pues por cada kilogramo ingerimos también unos 100 a 300 microgramos de plomo, que provienen principalmente de los barnices de las vajillas que empleamos; en nuestra agua, ya que unos 100 microgramos por litro son de plomo, que provienen de las tuberías por las que atraviesa, que son de plomo o están soldadas con él; y en nuestro aire, por la combustión del tetraetilo de las gasolinas y por efluentes de otras industrias que utilizan este elemento.
Hace unos años se abusaba del plomo como ingrediente para fabricar pigmentos. Su empleo se limitó cuando se estimó que había sido la causa de muerte de alrededor de 200 niños en Estados Unidos. Las investigaciones de la OMS indican que si la sangre de un niño contiene al nacer más de 10 microgramos por decilitro, aquél pudiera presentar un retraso mental los dos primeros años de su vida.
A todo esto se exponía a los niños habitantes del Distrito Federal. Por ello resultó imprescindible reducir el contenido de plomo en las gasolinas y buscar antidetonantes que sustituyeran al tetraetilo de plomo. Desde septiembre de 1992, a la gasolina Nova que se expende en la zona metropolitana de la ciudad de México solamente se añaden 0.1 ml de tetraetilo por cada litro. En tal virtud, y debido asimismo a la aparición de la gasolina Magna Sin, las mediciones de plomo en la atmósfera de la ciudad de México en todo 1993 no rebasaron la norma internacional permisible.
¿GASOLINA OXIGENADA? LA LUCHA CONTRA LA CONTAMINACIÓN
Por otra parte, para reducir la contaminación vehicular se desarrolló un convertidor
catalítico por el que atraviesan los gases del escape. Mediante una reacción
catalítica propiciada por metales pesados (platino, paladio y rodio) se logra
reducir las emisiones de monóxido de carbono, hidrocarburos y óxidos de nitrógeno
(el primero es un potente veneno para el organismo y los segundos, como ya se
mencionó, son los precursores de la formación de ozono en la baja atmósfera).
Sin embargo, la presencia de plomo en la gasolina destruye la acción del catalizador,
pues se dice que el plomo lo envenena. Debido a ello, para instalar dicho
convertidor en todas las unidades automotoras nuevas fue necesario desarrollar
un nuevo tipo de gasolina sin plomo, que es la Magna Sin. Esta gasolina contiene
un nuevo antidetonante, que es el metilterbutil éter, o MTBE (véase
fórmula 18) que es un compuesto con un átomo de oxígeno. Por ello se dice que
la Magna Sin es una gasolina oxigenada.
Esta acción es una aportación más de la química en la lucha contra la contaminación. En 1992 PEMEX añadió más de 3 000 millones de litros de MTBE a la gasolina de los automóviles en México.
Por otra parte, además del cierre de la refinería de Azcapotzalco, en 1992
se redujo el contenido de azufre en el gasóleo industrial que se quema en la
zona metropolitana, y en octubre de 1993 apareció en el mercado el diésel Sin,
que es un combustible diésel con menos de 0.5% de azufre. En este caso, logramos
obtener el producto al mismo tiempo que en Estados Unidos, lo cual habla de
la calidad de nuestro personal técnico y científico en la industria de la refinación
del petróleo. Con todas estas acciones disminuyó notablemente la presencia de
dióxido de azufre, SO2, en el aire de la ciudad,
el cual en los últimos años ha permanecido por debajo de la norma internacional
aceptada.
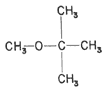
Fórmula 18. Éter metil-terbutílico, base de la gasolina oxigenada. Hasta
ahora hemos tenido que importarlo, pero pronto PEMEX tendrá la
capacidad de producir todo el necesario.
Para que una sustancia sea útil como combustible, debe desprender una gran cantidad de calor cuando reacciona con el oxígeno. La fórmula 19 presenta la combustión completa de un octano.
Fórmula 19. Reacción química que se lleva a cabo en los motores de combustión interna. Se necesitan 25 moléculas de oxígeno para quemar dos moléculas de octano. Si el motor no recibe el aire suficiente, la reacción puede no ser ésta, sino la que produce monóxido de carbono (CO), que es sumamente venenosos. Entre otras cosa, por eso conviene afinar puntualmente el motor de un vehículo.
Vale la pena desviarnos un ápice del tema de este capítulo para presentar otras
sustancias que son aún mejores combustibles que los hidrocarburos. Por ejemplo,
la hidrazina (N2H4), un hidruro del nitrógeno,
es la sustancia preferida para el lanzamiento de cohetes y misiles. Este compuesto
llevó al hombre a la Luna. Su combustión, además de calor; sólo produce agua
y nitrógeno gaseoso (véase la fórmula 20); es un combustible no contaminante.
Fórmula 20. Reacción de combustión de la hidrazina.
En la década de los cincuenta se esperaba que los hidruros de otro elemento, el boro, fueran excelentes combustibles. Se iniciaron en Estados Unidos diversos programas de investigación, cuyo resultado fue aparentemente un fracaso. Los hidruros de boro, al quemarse, generaban óxidos sólidos inmanejables. Sin embargo, como un ejemplo más de que todo nuevo conocimiento es útil, el área que se inició fue de las más importantes y estratégicas de la química inorgánica.
Por ejemplo, hoy se producen 2 000 toneladas anuales de borohidruro de sodio (NaBH4), un excelente agente reductor en transformaciones químicas. Su paternidad se debe al químico H.C. Brown, quien luego abrió brecha en el uso de los compuestos de boro para la síntesis de moléculas orgánicas, por lo que recibió el Nobel de química en 1979.
Un compuesto de boro, el hidruro llamado diborano, B2H6,
revolucionó muchos aspectos de la química. Se inflama en contacto con el aire,
liberando más calor que cualquier hidrocarburo o la hidrazina, y su estructura
muestra un átomo de hidrógeno enlazado a otros dos átomos (véase la fórmula
21), a pesar de que aparentemente no existen los electrones necesarios para
ello. Estos compuestos deficientes en electrones son tema actual de investigación
en el mundo. Un grupo de investigación del Centro de Investigación y Estudios
Avanzados del IPN tiene contribuciones notables en este campo.
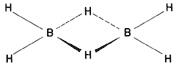
Fórmula 21. Diborano. Los hidrógenos puente entre los dos boros se encuentran por encima y por debajo del plano del papel. Ambos muestran una valencia de dos (están enlazados a dos átomos).
La mayor parte de los compuestos aromáticos del petróleo o de los producidos en la refinación se utilizan para aumentar el octanaje de las gasolinas. Sin embargo, en algunas refinerías se establecen procesos para la producción amplia de estos compuestos. Por ejemplo, en México existe un tren de aromáticos en La Cangrejera, Veracruz —por ahora el complejo petroquímico más importante de América Latina— y en la refinería Lázaro Cárdenas de Minatitlán.
La Cangrejera consta de veinte plantas, siete de las cuales se dedican a la producción de aromáticos (véase la fórmula 22).
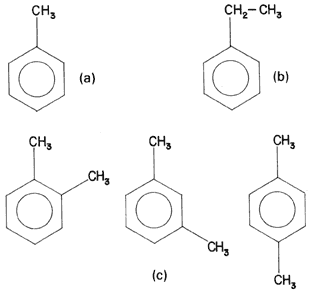
Fórmula 22. Los derivados más comunes del benceno. a) Metilbenceno o tolueno. b) Etilbenceno. c) Isómeros del dimetilbenceno o xilenos. El primero se llama orto-xileno, le siguen el meta-xileno y el para-xileno.
Para empezar, una planta reformadora BTX (por benceno-tolueno-xileno)
transforma una carga que sólo contiene de 5 a 10% de aromáticos en un efluente
con 42 a 47%, una notable muestra de transformación química catalítica. Otra
de las plantas, la de xilenos plus emplea otro proceso catalítico para
aumentar el contenido de xilenos y etilbenceno. Una tercera planta catalítica
se encarga de la isomerización de xilenos, y así de elevar la proporción del
isómero para-xileno, que se emplea posteriormente para la fabricación de fibras
poliéster (ropa), adhesivos y pinturas, tintas, herbicidas y recubrimientos.
En segundo término vienen las plantas fraccionadora y extractora de aromáticos. El principio de éstas es la destilación. En el cuadro 9 se muestran las temperaturas de ebullición de los productos aromáticos primarios.
|
CUADRO 9. Temperaturas de ebullición de aromáticos. |
|||
|
|
|||
|
|
|
||
|
|
|||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|||
Los dos primeros compuestos son fácilmente destilables. Sin embargo, note el amable lector la poca diferencia entre las temperaturas de ebullición de los cuatro isómeros que les siguen en el cuadro. Para su separación se requieren torres de destilación muy altas. Es más, se prefiere separar al m-xileno del p-xileno (que ebullen con menos de un grado de diferencia) por otro proceso diferente de la destilación, la llamada cristalización fraccionada. Si bien los puntos de ebullición de ambos compuestos son similares, sus puntos de congelación son de -47.9°C y 13.3°C, así que mediante un proceso de cristalización en frío se logra separar el p-xileno de su isómero menos valioso, el m-xileno.
Por lo general, como las reacciones de aromatización se llevan a cabo a una temperatura moderada a la que no se presentan tantas rupturas de enlaces, la proporción de benceno que se obtiene muchas veces no es mayor de 10%. Como la demanda del mercado es mayor, en La Cangrejera existe una última planta, llamada hidrodealquiladora de tolueno, en la que parte del tolueno se transforma en benceno (véase la fórmula 23). Los usos de éste son extensísimos, basta mencionar la fabricación de nailon, hule sintético, insecticidas, detergentes y perfumes.
No obstante, no todo el tolueno se transforma en benceno, pues aquél es importante materia prima para la producción de desinfectantes, preservativos de alimentos, colorantes y explosivos.
La figura 13 resume el tratamiento que el petróleo crudo recibe en la refinería. Vemos que además de los aromáticos se obtienen otros productos gaseosos (etileno, propileno y butileno), que por ser comunes a los que se producen a partir del gas natural, los trataremos más adelante.
N2, UNA MOLÉCULA NO REACTIVA, Y SU REPERCUSIÓN EN LA AGRICULTURA
Los tejidos de todos los seres vivientes contienen nitrógeno. Este es un elemento básico de nuestra dieta y de la de todas las plantas y animales.
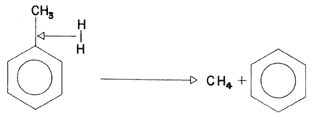
Fórmula 23. En la reacción de alquilación la molécula de hidrógeno rompe
el enlace entre el anillo y el grupo alquilo, CH3 en
este caso, con lo que se recuperan benceno y metano.
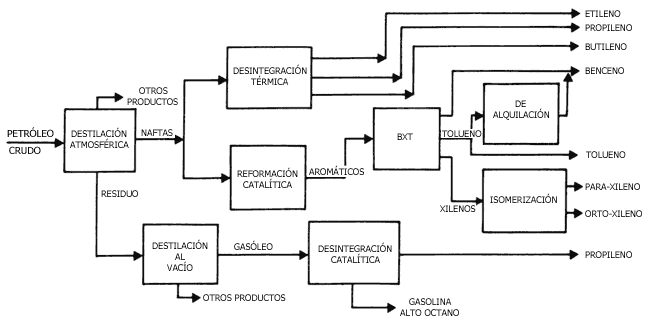
Figura 13. Síntesis de la cadena productiva mediante la cual una mezcla de miles de compuestos (el petróleo crudo) se transforma en productos más aprovechables. Las sustancias de la derecha son las materias primas de la industria petroquímica. (Tomada de Análisis de la industria petroquímica por cadenas productivas, Comisión Petroquímica Mexicana, México 1986.)
Vivimos rodeados de nitrógeno (78% del aire atmosférico contiene la molécula N2). Grandes volúmenes de N2 pasan todos los días por nuestros pulmones y, sin embargo, nada de ello nos sirve para suplir nuestras necesidades de este elemento. Nuestro cuerpo no posee la capacidad de transformar el N2 e incorporarlo a nuestros tejidos. La molécula de N2 es muy estable y sale de los pulmones de la misma forma en la que entra.
En realidad, obtenemos el nitrógeno que requerimos al asimilar el que contienen los vegetales y animales que constituyen nuestro alimento. Pero... ¿y cómo obtuvieron ellos ese nitrógeno?
Todos los animales dependemos del reino vegetal para hacernos del nitrógeno
necesario. Los carnívoros lo hacen indirectamente, al alimentarse de otros animales
vegetarianos. Ahora bien, las plantas obtienen el nitrógeno al absorber del
suelo sales nitrogenadas (nitratos, NO-3, por
ejemplo) o derivados del amoniaco, NH3, a través de las raíces.
Pero... ¿por qué no se ha acabado el nitrógeno del suelo?
En parte se debe a que recircula en un proceso denominado ciclo del nitrógeno. Se estima que los organismos vivos contienen unos 15 000 millones de toneladas de nitrógeno. Cuando mueren, su nitrógeno retorna al suelo, de donde vuelve a ser tomado por las plantas (por eso la tierra de hoja es un buen abono). Pero la otra parte del asunto es que existe una fuente de producción de nitrógeno asimilable: unos diminutos microorganismos son capaces de transformar el nitrógeno del aire ( N2) en amoniaco (NH3) y otros derivados nitrogenados (se dice que fijan el nitrógeno). Estas bacterias y algas trabajan simbióticamente con otros vegetales (como las leguminosas, por ejemplo), que son el destino de ese nitrógeno asimilable (unos 200 millones de toneladas al año).
El campesino al rotar cultivos enriquece la tierra. Un plantío de frijol, que es una leguminosa, logra la nitrificación del suelo gracias a la acción de los microorganismos fijadores de nitrógeno.
Aunque parezca mentira, antes del siglo XX la alimentación de toda la humanidad descansaba en estos microorganismos. Si algo les hubiera pasado y hubieran desaparecido, la población del planeta había decrecido enormemente, después de un periodo terrible de hambruna. La razón es que no se habría podido producir nitrógeno asimilable a partir del que existe en el aire. Sólo habríamos contado con el recirculado por los seres vivos, con el de la sal nitro chilena (enormes depósitos naturales de nitrato de sodio) y el obtenido como subproducto de la fabricación de carbón de coque.
Durante muchos años, las salinas chilenas garantizaron el abasto de fertilizantes nitrogenados a todo el mundo. Adicionalmente, el nitrato chileno también es la materia prima para fabricar multitud de explosivos (trinitrotolueno —TNT—, nitroglicerina y nitrocelulosa). Por lo mismo, el control de las líneas marítimas hacia Chile era crítico para el abastecimiento oportuno de este elemento.
Al estallar la primera Guerra Mundial se libraron cerca de Chile dos batallas marítimas de importancia: una en las islas Coronel, que ganó Alemania, y otra en las Malvinas, de la que salieron victoriosos los británicos. Hay quienes opinan que estas dos batallas pudieron haber dado fin a la guerra, de no ser por dos enormes descubrimientos científicos de unos cuantos años antes.
Por una parte, en 1909 el químico alemán Fritz Haber perfeccionó el proceso para obtener amoniaco directamente a partir de nitrógeno e hidrógeno (véase la fórmula 24). ¡Por fin el género humano había podido vencer a la poco reactiva molécula del N2! No resistió las altas temperaturas y presiones, ni la presencia de un catalizador.
Fórmula 24. Reacción de Haber.
Dos años antes, otro químico alemán llamado Wilhelm Ostwald encontró el catalizador adecuado para convertir amoniaco en ácido nítrico. El resto para llegar a obtener explosivos era coser y cantar.
Ambos descubrimientos fueron empleados por Alemania una vez que se les cerró la ruta hacia Chile. Así, aunque el proceso Haber tuvo en principio esta aplicación militar, que tal vez prolongó la primera Guerra Mundial, sirvió después para producir los fertilizantes que propiciaron la enorme explosión demográfica de este siglo.
Una vez más, el conocimiento científico sirvió como arma de dos filos, algo similar a lo que ocurre con el bisturí, que es una bendición en las manos de un médico, pero un peligro en las de un asesino.
De la fórmula 24 para obtener amoniaco, es claro que el nitrógeno se obtiene directamente del aire, pero ¿cómo puede conseguirse hidrógeno en forma elemental? Es más, la mezcla nitrógeno-hidrógeno que se requiere debe ser muy pura, para que no se envenene el catalizador que acelera la transformación.
Hoy, la forma más barata de obtener el hidrógeno de la mezcla hace uso del metano, CH4, del gas natural.
Para obtener el metano se llevan a cabo diversos procesos:
a) Para empezar, se elimina el azufre del gas natural (que viene en forma de hidruro, H2S). Luego este azufre se recupera en forma elemental para la fabricación de ácido sulfúrico.
b) El gas natural endulzado (sin H2S) se alimenta a una planta criogénica. El objetivo de ésta es separar los diversos componentes del gas natural mediante su destilación sucesiva, con lo que se obtiene el metano puro.
Al metano se le adiciona vapor de agua y aire y se introduce la mezcla en enormes hornos a temperaturas de 1 000°C (muy cerca del límite metalúrgico de las tuberías por las que atraviesa la mezcla), donde ocurre la transformación de la fórmula 25.

Fórmula 25. Producción de la mezcla nitrógeno-hidrógeno para obtener amoniaco a partir de gas natural.
El bióxido de carbono producido se elimina posteriormente mediante su absorción con disolventes especiales, con lo que se alcanza la deseada mezcla nitrógeno-hidrógeno.
En México, PEMEX cuenta con un enorme complejo productor de amoniaco en Cosoleacaque, Veracruz, uno de los más grandes del mundo.
Desde Cosoleacaque se envía el amoniaco por tubería hasta la planta de Fertimex, donde se transforma en diversos fertilizantes nitrogenados.
CÚMULOS METÁLICOS COMO CATALIZADORES
Los catalizadores más importantes en la industria petroquímica son los que contienen metales de transición (vanadio, hierro, níquel, cobalto, rodio, etcétera). Para que estos elementos actúen como catalizadores se requiere que tomen la forma de pequeñísimas partículas (con menos de una millonésima de centímetro de diámetro), llamadas cristalitos, las cuales se depositan sobre un soporte, como el óxido de aluminio.
Aún hoy es un rompecabezas entender los mecanismos de la catálisis, que es un área de intensa investigación actual. Una forma de ir despejando incógnitas ha sido estudiar, en el laboratorio, el comportamiento de compuestos que contienen más de dos átomos metálicos, enlazados entre sí formando una estructura polihédrica con caras triangulares; los llamados cúmulos metálicos (véase un ejemplo en la fórmula 26).
El estudio de las reacciones que se llevan a cabo sobre la superficie del cúmulo reflejan, en ocasiones, algunos procesos catalíticos comerciales, y dan luz sobre el fundamento de la catálisis.
Se han llegado a reunir más de 30 átomos metálicos en un cúmulo. Algunos alcanzan el tamaño para utilizarlos como cristalitos y han sido patentados como eficientes catalizadores.
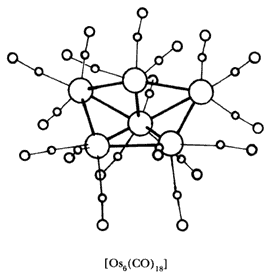
Fórmula 26. Estructura de un cúmulo metálico con seis átomos de osmio (los círculos grandes) y 18 carbonilos (C=O).
LAS CADENAS PRODUCTIVAS QUE PARTEN DEL ETILENO
Multitud de productos petroquímicos se obtienen a partir de dos hidrocarburos con un doble enlace: el etileno, C2H4, y el propileno, C3H6. El primero es, con mucho, la materia prima petroquímica más importante. En la figura 14 se muestran algunas de las cadenas productivas en las que interviene el etileno.
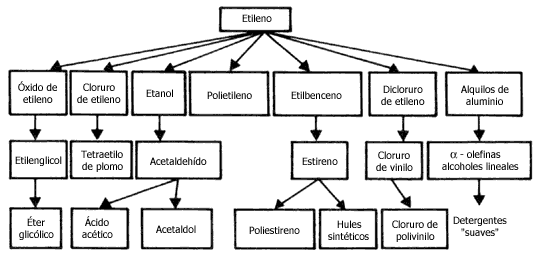
Figura 14. Los principales productos petroquímicos que se obtienen a partir
del etileno. (Tomado de R.M. Stephenson, Introducción a los procesos químicos
industriales, CECSA, México 1980).
Algunos de los nombres de sustancias que aparecen en este diagrama se volverán más familiares al lector cuando lea el capítulo tercero.
La obtención industrial de etileno se lleva a cabo mediante la deshidrogenación del etano (véase la fórmula 27).
Fórmula 27. Reacción de producción del etileno CH2 = CH2, a partir del etano, C2H6, del gas natural.
Esta transformación es fuertemente endotérmica, es decir; requiere de calor para ocurrir. Por eso debe llevarse a cabo en hornos de pirólisis, a unos 1000°C. Esta alta temperatura produce el rompimiento de enlaces, así que la formación de etileno se ve acompañada de la creación de otros productos secundarios no deseados, que son separados posteriormente por destilación o absorción.
En el complejo de La Cangrejera se cubre la producción de algunos de los compuestos del diagrama de la figura 14, a saber; óxido de etileno, acetaldehído, etilén glicol y polietileno de baja densidad. Son múltiples los usos de estas sustancias: en fibras, películas, cables, tubos y láminas plásticas, cementos, cosméticos, desodorantes, fluidos para frenos, herbicidas, tintas, detergentes, líquidos para champús, telas de planchado permanente, anticongelantes, inhibidores de corrosión y suavizantes de fibras. Todo un mar de productos petroquímicos de consumo final.
REACTIVOS DE GRIGNARD. LA MAGIA DE LA QUÍMICA ORGANOMETÁLICA
En el laboratorio, el interés del químico es la preparación de nuevos compuestos, para ampliar con ello el conocimiento universal sobre el comportamiento químico y dar lugar a posibles nuevas aplicaciones.
Damos fin a este capítulo sobre petroquímica con el trabajo que el francés Grignard realizó en 1900 sobre la reacción del magnesio metálico con los halogenuros de alquilo. Estos compuestos se obtienen al eliminar un hidrógeno de un hidrocarburo y sustituirlo por un halógeno (flúor; cloro, bromo o yodo).
Fórmula 28. En esta reacción, X representa a un halógeno (flúor, cloro, bromo o yodo) y R a un radical alcalino (-CH3' por ejemplo). La mezcla del halogenuro de alquilo, R-X, con magnesio metálico, en éter, da lugar al compuesto R-Mg-X , llamado organomagnesiano: el reactivo de Grignard.
La fórmula 28 presenta la reacción de formación del reactivo de Grignard. En ausencia de éter, los organomagnesianos son sólidos muy sensibles al aire y a la humedad, por lo que deben ser resguardados bajo atmósferas inertes (nitrógeno o argón). Su estructura es de largas cadenas (véase la fórmula 29).
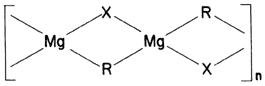
Fórmula 29. Cadena de un organomagnesiano. Algo notable en estos compuestos es que el carbono presente en R presenta cinco enlaces, en cuyo caso la tetravalencia del carbono pierde todo sentido.
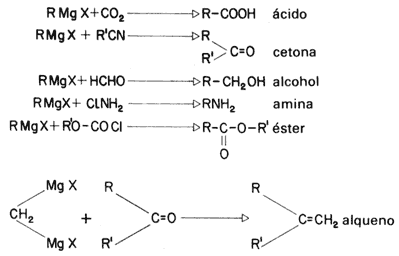
Fórmula 30. Esquemas simplificados de algunas reacciones donde el reactivo de Grignard se transforma en muy diferentes compuestos. A fin de cuentas, el halógeno del compuesto R-X de la fórmula 28 ha sido reemplazado por muy diversos grupos de átomos.
El trabajo de doctorado de Grignard, por el cual recibiera luego el Premio Nobel de química en 1912, consistió en el uso de los organomagnesianos en síntesis orgánica. Hoy estos reactivos son ampliamente empleados, pues permiten obtener una multitud de compuestos, con muy diversos grupos funcionales (véase la fórmula 30).
Reacciones como éstas son la llave del químico para abrir las puertas de lo desconocido. Parece mentira que existan procedimientos para sustituir un átomo (un halógeno en este ejemplo) por cualquier otro grupo, en todas y cada una de los tetrillones de moléculas de una muestra. ¡La química sí es verdadera producción en serie!
Basualdo, J. S., Complejo petroquímico La Cangrejera, Veracruz, PEMEX, México, 1981.
Comisión Petroquímica Mexicana, Análisis de la industria petroquímica por cadenas productivas, SEMIP, México, 1986.
Chow, S., Petroquímica y sociedad, colección La Ciencia desde México, Fondo de Cultura Económica, México, 1987.
Fremantle, M., Chemistry in Action, MacMillan, Londres, 1987.
ONUDI, The Petrochemical Industry in Developing Countries, Viena, 1985.
PEMEX, El petróleo, Gerencia de información y relaciones públicas de Petróleos Mexicanos, México, 1985.
—,Memoria de labores 1992, México, 1993.
Romo de Vivar, A., Química, Universo, Tierra y vida, colección La Ciencia desde México, Fondo de Cultura Económica, México, 1988.
Silva Herzog, J., La expropiación del petróleo 1936-1938. Álbum fotográfico, Fondo de Cultura Económica, México, 1981.
Stephenson, R. M., Introducción a los procesos químicos industriales, CECSA, México, 1984.