III. MACROMOLÉCULAS
SIN DUDA, éste es otro campo en el que la ciencia central ha incidido profundamente en los últimos años.
El descubrimiento del hule y la síntesis de plásticos artificiales dieron un vuelco a la naturaleza de los materiales que rodean a la humanidad. En muchas de sus aplicaciones, los plásticos han sustituido con ventaja al vidrio, al cuero, al algodón, a la cerámica, a la madera y hasta a los metales. Hoy, los materiales plásticos son importantes satisfactores de necesidades en cualquier sociedad. En los países desarrollados, cada habitante cuenta en promedio con 100 kilogramos de plástico. En México esta cifra ya supera los 15 kilogramos, y su influencia abarca sectores industriales de gran importancia, como el automotriz, el electrónico, el de la construcción e incluso el de la salud.
Por otra parte, respecto a las macromoléculas de la vida, el hallazgo de la estructura de las proteínas y los ácidos nucleicos dio un sustento básico a la biología molecular.
Sobre estos asuntos versa el presente capítulo, en el que transitamos directamente la tercera parte de la ruta que nos lleva del tequesquite al ADN.
EL HULE: MACROMOLÉCULA NATURAL
Por su naturaleza elástica, el hule es una de las más interesantes e importantes sustancias que conocemos. Una liga de hule se puede estirar hasta 10 veces su tamaño original y regresa a su forma inicial casi sin deformarse. El hule se puede moldear de muchas formas y, además, es impermeable al agua y al aire.
El hombre conoció el hule hace muchos siglos, como una secreción lechosa de diversas plantas y árboles. El látex (como se conoce a la suspensión coloidal de las partículas de hule en agua) se encontraba principalmente en el guayule y la hevea brasiliensis, en México, Perú y Brasil.
Los antiguos mexicanos lo utilizaron en la fabricación de bolas para practicar el juego de pelota. Por cierto, el tiro para obtener el triunfo era tan raro y tan difícil que el jugador que lo lograba tenía derecho a apoderarse de todas las mantas y joyas de los espectadores. Otros habitantes de América utilizaron el hule para proteger del agua sus prendas de vestir y para la fabricación de botas rudimentarias.
Cada árbol de hevea produce entre 15 y 30 gramos de látex por día. Otras sustancias lechosas con propiedades semejantes al hule se obtienen de la gutapercha en Malaya, Borneo y Sumatra, y del kok-sagis en la Rusia asiática.
Para obtener el látex se hacen incisiones en forma de V en el tronco del árbol. El jugo lechoso que fluye se recoge en vasijas. En la misma plantación, el látex se coagula (se rompe la estabilidad del coloide) mediante la adición de un ácido. Posteriormente, se lo lava y seca.
La primera fábrica que empleó hule natural crudo fue establecida en París en 1803. En un principio producía ligas y tirantes, pero posteriormente incorporó el hule en gabardinas, como repelente del agua. Sin embargo, este hule tenía serios inconvenientes. Además de ser pegajoso, en verano se reblandecía y en invierno se volvía rígido y quebradizo.
En 1839 Charles Goodyear descubrió accidentalmente cómo resolver estos problemas cuando se le derramó una mezcla de azufre y hule natural sobre una estufa caliente. El producto obtenido resultó ser más elástico y resistente al calor y a la tensión que el hule crudo. El proceso de mezclar y hacer reaccionar el azufre caliente con el hule crudo se llama vulcanización.
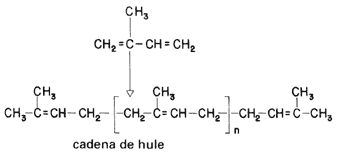
La explicación molecular de este profundo cambio en las propiedades del hule se muestra en la fórmula 31.
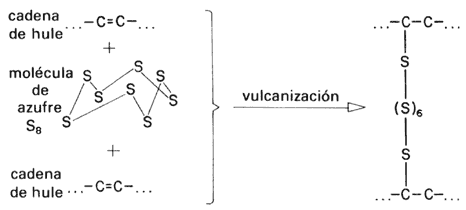
Fórmula 31. Las cadenas de polímero en el hule contienen puntos con dobles ligaduras carbono-carbono. El azufre, que consiste en moléculas con ocho átomos arreglados en forma de corona, reacciona con dos cadenas y las une entre sí. Este enlace que amarra unas cadenas con otras da al hule sus propiedades mecánicas y térmicas. Si el hule de las llantas de un vehículo no se vulcanizara, apenas rodaría unos pocos kilómetros.
Hacia fines del siglo pasado, el hule vulcanizado tenía tantos usos que la producción de la hevea en Brasil era insuficiente. Unos botánicos ingleses sacaron de contrabando semillas de árbol del territorio brasileño y produjeron una variedad más resistente a las enfermedades y con mayor rendimiento de látex.
El imperio británico estableció enormes plantaciones en sus colonias del Lejano Oriente. La cantidad y calidad de este hule les dio a sus poseedores el control prácticamente total del mercado mundial.
MACROMOLÉCULAS, POLÍMEROS Y MASA MOLECULAR
Desde el siglo pasado los químicos han establecido una escala especial de masas. Como lo que se trata de medir es la masa de un átomo o una molécula, se escogió una unidad sumamente pequeña: la unidad de masa atómica (uma), que es la que corresponde aproximadamente al átomo de hidrógeno más abundante en la naturaleza:
1 uma = masa de un átomo de hidrógeno-1
En esta escala, las masas de los átomos naturales corresponden a números entre 1 (hidrógeno) y 238.1 (uranio). Aunque en este siglo se ha modificado la base de la escala, los efectos son poco notorios.
Las masas de las moléculas se obtienen al sumar las correspondientes de los átomos que las constituyen. Por ejemplo, la molécula de sulfuro de hidrógeno, H2S, tiene masa de 34.1 uma, que es la suma de las de dos hidrógenos (con 1 uma cada uno) y un azufre (con 32.1 uma).
A las moléculas con masas superiores a 10 000 uma se las conoce como macromoléculas. Son esenciales en diversos procesos biológicos. La hemoglobina, el almidón, las enzimas y el ADN son macromoléculas naturales de los organismos vivos.
Cuando una macromolécula se obtiene al repetirse un patrón regular de átomos a lo largo de la misma, se tiene un polímero. Existen polímeros cuya masa molecular supera el millón de uma. El compuesto con moléculas más pequeñas, a partir de las cuales se construye un polímero, es un monómero. Para obtener algunos polímeros se utilizan dos o más monómeros, y por eso se conocen como copolímeros.
El algodón, la madera, el hule y la lana son ejemplos de polímeros naturales. Algunos polímeros sintéticos son el polietileno, y el policloruro de vinilo (PVC).
Cuando un polímero fluye y acepta ser moldeado, extrudido o laminado, se lo denomina plástico. Dentro de éstos existen los termoestables, que no pueden ser suavizados o remoldeados mediante calentamiento, y los termoplásticos, que si admiten su reprocesamiento. Las resinas epoxi, adhesivos familiares en el hogar; y las espumas de poliuretano de nuestras almohadas son termoestables. La facilidad para reprocesar los termoplásticos se debe a que sus cadenas poliméricas no están entrelazadas. El polietileno, de uso tan generalizado, y el poliacrilato de metilo, popular sustituto plástico del vidrio, son ejemplos de termoplásticos.
EL HULE SINTÉTICO. QUÍMICA EN ACCIÓN
El incremento del precio de la materia prima, así como la irrupción de la primera Guerra Mundial, transformaron el panorama mundial del mercado del hule. Desde ese momento, particularmente en los países que carecían de este recurso, se dio un gran impulso a la producción de hule sintético.
Desde 1826, Michael Faraday había encontrado que el calentamiento del hule crudo o destilación destructiva producía un hidrocarburo de bajo punto de ebullición y fórmula C5H8, que recibe el nombre de isopreno (véase la fórmula 32).
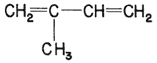
Fórmula 32. Molécula del isopreno. El hule se obtiene cuando una multitud de moléculas como ésta se enlazan unas tras otras. Por ello se dice que el isopreno es el monómero del hule.
La clave molecular de la estructura del hule la halló Hermann Standinger en
Alemania, a mediados de la década de los años veinte. Ello le valió el Premio
Nobel de química en 1953. Descubrió que el hule está constituido por moléculas
gigantes, formadas a partir de una única unidad estructural: el isopreno. En
el lenguaje actual se dice que el isopreno es el monómero del polímero
llamado hule (véase la fórmula 33).
Fórmula 33. Un polímero es una macromolécula en la que se repite n veces la misma estructura básica (monómero). En el caso del hule, las cadenas pueden tener desde n=20 000 hasta n=100 000.
Los primeros intentos de polimerizar isopreno para obtener hule sintético fueron
infructuosos. Por sí misma, la síntesis industrial del monómero presentaba serios
problemas. Por eso es que muchas de las experiencias iniciales se realizaron
con moléculas semejantes al isopreno. En 1928 se preparó en Alemania el primer
sustituto del hule natural: un copolímero del butadieno y el estireno al que
se llama SBR (por sus siglas en inglés) y que resultó excelente
para fabricar llantas (véase la fórmula 34).
El color negro de las llantas proviene del llamado negro de humo, que es carbón en polvo que se agrega para reducir su costo y para aumentar la resistencia a la fricción y la tensión.
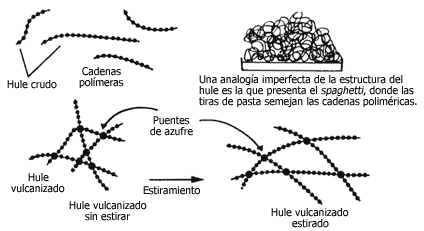
Figura 15. La elasticidad del hule se debe a que las enormes cadenas poliméricas se encuentran enrolladas como en el espagueti. Las cadenas se extienden al estirar ligeramente el material y vuelven a enrollarse al dejar de estirar; aunque, al aplicar una fuerza mayor, puede ocurrir que el hule no vuelva a su tamaño original. Sin embargo, si el hule ha sido vulcanizado, los puentes de azufre que se forman entre las cadenas dan al hule mayor solidez, sin perder su elasticidad. Si la cantidad de puentes de azufre es muy grande, se obtiene un material duro llamado ebonita, con el que se fabrican cajas para acumuladores y bolas de boliche.
Hacia 1940 la producción de hule sintético alcanzó 175 000 toneladas en Alemania,
90 000 en la URSS y 10 000 en Estados Unidos. Como durante la segunda Guerra
Mundial el ejército japonés controló la principal zona productora de hule natural,
los gobiernos aliados iniciaron programas de emergencia para la fabricación
de hule sintético. Así, por ejemplo, al final de la contienda Estados Unidos
producía 700 000 toneladas de hule sintético por año.
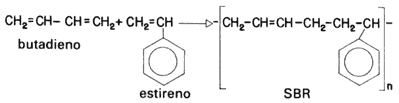
Fórmula 34. El hule sintético que se elabora con butadieno y estireno es un copolímero, pues se obtiene a partir de dos monómeros diferentes.
Otro hule sintético preparado en esa época fue el neopreno, como se llama al
polímero del cloropreno. Aquí un átomo de cloro ocupa la posición del grupo
metilo (CH3) del isopreno (véase la fórmula 35). El neopreno,
a diferencia del hule, no se hincha ante el contacto con disolventes orgánicos,
por lo que se emplea para fabricar las mangueras para verter gasolina.
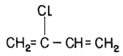
Fórmula 35. El cloropreno es el monómero del neopreno.
En una molécula que presenta una doble ligadura carbono-carbono, este enlace es rígido y no se presenta una rotación libre sobre el mismo. Debido a ello pueden existir dos isómeros del compuesto, dependiendo del arreglo espacial de los sustituyentes alrededor de la doble ligadura. Ésta es la isomería geométrica. Un ejemplo de ella, en la fórmula 36, puede ayudar a comprender el fenómeno.
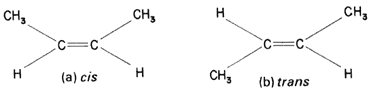
Fórmula 36. Como el enlace C=C es rígido, existen dos formas geométricas de arreglar en el espacio dos grupos metilo, -CH3, enlazados a cada carbono del doble enlace. a) El isómero cis tiene a los metilos hacia el mismo lado del doble enlace. b) El isómero trans los tiene en direcciones opuestas.
Este arreglo especial les da a las moléculas propiedades particulares y diferentes.
Además de que los dos isómeros cis y trans tienen diferentes puntos
de ebullición y fusión, reaccionan químicamente en diferente forma. En un momento
veremos qué tiene esto que ver con el hule natural.
QUÍMICA: UNA CIENCIA SOBRE LAS TRES DIMENSIONES
Los intentos de polimerizar isopreno en el laboratorio para producir hule natural se coronaron con éxito en 1954. A pesar de que ya se conocía desde hacia más de 100 años la composición del hule, hasta ese momento se logró arreglar esteroespecíficamente a las moléculas del isopreno. Es decir; resolver el problema de la isomería cis-trans en la macromolécula.
Así, en el poliisopreno tenemos dos casos extremos, representados en la fórmula 37.
Antes de 1954 los intentos por polimerizar al isopreno producían una mezcla heterogénea de los isómeros cis y trans con propiedades distintas de las del hule natural (que es el cis). Es en esta fecha cuando, casi simultáneamente, los químicos de las compañías Goodyear y Firestone descubrieron cómo polimerizar esteroespecíficamente el isopreno. Con ello se pudo obtener en el laboratorio hule sintético idéntico al natural.
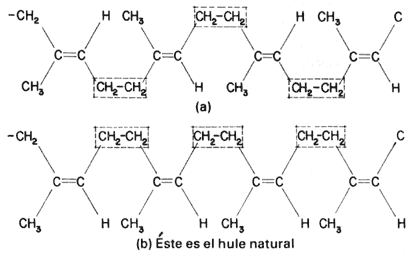
Fórmula 37. a) Poli-trans-isopreno. Los grupos -CH2-CH2- están alternados sobre lados opuestos de la doble ligadura. b) Poli-cis-isopreno. En este caso, todos los -CH2-CH2- están del mismo lado.
Los químicos K. Ziegler y G. Natta se hicieron acreedores al Premio Nobel de química en 1963 por su descubrimiento de catalizadores esteroespecíficos.
El hule es, entonces, una macromolécula que puede ser obtenida a partir del látex de diversas plantas o prepararse sintéticamente en el laboratorio. Éste será también el orden que seguiremos en este capítulo. Trataremos inmediatamente los polímeros sintéticos, como el nailon, el polietileno, el teflón o los silicones, y al final las macromoléculas de origen biológico, como la celulosa, la seda y el ADN.
TIPOS DE REACCIÓN PARA PREPARAR POLÍMEROS SINTÉTICOS
Según los principales tipos de reacción por los cuales se tienen polímeros, éstos se clasifican como polímeros de adición o de condensación. En los primeros se adicionan monómeros que contienen una doble ligadura C=C, en un proceso facilitado por la presencia de un catalizador. En los segundos se forman largas cadenas como resultado de la combinación de dos moléculas diferentes (monómeros), mediante la pérdida de alguna molécula pequeña, generalmente agua.

POLIETILENO: UN POLÍMERO POR ADICIÓN
El compuesto más sencillo que puede tener una reacción de polimerización por adición es el etileno CH2=CH2. El polímero resultante, el polietileno, es el más barato y el que se produce en mayor cantidad en el mundo. Las llamadas bolsas de plástico están hechas de polietileno.
La materia prima, el etileno, se obtiene por la eliminación de dos átomos de hidrógeno del etano, el segundo componente más importante del gas natural (véase la fórmula 27). En La Cangrejera, PEMEX fabrica tanto el monómero como el polietileno de baja densidad.
La doble ligadura es la razón de la reactividad de este compuesto. Con la presencia del catalizador adecuado tiene lugar la polimerización (véase la fórmula 38).
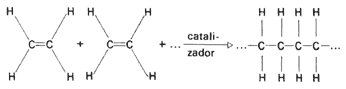
Fórmula 38. La polimerización del etileno constituye un buen ejemplo del uso de catalizadores para unir pequeñas moléculas de una forma específica, y así producir un polímero.
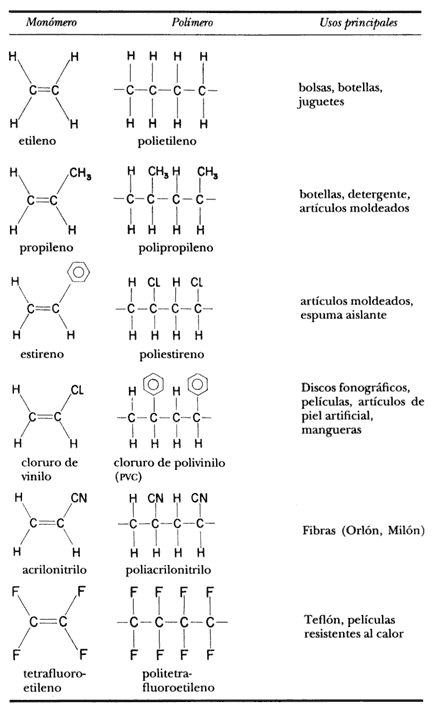
Se puede obtener una tremenda variedad de moléculas al sustituir los átomos de hidrógeno en el etileno por otros átomos o grupos de átomos, así como también una gran variedad de polímeros de adición, como se muestra en el cuadro 10.
|
|
|
Una vez que los monómeros se transforman en polímeros se incrementa notablemente
el valor del producto. Veamos la figura 16. El valor (en 1984) de una tonelada
de etileno era de 425.9 dólares. Si esa tonelada se emplea para fabricar cloruro
de vinilo (el monómero del PVC), su valor aumenta 51%. Si con ella se obtiene
polietileno, aumenta 55%. Ésta es la magia de la petroquímica, sus efectos
dan a los productos valor agregado, el cual se maximiza si se llega hasta los
productos de consumo terminal.
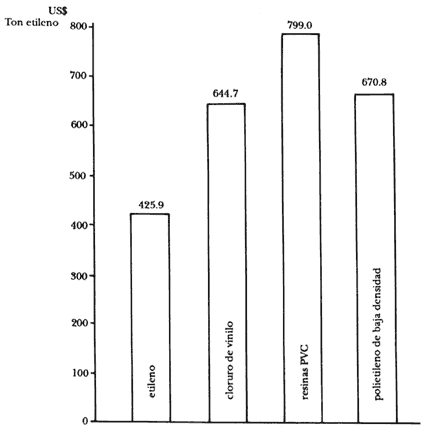
Figura 16. Precio en dólares por tonelada de etileno empleada para la fabricación de algunos de los productos del cuadro 10. La cifra representa el valor del petroquímico al ser exportado (E), o al que se lo compra, en caso de que se importe (I). Fuente: Análisis de la industria petroquímica por cadenas productivas, Comisión Petroquímica Mexicana, México 1986.)
EL PETRÓLEO TAMBIÉN SIRVE PARA LAVAR
El detergente que empleamos comúnmente es resultado de la petroquímica.
Para su elaboración es necesario preparar un tetrámero del propileno, CH3-CH-CH2. En este caso, la polimerización se reduce a la unión de cuatro unidades monoméricas. El resultado se muestra en la fórmula 45. Se trata de un hidrocarburo con doce átomos de carbono.
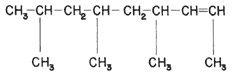
Fórmula 45. El tetrámero del propileno. Lo fabrica Petróleos Mexicanos.
El tetrámero se hace reaccionar con ácido sulfúrico y con benceno, otro producto petroquímico básico que se mencionó en el capítulo anterior. La reacción, después de una neutralización con sosa cáustica, NaOH, produce un compuesto con un rimbombante nombre químico: dodecilbencensulfonato de sodio. Éste es el detergente de todos los días en todas las casas (véase la fórmula 46).
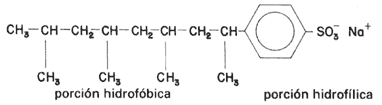
Fórmula 46. Molécula del detergente común y corriente. Las formas comerciales del producto le adicionan multitud de otros productos, con muy diversas finalidades.
Las moléculas de detergente, como las de los jabones, constan de dos partes
bien diferenciadas. Por un lado se tiene una larga cadena de átomos de carbono,
que por ser de naturaleza orgánica se disuelve en las grasas y no es afín al
agua (porción hidrofóbica); por el otro, un grupo con carga eléctrica,
con mucha afinidad al agua (porción hidrofílica).
Esta estructura de jabones y detergentes es la responsable de que actúen como limpiadores. La porción hidrofóbica penetra en la grasa, mientras que el extremo hidrofílico toma contacto con el agua. Así, una tallada logra que la gota de grasa se desprenda de la ropa sucia.
El problema con los detergentes, y no con los jabones, es que muchos no son biodegradables (no son destruidos por los microorganismos del medio ambiente), por lo que se acumulan en los recursos acuáticos. Desgraciadamente, ya resulta familiar la presencia de espumas en las aguas de nuestros ríos y lagos. Las concentraciones moderadas de detergente afectan sensiblemente la vida acuática, por lo que éste es un problema muy grave.
La solución no es difícil. Si el tetrámero de la fórmula 45 fuese lineal, y no ramificado, el detergente podría ser biodegradado. Estos detergentes con cadena lineal son un poco más costosos, pero afortunadamente ya va generalizándose su producción y consumo. Actualmente una buena proporción de los detergentes líquidos que se encuentran en el mercado ya tienen dodecilbencensulfonato lineal, perfectamente biodegradable. Otra aportación de la química contra la contaminación.
EL UNO, DOS, TRES DE LOS PLÁSTICOS
Hay al menos tres factores que determinan las propiedades del polietileno y, en general, de los polímeros:
1) El grado de polimerización. Un polímero con una cadena de 10 átomos de carbono es, obviamente, diferente de uno en el que las cadenas sean de 10 000 átomos. Los de cadenas largas son más fuertes, pues son más fibrosos que los de cadenas cortas.
2) El grado de cristalinidad. Ya comentamos que una cadena polimérica puede imaginarse como una tira de espagueti que se dobla de muchas y variadas maneras: es amorfa. Sin embargo, es posible ordenar estas cadenas, al menos parcialmente, para obtener zonas cristalinas.
Básicamente, hay dos tipos de polietileno: el de baja y el de alta densidad. Ambos son producidos mediante diferentes catalizadores y condiciones de reacción. El polietileno de alta densidad, parcialmente cristalino, se utiliza, entre otras cosas, en la fabricación de juguetes, botellas y gabinetes de radio y televisión. El de baja densidad, amorfo, se emplea para hacer bolsas y como aislante eléctrico. Sin embargo, las películas para envolver los alimentos y mantenerlos frescos se hacen con polietileno de alta densidad, que es menos permeable, y por lo tanto conserva mejor la humedad natural de los alimentos.
3) El grado de reticulación. Este se logra cuando unas cadenas están unidas a otras por fuertes enlaces. Con esto el polímero adquiere gran fuerza y rigidez. La vulcanización del hule es, precisamente, la forma de aumentarle el grado de reticulación.
GRUPOS FUNCIONALES EN QUÍMICA ORGÁNICA
Un grupo funcional es la parte reactiva de una molécula. La presencia de un determinado conjunto de átomos provoca que todas las moléculas que contengan un grupo dado experimenten reacciones químicas similares. Algunos ejemplos de grupos funcionales son los siguientes:
Cada grupo funcional le confiere propiedades particulares a la cadena de carbono a la cual está unido. Por ejemplo, centrémonos en el grupo hidroxilo. Los compuestos que lo incluyen se llaman alcoholes. Los más sencillos de estos compuestos son el metanol, CH3 -OH, el etanol, CH3 -CH2 -OH, y el propanol, CH3 -CH2 -C2H -OH. Los tres presentan las reacciones químicas típicas del grupo hidroxilo. Sin embargo, el diferente tamaño de la cadena afecta otras de sus ropiedades. Por ejemplo, mientras que el metanol es venenoso (su ingestión provoca ceguera y hasta la muerte), el etanol está presente en todas las bebidas alcohólicas. Cabe aclarar que no por ello deja de ser tóxico.
POLIMERIZACIÓN POR CONDENSACIÓN
En este tipo de polimerización toman parte dos moléculas con diferentes grupos funcionales. Al reaccionar se desprende una molécula más pequeña, que por lo general es de agua.
Un ejemplo sencillo de una reacción de condensación es la del ácido acético (el ácido del vinagre) con el etanol (véase la fórmula 47).
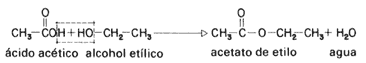
Fórmula 47. En esta reacción de condensación, el agua se forma a partir del -H del ácido y el OH- del alcohol. Los dos fragmentos restantes se reúnen para formar un éster.
El producto de una reacción como ésta (ácido + alcohol) es llamado genéricamente éster. El acetato de etilo es un éster.
Esta reacción, llamada de esterificación, es la base para la fabricación de las fibras poliéster. En este caso se toma una molécula con dos grupos carboxilo (un diácido), como el ácido tereftálico (véase la fórmula 48), y otra molécula con dos grupos funcionales hidroxilo, como el etilenglicol (en los países fríos también se lo utiliza como anticongelante en los motores de automóviles).
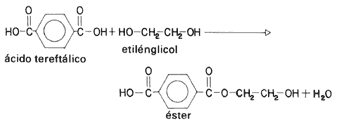
Formula 48. Primer paso de la esterificación de un diácido con un dialcohol.
Inicialmente se produce un éster con un grupo carboxilo libre, por un lado, y un grupo hidroxilo, por el otro (véase la fórmula 48).
Posteriormente, ambos grupos libres pueden seguir reaccionando con otras moléculas. El proceso continúa hasta obtenerse largas cadenas de poliéster; el polietilentereftalato (PET) (véase la fórmula 49).
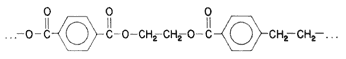
Fórmula 49. En la reacción de la fórmula 48 quedó libre un grupo ácido, HOOC-, y un grupo alcohol, -HO, así que es posible la condensación de más unidades monoméricas hasta producir el polietilentereftalato; la fibra poliéster, un magnifico sustituto del algodón.
El uso más común del polietilentereftalato es la fabricación de fibras textiles y películas transparentes, que se emplean para las cintas de grabadora y para empacar alimentos congelados.
Es altamente probable que usted, amable lector; vista ahora alguna ropa con multitud de macromoléculas de un poliéster. Es más, algunos lectores quedarían completamente desnudos si les pidiéramos que se quitaran todas las prendas con estas fibras.
Recientemente se ha logrado que esta resina alcance un alto grado de cristalinidad, lo que la ha convertido en el termoplástico más rígido. Varias compañías automotrices lo han incluido para reemplazar diversas piezas metálicas.
DE VUELTA A LAS CADENAS PRODUCTIVAS
Este ejemplo de las resinas poliéster nos permite hacer un breve alto para analizar la complejidad del árbol de la petroquímica. El siguiente diagrama muestra la cadena productiva que conduce al polietilentereftalato.
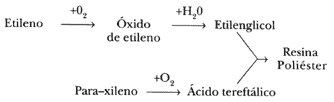
Basta que recordemos que, a su vez, el etileno provino del hidrocarburo de dos carbonos del gas natural (el etano), y el para-xileno fue un producto del tren de aromáticos de la refinería.
Debe quedar claro para el lector que para realizar la producción de fibra poliéster (para ropa, por ejemplo) no debe fallar ninguna de las etapas anteriores. Si por algún error o contingencia se frena un paso de la cadena de producción, la única salida es importar cierta cantidad de un petroquímico intermedio. Desafortunadamente, eso ocurre con cierta frecuencia. En ocasiones sucede por fallas imprevisibles de carácter técnico o de materia prima; en otras, por errores humanos, y en otras más, por deficiente planeación, cuando se retrasan los proyectos de inversión. Es por esto que en México la demanda de algunos productos básicos ha superado la oferta, por lo que ha sido necesario importarlos, cada vez en mayores cantidades.
Otros dos grupos funcionales que suelen adicionarse, con la subsecuente eliminación de agua, son los carboxilos (-COOH) y las aminas (-NH2). El resultado es un compuesto que se conoce con el nombre de amida, caracterizado por el enlace -CONH-. Esta reacción es precisamente la que lleva a cabo nuestro cuerpo para fabricar proteínas, como veremos más adelante.
Si, como se planteó para el caso del poliéster; se hacen reaccionar dos compuestos, uno con dos carboxilos y el otro con dos aminas, se obtiene una poliamida.
La reacción entre el diácido de seis carbonos (ácido adípico) y la amina de seis carbonos (la hexametilediamina) produce una poliamida muy especial, llamada nylon 6,6 (véase la fórmula 50).
El nailon es un sólido opaco, blanco, que se utiliza principalmente para hacer fibras textiles. Fue preparado originalmente el 28 de febrero de 1935 por el químico Carothers, en los laboratorios de la compañía Dupont.
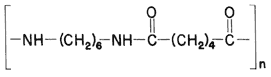
Fórmula 50. Nylon 6,6. La letra n indica que un gran número de las unidades encerradas entre paréntesis se repiten, una tras otra, formando la cadena polimérica.
Durante la segunda Guerra Mundial, cuando Japón cerró el acceso a la seda del Lejano Oriente, el nailon probó ser una fibra superior por muchas de sus propiedades. En ese momento se lo utilizó para elaborar artículos militares, como cuerdas para barcos y paracaídas. Posteriormente, su uso en medias femeninas aumentó enormemente su popularidad.
Aunque parezca cuento, se han producido películas de nailon diez veces más delgadas que el pelo humano. Se usa también en cuerdas para llantas automotrices y en artículos moldeados.
Las fibras de nailon son muy fuertes, mucho más que cualquiera de las fibras naturales. Otra propiedad de las telas de nailon es que se secan fácilmente. Posteriormente, cuando discutamos la estructura de los carbohidratos, como el algodón, veremos que estas moléculas tienen muchos grupos hidroxilo, -OH, los cuales son muy afines al agua. Por ello el algodón es más difícil de secar que el nailon.
Existen polímeros de condensación no formados por átomos de carbono. Así, por ejemplo, dos moléculas de dihidroxisilano reaccionan entre sí para producir una molécula con enlace Si-O-Si. Esta molécula puede reaccionar de nuevo hasta producir una macromolécula de silicón, como se la llama (véase la fórmula 51).
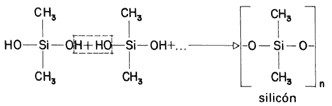
Fórmula 51. El silicón, formidable sellador, es el polímero por condensación del dihidroxisilano.
La primera huella del hombre en la Luna fue hecha con una bota de silicón.
Hay muchos tipos de silicones, que resultan de emplear diferentes monómeros (puede cambiarse el CH3 por otros grupos). Los aceites, las grasas y los hules de silicón son mucho más resistentes al calor y al ataque de los productos químicos que sus equivalentes derivados del carbono. Esto los ha hecho muy útiles en medicina, para fabricar prótesis, y como selladores y aislantes en determinadas industrias. Son también ampliamente utilizados en electrónica para la fabricación de circuitos integrados. En 1940 apenas se produjeron algunas pocas toneladas en el mundo. No obstante, en 1969 fueron 100 000 y hoy se producen más de 400 000 toneladas.
ÁCIDO SULFÚRICO: DIME CUÁNTO PRODUCES Y TE DIRÉ CUANTO VALES
Alrededor de 90% de la producción mundial del azufre se utiliza para preparar ácido sulfúrico, H2 S04
Ya que éste ha sido catalogado como el producto químico industrial más importante de todos, no se puede dejar de mencionarlo en este viaje del tequesquite al ADN.
Como 60% del ácido sulfúrico producido se emplea para preparar fertilizantes y el resto en importantes empresas fabricantes de resinas sintéticas, papel, detergente y biocidas, la producción de ácido sulfúrico de un país es un buen indicador de su desarrollo industrial.
Como, se mencionó, la producción de H2 S04 parte del azufre. Este se obtiene tanto de yacimientos naturales como a partir del sulfuro de hidrógeno, H2S, que acompaña al gas natural. El azufre se quema en presencia de oxígeno y un catalizador, con lo que se obtiene el óxido S03, que con la adición de agua se transforma en ácido sulfúrico.
Los óxidos del azufre también se producen al quemar combustibles que contienen azufre, y son peligrosos contaminantes atmosféricos. Esta es la razón para que se desulfurice la gasolina. La presencia de estos óxidos en el aire da lugar a la llamada lluvia ácida, ya que basta el contacto con el agua para que se formen ácidos, como el sulfúrico.
La lluvia ácida perjudica tanto a las construcciones como a los seres vivos. Se estima que anualmente se lanzan unos 200 millones de toneladas de óxidos de azufre al aire del planeta, lo cual amenaza y destruye cotidianamente diversas especies acuáticas. La ciudad de México se encontraba fuertemente amenazada por este problema. En 1986 se informó que la acidez de la lluvia era diez veces mayor que la esperada para una atmósfera limpia. Afortunadamente, como se indicó en el capítulo II, actualmente se han podido controlar las emisiones de óxidos de azufre a la atmósfera.
Muy pocos de los polímeros que hoy se producen alcanzan su uso final sin una modificación. Para ello se cuenta con una gran variedad de aditivos que alteran de diversa manera sus propiedades. Los más comunes son los colorantes y los pigmentos, pero existen otros, como los agentes espumantes, los plastificantes, los materiales de relleno y los estabilizadores. Comentaremos brevemente algunas de sus características.
Los agentes espumantes son hidrocarburos de bajo punto de ebullición que se agregan al plástico. Con el calentamiento, o por una presión reducida, el hidrocarburo se evapora y produce burbujas en el plástico. El llamado hule espuma de poliuretano y la espuma de poliestireno son preparados de esta manera. Los plásticos espumados tienen menor densidad y son mejores aislantes térmicos.
Los plastificantes son sustancias que les imparten flexibilidad a los polímeros. Actúan como lubricantes internos que separan las cadenas poliméricas. El PVC es quebradizo y se rompe fácilmente, pero con la adición de plastificantes se vuelve suave y flexible. Con PVC modificado se fabrican productos como muñecas, paraguas, accesorios de jardín, tubos protectores de instalaciones eléctricas y asientos de automóviles.
En ocasiones se agregan al plástico materiales de relleno que reducen el costo del producto final y mejoran sus propiedades físicas y mecánicas. Los más utilizados son materiales fibrosos, como el asbesto y la fibra de vidrio. Por ejemplo, los poliésteres reforzados con fibra de vidrio tienen amplio uso para fabricar lavabos, carrocerías de vehículos de mar y tierra, y otros objetos diversos.
Muchos de los plásticos empleados en artículos que están expuestos a la luz solar terminan por perder su resistencia original y se vuelven quebradizos. La razón de ello es que la luz ultravioleta, presente en la radiación solar, es capaz de romper algunos de los enlaces químicos de los polímeros. Para evitarlo se agregan moléculas estabilizadoras que absorben la luz ultravioleta y liberan la energía recibida como calor.
¿CONTAMINACIÓN MACROMOLECULAR?
Gran parte de la producción de plásticos es eliminada en forma de desechos... pero esto es un decir. Uno de los más graves problemas asociados con los plásticos es su indestructibilidad. Todos sabemos de la presencia de bolsas, botellas y otros objetos de plástico en playas, ríos, lagunas y predios. Conservadoramente se estima que en el mundo, cada año, alrededor de 250 000 toneladas de plástico tienen como destino final el medio ambiente, en donde se acumulan como basura. En algunas ciudades, parte de ese plástico se recicla y sirve posteriormente para la producción de bolsas.
Estos objetos plásticos, que están por todas partes, no son biodegradables, al igual que algunos detergentes. Debido al gran tamaño de las moléculas de éstos, los microorganismos bacterianos, responsables de la degradación de muchos de los desechos sólidos, son incapaces de atacar a los plásticos. Por otro lado, su combustión puede desprender gases tóxicos, principalmente ácido cianhídrico (que es, nada menos, el de la cámara de gases) y clorhídrico, de ahí que quemarlos no sea una solución para eliminarlos.
La proliferación de basura plástica puede resolverse, pero hace falta que todos participemos. La manera más sencilla de hacerlo es el reciclaje. Si todos clasificáramos nuestra basura y separáramos los objetos plásticos de los de vidrio, metal y materia orgánica, la reutilización de plásticos, metales y vidrio sería más factible.
Otra salida posible es el uso de aditivos que realicen la función inversa a la de los estabilizadores, es decir, que tiendan a destruir el material. Se ha demostrado que un tipo de aditivos sensibles a la luz induce la ruptura de las cadenas poliméricas después de cierto tiempo de exposición, lo cual facilita su posterior degradación bacteriana. Los compuestos llamados tiocarbamatos (véase la fórmula 52) empiezan a usarse con este propósito. Sus efectos pueden apreciarse claramente en la figura 17.
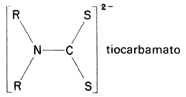
Fórmula 52. Algunos de los aditivos para fotodegradar los plásticos son tiocarbamatos de metales de transición. Aquí se muestra el ion tiocarbamato.

Figura 17. Esta secuencia de fotos muestra la descomposición fotoquímica de un plato de plástico. a) Sin plato. b) El plato se incorpora al jardín. c) En 30 a 90 días el plato se rompe. d) En 60 a 120 días el plato está completamente roto. e) Entre 90 a 150 días sólo quedan fragmentos. f) De seis a doce meses después no hay restos del plato en el jardín. (Tomada de J. W. Hill, Chemistry for Changing Times, Burguess, Minneapolis, 1980).
No obstante los éxitos iniciales de este tipo de aditivos, no han sido incorporados sistemáticamente en las formulaciones de los plásticos, al menos en nuestro país.
Adicionalmente, algunos de los plastificantes más usados, como los bifenilos policlorados, han sido encontrados en los tejidos de vacas, perros y conejos. Sus efectos tóxicos son considerables. Se ha demostrado que dichas sustancias producen mutaciones en animales de laboratorio. Por ello, actualmente algunos de estos plastificantes se han eliminado del mercado.
Al igual que en las demás áreas en las que la contaminación es crítica, en el terreno de los plásticos habrá de desempeñar un papel primordial la creación de una conciencia colectiva. Sin duda, los materiales plásticos han revolucionado al mundo, pero en el futuro su producción deberá acompañarse de soluciones globales, de tal forma que sean más los problemas que resuelvan que los que creen. Sin embargo, para lograr la producción de plásticos con mínimo riesgo ecológico existe una limitante, que es el problema de siempre: el económico. De todas formas, es necesario que tratemos de resolver este problema de la mejor manera posible, con los recursos a nuestro alcance.
De plástico hay hilos y pelotas, mangueras y gabinetes de radio, sillas y peines. Cada objeto merece un procedimiento especial que conduce a su producción. El diseño de los aparatos para moldear los plásticos en esos objetos útiles que están presentes a nuestro alrededor no corresponde al químico, sino al ingeniero.
Por ejemplo, los hilos se producen por la técnica de extrusión, por medio de la cual se bombea el plástico a muy alta presión y se le hace atravesar una criba con delgadísimos agujeros. Por extrusión se fabrican también mangueras y láminas para el recubrimiento de fachadas, paredes o muebles.
Los objetos abiertos se obtienen por inyección del plástico en moldes fabricados ex profeso, mientras que para objetos cerrados (pelotas, por ejemplo) se utiliza la técnica de moldeo por rotación.
Finalmente, se acostumbra producir las botellas plásticas por la técnica de soplado, en la que aire a presión fuerza al plástico a recubrir las paredes interiores de un molde.
Existe una infinidad de máquinas para procesar objetos plásticos, y cada una sigue ciertas reglas para su adecuado funcionamiento y diseño.
Nuestro país cuenta con una importante industria de procesamiento de polímeros, que ocupa a una notablemente alta proporción de mano de obra, en relación con el capital de inversión que requiere. No obstante, durante muchos años se ha manejado con máquinas de importación y con el aprendizaje empírico que le ha dado la misma actividad productiva. Es por ello que las industrias sobre todo las pequeñas, no siempre pueden resolver los problemas que se presentan, por lo que la producción deja de ser óptima y acaba por afectar los costos del producto. Sin duda, es imperativo que los centros educativos ayuden a la industria y combatan esta deficiencia en la formación de profesionales especializados en el campo de los plásticos, su síntesis y procesamiento.
Desde el punto de vista básico, el problema no es nada sencillo. Entender cómo hacer fluir controladamente a un plástico a través de la maquinaria de procesamiento es un muy serio problema de flujo de fluidos. Igualmente, lograr un proceso para obtener un nuevo polímero es otro serio problema de química sintética. No se pueden improvisar profesionales que aborden estos delicados temas.
A pesar de que en México la investigación sobre materiales poliméricos se encuentra en una etapa temprana, ya existen varios grupos importantes, no sólo en el Distrito Federal, sino también en los estados (en Monterrey, Saltillo y Hermosillo), comprometidos con la formación de posgraduados en esta especialidad. En la Universidad de Sonora se hace hincapié en aspectos tanto básicos como aplicados de la ciencia de los polímeros. En el Centro de Investigación en Química Aplicada (CIQA), en Saltillo, la investigación tiene un carácter más práctico e industrial.

Figura 18. Arbusto del guayule. Una de las primeras investigaciones realizadas
en el CIQA consistió en la extracción y el aprovechamiento del
hule del guayule, que es un arbusto que abunda en nuestras zonas áridas.
ASPECTOS DE LA INDUSTRIA DE LOS POLÍMEROS
Es tal la cantidad de objetos de plástico que se fabrican actualmente, que se puede decir que estamos en la era de los plásticos. En países como Alemania y Estados Unidos el consumo volumétrico de materiales plásticos es ya superior al del acero. El cuadro 11 muestra cómo ha evolucionado la producción de plásticos en México y en el resto del mundo. Aquellos con volumen más grande de producción mundial son: polietileno (35%), policloruro de vinilo (21%) y poliestireno (10%).
|
CUADRO 11. Evolución de la producción de plásticos en México y en el mundo. |
||
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Más de 70% de la producción mundial y mexicana de plásticos corresponde a los llamados plásticos de consumo, como el polietileno, el PVC el polipropileno y el poliestireno.
Otros tipos de plásticos, llamados de ingeniería, tienen mayor resistencia al calor y al impacto que los de consumo. A pesar de que constituyen alrededor del 2.5% de la producción mundial, representan, por sus propiedades particulares, aproximadamente 8% del valor total de la producción.
La disponibilidad de estos materiales hizo que su aplicación en mercados especiales, como el electrónico, el aeronáutico y el automotriz, creciera pronunciadamente.
Además de los de ingeniería, existen los plásticos de especialidad, como ciertos polímidas y plásticos biomédicos, que hasta hace poco eran considerados curiosidades de laboratorio. Estos representan cerca de 0.1% de la producción mundial.
Actualmente los países desarrollados están cerrando plantas productoras de plásticos de consumo debido, entre otras cosas, a que hay una gran competencia con los países productores de petróleo. Por esta razón se están enfocando a la producción de plásticos de ingeniería de especialidad, cuyos costos son, respectivamente, de 4 a 100 veces mayores que los de los plásticos de consumo (véase la figura 19).
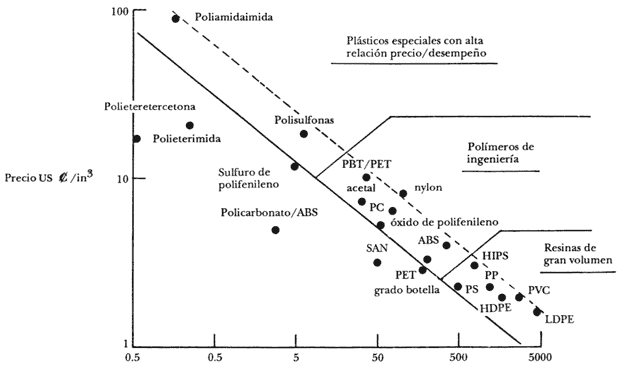
Figura 19. Relación precio/volumen de producción para las resinas de consumo
y de ingeniería. (Fuente: Comisión Petroquímica Mexicana-SEMIP,
Plásticos de ingeniería, México, 1986.)
En el año de 1950, con la producción de poliestireno empezó a funcionar la primera planta polimerizadora del país. Tres años después, tanto en Monterrey como en la ciudad de México iniciaron operaciones dos plantas productoras de PVC. Anteriormente, todo el plástico se importaba, bien como productos terminados o como maquinaria y materias primas.
En la década de los sesenta se inicia la integración vertical, con la producción nacional de moldes y equipo auxiliar, así como de monómeros (PEMEX en 1966 produce polietileno de baja densidad).
En los setenta, la industria de polímeros se expande ampliamente debido al incremento de la demanda nacional, y se exportan algunos productos. Este crecimiento originó fuertes importaciones, tanto de monómeros como de bienes de capital, y así, paradójicamente, el auge del petróleo acarreó un déficit de monómeros.
En 1981, antes de la crisis económica, ya se importaban 315 000 toneladas de petroquímicos básicos, las dos terceras partes del consumo nacional. Hacia 1984, las importaciones de los dos principales básicos (etileno y propileno) sumaron 220 millones de dólares. No obstante, continúa la exportación de PVC, fibra poliéster y algunos productos manufacturados.
En el cuadro 12 se muestra el consumo aproximado de plástico per cápita en algunos países en 1983.
|
CUADRO 12. Consumo per cápita de plásticos (1983), en kg/habitante. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
En nuestro país, alrededor de 32% de la producción está destinada a objetos de embalaje y envase. Otros mercados importantes son la construcción, los electrodomésticos y los juguetes. Menos de 1% está representado por el sector agrícola.
A pesar de su integración desarticulada, la industria de los polímeros le otorga al petróleo, materia prima de prácticamente todos los monómeros, un alto valor agregado. Por ello este sector tiene gran importancia en el desarrollo económico y tecnológico de nuestro país.
EL ENLACE POR PUENTE DE HIDRÓGENO
Antes de ingresar en el mundo de las macromoléculas que forman parte de los organismos vivos, y dada su importancia en estos sistemas, conviene que el lector se familiarice con un tipo de enlace especial, llamado por puente de hidrógeno.
Cada molécula conserva su estructura debido a la fuerza de los enlaces químicos que mantienen unidos a sus átomos. Ahora bien, una molécula de un compuesto puede interaccionar con el resto de las moléculas de la misma sustancia. De la magnitud de esta interacción intermolecular, que es menor que la del enlace químico, dependen muchas propiedades de las sustancias. Estas fuerzas son responsables, por ejemplo, de la existencia de los líquidos y los sólidos. Si no existieran atracciones intermoleculares, toda la materia sería gaseosa.
En ciertos compuestos que contienen hidrógeno, las fuerzas intermoleculares son especialmente fuertes. El agua es el primer caso notable (véase la fórmula 53). Por ello es que el agua es un líquido en las condiciones ambientales normales de la Tierra, lo cual ha hecho posible la aparición de vida en el planeta.
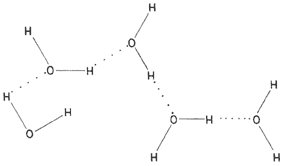
Fórmula 53. En el agua se establece un débil enlace intermolecular entre el oxígeno de una molécula y el hidrógeno de otra. Debido a ello el agua es líquida en condiciones ambientales, y es necesario emplear calor para romper los enlaces de hidrógeno y vaporizarla.
Es muy frecuente la presencia del enlace por puente de hidrógeno, el cual ocurre
entre un hidrógeno (que generalmente presenta una ligera carga positiva) y un
átomo sobre el cual exista una carga negativa neta (generalmente es el oxígeno,
aunque el flúor y el nitrógeno también son buenos ejemplos). Más adelante tendremos
oportunidad de ver varios casos de este tipo de interacción, que es crucial
en multitud de eventos biológicos.
Nuestra piel, las plumas del pavo real, los cuernos de los toros, la seda, las garras de las águilas, la lana, el algodón, el ARN y el ADN, todos los aspectos de la vida misma están sustentados en las macromoléculas naturales. A continuación comentaremos algunos ejemplos específicos de ellas.
Tal vez el dímero más común en nuestras vidas sea la sacarosa, nombre químico del azúcar de mesa. Empecemos con él.
Los polisacáridos son polímeros de los azúcares, sustancias que llevan el nombre químico de carbohidratos. Éstos son compuestos formados por carbono, hidrógeno y oxígeno, los dos últimos en la misma proporción que en el agua, es decir, dos átomos de hidrógeno por cada átomo de oxígeno. Tal vez el carbohidrato más conocido sea la sacarosa, con fórmula C12 H22 O11, pues es el azúcar que utilizamos comúnmente en las comidas.
La sacarosa es un disacárido, o sea, está formada por dos moléculas de carbohidratos (monosacáridos) que se unen por condensación (véase la fórmula 54), con la eliminación de una molécula de agua. Uno de ellos, la glucosa C6 H12 O6, es el carbohidrato más utilizado por nuestro cuerpo como fuente de energía. El otro, la fructosa, un isómero con la misma fórmula, es el responsable del sabor dulce de algunas frutas. Precisamente de ahí toma su nombre.
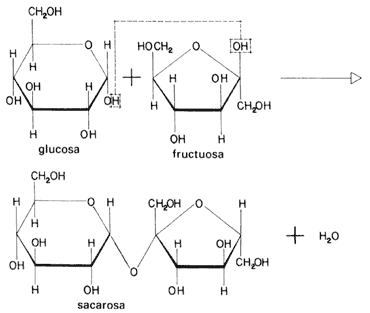
Fórmula 54. La sacarosa, o azúcar común, es disacárido. Para simplificar, no se muestra que en cada vértice de los hexágonos y pentágonos hay un átomo de carbono, excepto en los que aparece el símbolo del oxígeno.
Otros disacáridos ampliamente conocidos son la lactosa, que se encuentra en
la leche, y la maltosa, producto de la cebada.
La celulosa y el almidón son polisacáridos de la glucosa, donde el prefijo poli sí representa una multitud de moléculas de glucosa que se unen por condensación. La celulosa es uno de los principales elementos estructurales de las plantas, y el almidón constituye su reserva energética.
La celulosa es la sustancia orgánica más abundante en la tierra y únicamente algunas bacterias pueden digerirla, como las que se encuentran en el sistema digestivo de las termitas.
Por otra parte, una enorme cantidad de animales digiere el almidón, que es abundante en cereales y tubérculos, como el maíz y las papas.
La mayor diferencia estructural entre la celulosa y el almidón es la manera en que se unen las moléculas de glucosa, a través de uno de sus grupos OH (véase la fórmula 55).
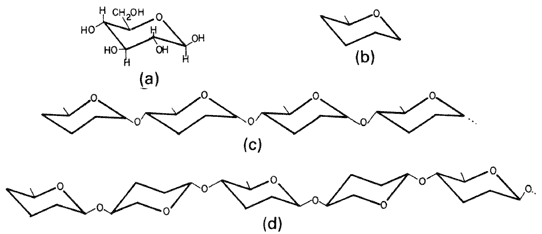
Fórmula 55. a) La glucosa, que corresponde a la primera fórmula hexagonal de la fórmula 54, se muestra aquí en su acomodo espacial real. b) En ocasiones, la fórmula de (a) se simplifica de esta manera. c) Almidón. d) Celulosa. Los dos últimos son polímeros de la glucosa.
Esta diferencia puede parecer mínima, pero el resultado es espectacular.
a) En la celulosa, las moléculas de glucosa están colocadas en línea recta. Los enlaces por puente de hidrógeno entre cadenas vecinas dan lugar a estructuras relativamente rígidas, en las que hay pocas posibilidades de que penetren moléculas de agua. Al ser un polímero lineal, resulta óptima para construir microfibrillas, a partir de las cuales se constituyen todas las estructuras vegetales (del tallo, hojas y raíz).
b) Por el contrario, en el almidón las cadenas adquieren una configuración espiral, que hace al polisacárido menos rígido. Existe un menor número de enlaces por puentes de hidrógeno, así que el agua puede penetrar más fácilmente entre las cadenas. El almidón animal se encuentra en el hígado y los músculos. Se utiliza en las comidas como fuente de energía.
El algodón es la forma más pura de la celulosa. Contiene las fibras más largas, por lo que se emplea para fabricar ropa. Su capacidad de absorber agua se debe a que no todos sus átomos de oxígeno están contenidos en enlaces por puentes de hidrógeno, por lo que algunos de sus grupos -OH pueden interaccionar con moléculas de agua. La celulosa de la madera es de fibra más corta y no se puede utilizar en la industria textil, pero sí para fabricar papel.
Tal como lo conocemos, el papel es un invento chino de hace aproximadamente 2 000 años. Hoy se puede fabricar con un grosor menor que el del cabello humano.
La pulpa de la madera puede emplearse también en la preparación de otros productos, como los siguientes:
- Nitrato de celulosa. Se utiliza en la fabricación de explosivos, lacas y plásticos.
- Acetato de celulosa. Se emplea para hacer las películas de cine y, en forma de fibra, como la materia textil llamada rayón.
- Xantato de celulosa. Es ampliamente conocido con el nombre comercial de celofán. Se usa también para fabricar cuerdas de llantas.
Las proteínas forman parte de todos los seres vivos y, como su nombre lo indica (proviene del griego proteios, que significa primero), son de primordial importancia para todos los organismos, desde un virus hasta una ballena. Participan en multitud de procesos biológicos esenciales, los cuales se resumen en el cuadro 13.
|
CUADRO 13. Función biológica de las proteínas. |
|
|
|
|
|
|
|
|
|
|
| Estructural | Constituyentes de pelo, lana, plumas (protección), músculos, seda, piel. |
| Respiratorio | Transporte y almacenaje de oxígeno. |
| Enzimático | Catálisis biológica. Reacciones de síntesis, oxidación, hidrólisis, etc. |
| Anticuerpos | Defensa del organismo contra el ataque de agentes extraños, como virus y bacterias. |
| Hormonal | Regulación del metabolismo. |
| Nucleoproteica | Transmición hereditaria, síntesis de proteínas para formar tejidos. |
|
|
|
Las proteínas son macromoléculas con pesos moleculares que van de 5 000 a varios millones de uma. La unidad fundamental (monómero) son los aminoácidos. A diferencia de los polisacáridos, en donde únicamente una molécula (la glucosa) se repite gran cantidad de veces, en las proteínas se tiene el agrupamiento de 20 aminoácidos diferentes. Por ello podemos decir que las proteínas son copolímeros. A partir de veinte diferentes monómeros, las posibilidades de construcción de polímeros son enormes, de allí que haya tal variedad de proteínas.
Los veinte aminoácidos naturales tienen en común la presencia de dos grupos funcionales, el grupo amino (-NH2) y el ácido carboxílico (-COOH), colocado éste sobre el mismo carbono que soporta al amino.
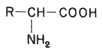
Fórmula 56. Estructura general de un aminoácido.
La fórmula 56 presenta la estructura general de un aminoácido y en el cuadro 14 se encuentran algunos ejemplos de los radicales R.
|
CUADRO 14. Algunos de los veinte aminoácidos naturales. Fórmulas 57 a 66. |
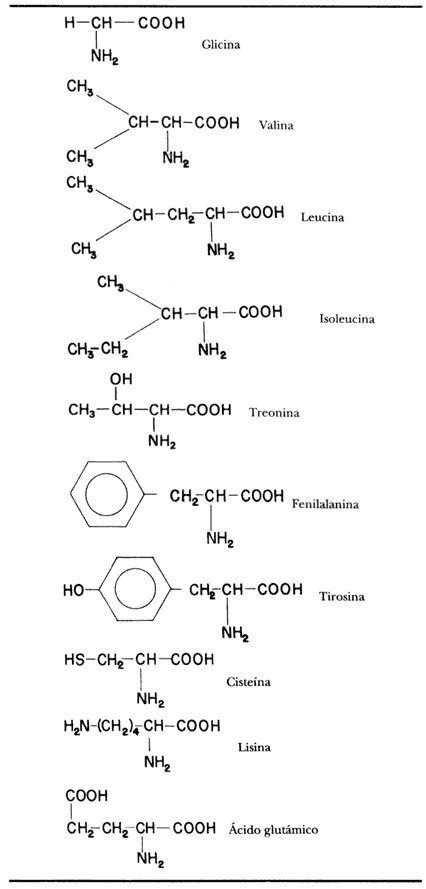
|
El aminoácido más simple es la glicina, en la que el radical R es un átomo de H. Al interactuar con otro aminoácido, como la alanina, con R=CH3, ambas moléculas se condensan, formando un dipéptido a través de la eliminación de una molécula de agua (véase la fórmula 67). El resultado descrito se denomina glicil-alanina.
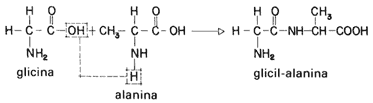
Fórmula 67. Formación de un dipéptido. A partir de los aminoácidos más simples (glicina y alanina) puede formarse un dímero o dipéptido. Como se observa, la glicil-alanina contiene aún un grupo amino y un grupo ácido, por los cuales puede continuar reaccionando con otros aminoácidos para formar un polipéptido mayor.
Sin embargo, pudiera ocurrir que la molécula de agua se eliminara a partir del
-OH de la alanina y el H de la glicina, con lo cual se forma la
alanil-glicina. Así, un par de aminoácidos pueden formar dos dipéptidos.
Fórmula 68. El enlace peptídico es el lazo de unión entre los residuos de los aminoácidos de un polipéptido.
El enlace que se forma entre los dos aminoácidos se conoce como enlace peptídico (véase la fórmula 68). Es el mismo que se presenta en la polimerización del nailon.
La reacción entre dos dipéptidos genera un tetrapéptido. A partir de cuatro aminoácidos diferentes que reaccionen en todas las combinaciones posibles se puede producir un gran total de veinticuatro (4x3x2x1) tetrapéptidos. Si se utilizan 20 aminoácidos diferentes pueden obtenerse 2.43 X 1018 diferentes polipéptidos de veinte unidades, ¡nada menos que casi dos y medio trillones! Como vemos, hay una enorme cantidad de polipéptidos, de los cuales sólo una pequeña fracción constituye las proteínas de los seres vivos.
Desde luego, si pensáramos en combinar cualquier tipo de aminoácidos, y no sólo los 20 naturales, el número de polipéptidos sería impensable. La figura 20 presenta la secuencia de aminoácidos de una de las proteínas más simples.
La estructura de las proteínas es muy complicada, por lo que acostumbra analizarse en tres diferentes niveles.
La estructura primaria corresponde a la diferente secuencia de aminoácidos en la cadena polipeptídica (véase la figura 20).
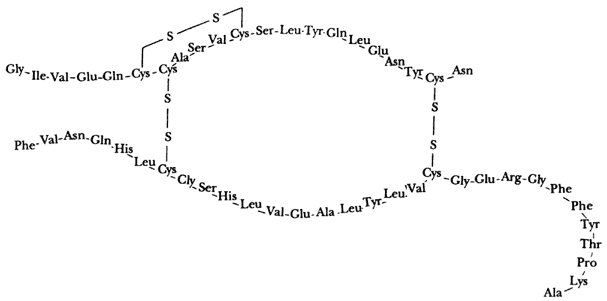
Figura 20. La insulina es una enzima producida por el páncreas que interviene en el metabolismo de los azúcares. Su ausencia causa la diabetes. Consiste de dos cadenas polipeptídicas con 21 y 30 residuos de aminoácidos. Ambas cadenas están enlazadas a través de puentes disolfuro provenientes del azufre de la cisteína. Cada terna de letras en la figura representa una abreviatura del nombre (en inglés) del aminoácido original (Gly=glicina, Val=valina, etcétera).
La estructura secundaria es el resultado de las interacciones entre diferentes porciones de la cadena proteica. En muchos casos tienen lugar a través de enlaces por puente de hidrógeno, lo cual origina que las cadenas adopten forma de hélice (véase la figura 21).
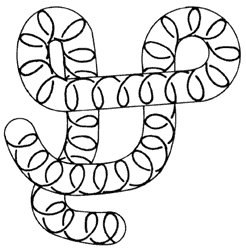
Figura 21. a) Las cadenas de polipéptidos pueden adquirir formas helicoidales. b) Su estructura de hélice se mantiene gracias a la presencia de enlaces de hidrógeno entre dos enlaces peptídicos que se encuentran a diferentes alturas.
El estadounidense Linus Pauling recibió el Premio Nobel de química en 1954 por
sus estudios en la estructura de las proteínas. Años más tarde, su espíritu
pacifista lo llevó también a obtener el Premio Nobel de la paz.
La estructura terciaria de las proteínas es consecuencia de la interacción entre las cadenas helicoidales a través, por ejemplo, de enlaces por azufre o de puentes de hidrógeno. Como resultado de ella, las hélices proteicas pueden adoptar diferentes formas (véase la figura 22).
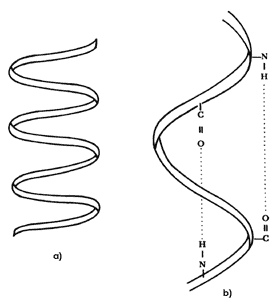
Figura 22. Las hélices de polipéptidos pueden doblarse y enrollarse en formas complejas, lo que dota a las proteínas de estructura terciaria.
Como resultado de esta complejidad estructural, la variedad de funciones que
adoptan las proteínas es muy amplia, como ya mencionamos.
Por ejemplo, el pelo humano y las plumas de las aves están formados de queratina. Esta proteína adopta la forma de una fibra, similar a los cables marinos de siete cabos, que constan de una hélice central y otras seis arrolladas a su alrededor.
Como otro ejemplo estructural, tanto la seda como las telas que tejen las arañas están hechas de fibroma, una proteína con estructura secundaria laminar, en lugar de helicoidal.
Finalmente, la función catalítica que llevan a cabo las enzimas es un ejemplo casi mágico de la importancia de la estructura proteica. Estas proteínas globulares son las responsables de acelerar la multitud de reacciones químicas de un organismo. La manera como lo logran es adoptando un arrollamiento tal que sólo da cabida a que se fije sobre su superficie (y en cierto sitio específico) una determinada molécula, la que debe reaccionar, y no otra (véase la figura 23). Lo que parece como de cuento es que este tipo de moléculas hayan aparecido, y sus medios de acción se hayan perfeccionado a lo largo de los 4 000 millones de años de existencia de condiciones propicias para el surgimiento y evolución de los seres vivos sobre la Tierra.
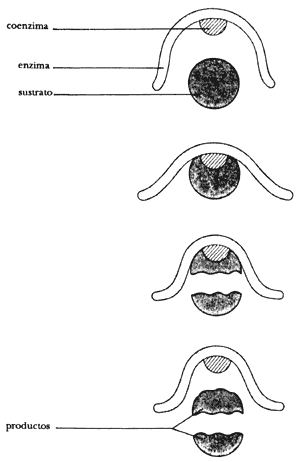
Figura 23. Las enzimas son proteínas que catalizan las reacciones biológicas. Para que sean activas requieren la presencia de una coenzima (como las vitaminas del complejo B). Estas parejas logran llevar a cabo reacciones específicas en los organismos vivos. En la figura se muestra la ruptura de un sustrato cualquiera. Las enzimas se emplean también en multitud de procesos industriales, como la manufactura de alimentos, vino y cerveza, fármacos, detergentes, textiles, cuero y papel.
ÁCIDOS NUCLEICOS O POLINUCLEÓTIDOS
La información genética (color de piel amarillo, pelo negro, ojos cafés, etc.) se encuentra guardada en los genes del núcleo de las células, en una macromolécula llamada ADN (ácido desoxirribonucleico). Esta información es transmitida a las células que fabrican las proteínas a través de otra macromolécula, el ARN (ácido ribonucleico), que es muy semejante al ADN. Estas dos macromoléculas, conocidas como ácidos nucleicos, son las más largas que se han descubierto hasta el momento y tienen masas moleculares superiores a 20 000 millones de uma. Son la parte fundamental de los sistemas de reproducción de todos los seres vivos, desde los virus hasta el homo sapiens. Pero ¿cómo están constituidas?
Tanto en el ADN como en el ARN se encuentran diferentes moléculas cíclicas con varios átomos de nitrógeno. Por sus propiedades básicas son conocidas como bases púricas (aquellas derivadas de la purina) y bases pirimídicas (derivadas de la pirimidina). La fórmula 69 presenta las cinco bases de los ácidos nucleicos.
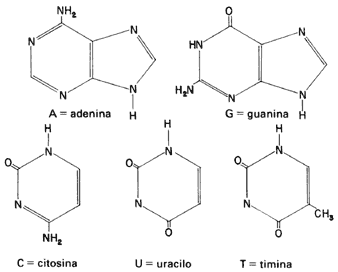
Fórmula 69. Fórmulas de las dos bases púricas y de las tres bases pirimídicas que forman parte de los ácidos nucleicos.
El ADN contiene cuatro de estas moléculas, y difiere del ARN en que la timina
reemplaza al uracilo. Así, si damos la siguiente nomenclatura: A= ademina,
G= guanina, C= citosina, U= uracilo, y T= timina,
entonces los dos ácidos nucleicos contienen las siguientes bases:
Los nucleósidos consisten en la unión de una base púrica o pirimídica a una molécula de azúcar (sacárido). Los azúcares que se presentan contienen sólo cinco átomos de carbono y no seis, como en el caso de la glucosa y la fructosa. La ribosa (en el ARN) o la desoxirribosa (en el ADN) son los dos azúcares presentes en los ácidos nucleicos (véase la fórmula 70). La única diferencia entre estas dos moléculas es la presencia de un grupo OH adicional en la ribosa. Este simple cambio tiene, sin embargo, un profundo efecto en las funciones biológicas de la macromolécula.
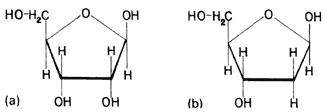
Fórmula 70. La ribosa (a) y la desoxirribosa (b). Cuando estos azúcares se enlazan químicamente a las bases de la fórmula 69, se forman agregados que reciben el nombre de nucleósidos.
Se llama nucleótido al resultado de la unión de un nucleósido con un grupo fosfato (H2 PO-4). Es decir; están formados por una base (púrica o pirimídica), un azúcar (ribosa o desoxirribosa) y fosfato (véase la fórmula 71).
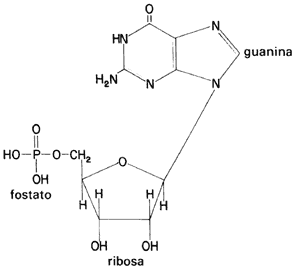
Fórmula 71. Estructura de un nucleótido con guanina como base y ribosa como azúcar.
ÁCIDOS NUCLEICOS O POLINUCLEÓTIDOS
Un nucleótido se une a otro por una reacción de condensación, formando polinucleótidos.
El ADN y el ARN son polinucleótidos en donde los fosfatos actúan como puentes de unión de diferentes nucleótidos. Con ello se forman larguísimas cadenas. La columna vertebral de la cadena está constituida por el grupo fosfato y el azúcar. Las bases pueden considerarse como ramificaciones. Como en el caso de las proteínas, la estructura primaria de estas macromoléculas se encuentra definida por la secuencia de los nucleótidos, la que, a su vez, depende de la base ligada al azúcar (véase la fórmula 72).
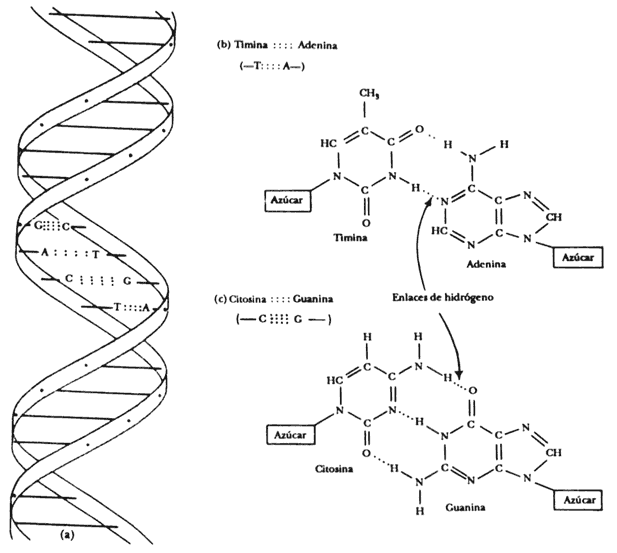
Figura 24. a) La doble hélice del ADN consiste en dos polinucleótidos enlazados a través de puentes de hidrógeno entre bases de cada cadena. b) Una timina de un lado se une con una adenina del otro. c) Una citosina con una guanina.
La ya famosa doble hélice corresponde a la estructura secundaria de los polinucleótidos. La forma helicoidal se adquiere gracias a la existencia de enlaces por puente de hidrógeno entre las bases de dos diferentes cadenas. Aquí se encuentra el secreto de la vida (véase la figura 24).
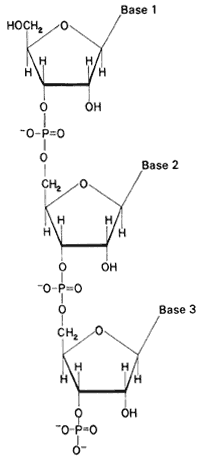
Fórmula 72. Segmento de polinucleótido. El orden en que se arreglan las bases a lo largo de la cadena es la clave de la información hereditaria de un individuo. En estas cadenas radica la química de la herencia.
J. Watson, F. Crick y M. Wilkins ganaron el Premio Nobel en 1962 por la elucidación de la estructura secundaria del ADN.
El orden en que están acomodadas las diferentes bases púricas y pirimídicas a lo largo de la hélice determina el mandato genético para producir, por ejemplo, una hormona humana o una célula sexual de una mosca.
Fue en 1973 cuando, por primera vez, los bioquímicos lograron separar pedazos de genes de ciertas especies animales e introducirlos en otra especie. Es decir; hoy es perfectamente factible tomar un pedazo de ADN humano (el responsable de producir la insulina, por ejemplo) y pegarlo a un plásmido que se introduce a una bacteria. El resultado sorprendente es una colonia bacteriana que produce insulina humana. Con ello puede atenderse la necesidad de los enfermos de diabetes, que no pueden producir esta hormona pancreática.
Esta manipulación bioquímica ha generado una nueva rama de la ciencia, que se conoce como tecnología del ADN recombinante (rADN) o ingeniería genética. Y no es que el bioquímico pretenda tomar el lugar del ingeniero, sino que ahora él está en posibilidad de diseñar un nuevo tipo de estructuras: ¡las de los seres vivos!
No queremos terminar este libro sin mencionar y dar reconocimiento a un destacado científico mexicano: Francisco Bolívar Zapata. Fue el primero en describir; en 1977, un procedimiento para unir eficientemente moléculas de ADN y luego estabilizarlas en células bacterianas. Su artículo ha servido de base para más de 6 000 trabajos en la bibliografía mundial, lo cual constituye el récord para un científico latinoamericano. Bolívar estudió la carrera de química y luego la maestría en bioquímica en México. Fundó el Centro de Investigación en Ingeniería Genética y Biotecnología (hoy Instituto de Biotecnología de la Universidad Nacional Autónoma de México) en Cuernavaca, Morelos. Por sus contribuciones recibió a fines de 1991 el Premio Príncipe de Asturias y en 1992 el Premio Nacional de Ciencias y Artes.
Ha terminado el camino del tequesquite al ADN. La trayectoria tomada puede haber parecido caótica y desarticulada, pero su elección ha pretendido mostrar algunos frutos de la ciencia central.
Esperamos que el lector haya podido apreciar la aportación de la química a algunos aspectos de nuestra sociedad moderna. No le debe caber duda alguna de que la ciencia ha actuado en los últimos 300 años como un enorme elemento transformador de nuestro modo de vida. Si tomamos la debida precaución en los efectos ecológicos de estas transformaciones y las guiamos con un estricto sentido ético, la ciencia nos proporcionará muchos beneficios y muy pocos dolores de cabeza.
Chow, S., Petroquímica y sociedad, colección La Ciencia desde México, Fondo de Cultura Económica, México, 1987.
Comisión Petroquímica Mexicana, Plásticos de ingeniería, SEMIP, México, 1988.
Eguiluz, "Diagnóstico de la industria de los polímeros en México", en Memorias del Segundo simposio nacional de polímeros, Urea, México, 1986.
Jones, M. M., J. T. Netterville, D. O. Johnson, y J. L. Wood, The World of Chemistry, caps. 15 y 16, Saunders, Filadelfia, 1992.
Hughes, T., Chemistry: Ideas to Interpret Your Changing Environment, caps. 9 y 10, Dickenson, Encino, 1975.
Mark, H. F., Móleculas gigantes, Colección Científica, Time Life, México, 1972.
Paladini, A. C. y M. Burachik, Macromoléculas. Monografías de química, núm. 3, OEA, Washington, 1968.
Ureta Barrón, E., Polímeros, ANUIES, México, 1975.