II. LOS RELOJES GEOLÓGICOS RADIACTIVOS
A PESAR de que la radiactividad fue descubierta en 1896, su mecanismo no se entendió sino hasta después de haberse formulado la mecánica cuántica, muchos años más tarde. Esta teoría permitió comprender la estructura atómica de la materia y los cambios que sufre. En nuestro paseo por esta área de estudio consideremos en primer lugar la estructura atómica de la materia.
La materia del Universo está compuesta de átomos. Existen en la naturaleza unos 390 tipos de átomos diferentes y otros 1400 pueden producirse artificialmente. Las combinaciones entre estos átomos forman las moléculas de que está compuesto todo el Universo. Los átomos, a su vez, están compuestos por partículas más pequeñas llamadas partículas elementales. Las variaciones entre los átomos que constituyen los diferentes elementos se deben a la diferencia en el número de partículas elementales o subatómicas que los componen. Una manera de visualizar la relación entre el tipo de átomo y sus componentes subatómicos procede del modelo atómico propuesto por Rutherford a principios de siglo. Éste consiste en imaginar al átomo como un pequeño sistema solar en cuyo centro se encuentra un núcleo compuesto de partículas cargadas positivamente, llamadas protones, y otras sin carga, llamadas neutrones. A su alrededor, como los planetas alrededor del Sol, giran otras partículas cargadas negativamente, llamadas electrones. En el caso atómico, varios electrones pueden girar en la misma órbita.
La diferencia entre los átomos de los distintos elementos estriba en el número de protones que poseen. Así, el hidrógeno posee uno, el helio dos, el litio tres, etc. Al número de protones en el núcleo de los átomos de un elemento se le llama número atómico (Z). Los átomos de un mismo elemento poseen el mismo número atómico; sin embargo pueden poseer un número diferente de neutrones o número neutrónico (N). Los átomos de un mismo elemento pero con diferente número neutrónico son llamados isótopos y poseen las mismas propiedades químicas pero masas diferentes. A la suma del número de protones y el número de neutrones se le llama número de masa (A):
Para designar los elementos se utiliza un símbolo al que suele añadirse en su parte superior el número de masa y en la inferior el número atómico. Por ejemplo, C es el carbono con 7 neutrones, C es el carbono con 6 neutrones. En general, como el número atómico es fijo para un elemento dado, escribir tanto su símbolo como su número atómico es redundante, pero permite saber de un vistazo cuántos protones posee aquel elemento y por substracción con el número de masa, su número neutrónico. De cualquier manera, es usual hablar solamente de carbono 13 o carbono 14, etc. Todos los elementos poseen varios isótopos pero entre éstos, algunos son estables, mientras que otros son inestables, es decir, decaen naturalmente o exhiben radiactividad natural. ¿Qué quiere decir que decaen? Como hemos visto, los átomos se diferencian entre sí por el número de protones en su núcleo, de manera que de un núcleo con número atómico A pueden derivarse núcleos de número atómico menor, siempre y cuando la carga total quede sin cambio. En la naturaleza existen átomos que dividen su núcleo espontáneamente para lograr estabilidad interna. Como en el núcleo atómico pueden existir varios protones y éstos tienen la misma carga eléctrica (positiva), tienden a rechazarse, y lo harían de no ser porque existen también fuerzas nucleares que los mantienen unidos. No entraremos en detalle sobre estas fuerzas que desgraciadamente no tienen un paralelo obvio con nuestra experiencia directa. Sin embargo, son reales y sin ellas no podría mantenerse el núcleo unido. Para algunos números de masa muy grandes o ciertas razones de N a Z estas fuerzas equilibran a las eléctricas de una manera poco estable y el núcleo termina por efectuar cambios que alteran el número A o el cociente N/Z hasta lograr estabilidad. Para lograr esto el núcleo atómico puede proceder de varias maneras según el valor de A, Z y N, pero con la sabiduría propia de la naturaleza, el proceso que seguirá será el óptimo en economía de energía y de pasos y, por lo tanto, será el mismo para el mismo tipo de núcleos.
Existen tres maneras en que el núcleo realice su cometido; las mencionaremos aquí sin entrar en las particularidades de cómo se llevan a cabo, ya que no son indispensables para entender la forma en que se utiliza este proceso para medir el tiempo geológico.
Estos tres mecanismos de decaimiento son los siguientes:
a) Decaimiento alfa (a). En este mecanismo, el núcleo emite una partícula alfa (que fue como se bautizó originalmente al núcleo del helio encontrado en la radiactividad natural), que consta de dos protones. Es decir, el núcleo se desembaraza de dos protones unidos y, si nos fijamos en la tabla de los elementos, veremos que el helio tiene un núcleo con dos protones. ¿Por qué dos protones unidos y no un protón o dos separados? Porque la energía requerida para emitirlo es menor que en los otros dos casos.
b) Decaimiento beta (b). Esta forma de decaimiento es bastante curiosa. En el decaimiento beta un neutrón se transforma en un protón por emisión de un electrón (para que la carga neutra del neutrón original se conserve, pues la carga negativa del electrón equilibra la positiva del protón). En una variante, un protón se transforma en un neutrón mediante la emisión de una partícula de carga positiva llamada positrón. Estas partículas, ejemplo de "antimateria", tienen vida muy corta, pues en un universo poblado por electrones muy pronto interaccionan con alguno de éstos y se aniquilan produciendo radiación electromagnética que se designa históricamente como radiación gamma. Una última forma de decaimiento beta es la llamada captura electrónica. En algunos átomos de núcleo muy pesado los electrones con las órbitas de radio más pequeño están muy cerca del núcleo, de tal manera que este último captura un electrón y transforma uno de sus protones en un neutrón, logrando de esta manera una transformación estable.
c) Decaimiento gamma (g). Esta forma de decaimiento no cambia ninguno de los números N y Z sino que ocurre cuando el núcleo se encuentra "excitado" o con un exceso de energía. El núcleo se libera del exceso emitiendo energía electromagnética en paquetes llamados "fotones". Este tipo de decaimiento no lleva a la generación de otros tipos de elementos y ocurre frecuentemente como un paso intermedio.
Existen unos 1 700 núcleos diferentes en su número de masa; de éstos, sólo 260 son estables. Si se examina una tabla de elementos puede observarse que sólo son estables aquellos núcleos con número de masa menor a 83 y con números atómicos y neutrónicos muy parecidos. Es interesante también observar que la gran mayoría de los isótopos estables tienen un número par al menos para uno de los números Z y N, y más del 50 % tienen un número par en ambos casos (Cuadro1).
UADRO 1. Número total de núcleos estables catalogados por las características
de sus números nucleares
|
|||
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|||
FUENTE: Holden
y Walker, 1972. |
|||
Vemos así que los núcleos atómicos cambian sus números nucleares por medio de la radiactividad natural para lograr estos tipos de configuraciones. Muchos de los núcleos radiactivos (o radionúcleos) no existen en la naturaleza porque sus vidas medias son muy cortas. Es decir, existen ciertos "grados de inestabilidad" y algunos núcleos cambian su estructura muy rápidamente mientras que otros lo hacen de manera muy lenta. La forma en que decaen los diferentes radionúcleos de un mismo elemento está gobernada por leyes probabilísticas. Esto quiere decir que si tenemos dos radionúcleos de un mismo elemento no decaen ambos al mismo tiempo. Una analogía nos la dan las palomitas o rosetas de maíz cuando son puestas al fuego. Todos los granos individuales están a la misma temperatura pero cada uno revienta a diferentes tiempos. Podemos describir el proceso haciendo una lista del número de palomitas presentes en diferentes lapsos de tiempo. De la misma forma, para un número Nx de radionúcleos X podemos medir el tiempo transcurrido para que la mitad de los núcleos Nx decaigan en otros elementos. A este tiempo se le llama vida media y lo denotaremos como Tm (Figura 1).
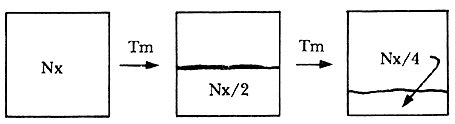
Figura 1. Esquema de decaimiento de un elemento radiactivo. Nx es el número inicial de radionúcleos, Tm es la vida media.
Para un mismo tipo de radionúcleos la vida media es una constante que no depende ni de la temperatura ni de la presión a que se encuentren los núcleos en cuestión.
Una constante que se suele utilizar frecuentemente en estudios de radiactividad es la llamada constante de decaimiento lambda (l). Esta constante nos dice qué tan rápidamente decae un número Nx de núcleos y por lo tanto está relacionada con la vida media. La relación es la siguiente:
Para entender esta constante, regresemos al ejemplo de las palomitas de maíz. Al principio de nuestro experimento, que llamaremos tiempo cero, tenemos por ejemplo 100 granos de maíz, luego de algunos minutos tendremos 10 palomitas y 90 granos, luego 30 palomitas y 70 granos y así sucesivamente. Podemos graficar el número de granos que hay en cada momento y tendremos algo parecido a la gráfica de la figura 2.
En el caso de los radionúcleos la gráfica que obtendríamos sería una curva que desciende regularmente (Figura 3).
En esta gráfica podemos ver que para diferentes radionúcleos existen diferentes cantidades sin decaer en un tiempo dado cualquiera. En las diferentes curvas la rapidez con que decaen está dada por las diferentes lambdas. Así, en la figura se tiene que l1>l2:

Figura 2. El cambio de granos de maíz en palomitas o rosetas es una analogía del decaimiento radiactivo. La gráfica muestra el número de granos que no han estallado y por substracción, los que ya han "decaído" a un producto diferente.
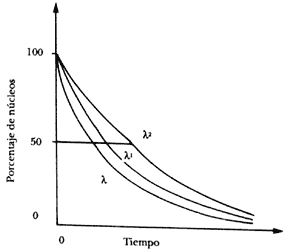
Figura 3. Gráfica de decaimiento de tres elementos radiactivos cuyas constantes de decaimiento son diferentes.
Este tipo de gráficas puede describirse por medio de la ecuación:
en donde No es el número inicial de átomos, t es el tiempo y e representa el número 2.718, base de los logaritmos naturales.
En esta fórmula, si queremos obtener el tiempo en que el número de átomos es la mitad del original, sólo tenemos que poner N = No/2, y así tendremos
Si sacamos logaritmo en ambos lados tendremos
o sea
Pero el logaritmo natural de 2 es 0.693, de manera que
que es la expresión para la vida media que teníamos originalmente.
Algunos núcleos decaen a otros (productos hijos) que son radiactivos, los cuales a su vez decaen en otros que son radiactivos y así sucesivamente hasta un producto estable. Se establece así una cadena conocida como serie de decaimiento o serie radiactiva. En estos casos las constantes de decaimiento para cada eslabón de la cadena son usualmente diferentes pero puede determinarse una constante para toda la serie. La figura 4 (a) muestra el proceso esquemáticamente.
Una analogía de una serie radiactiva la constituye el agua que se derrama de una serie de recipientes con orificios en sus bases (Figura 4b). En este caso el análogo de la constante de decaimiento lo constituye el diámetro del orificio, puesto que entre más grande sea éste más rápido se vacía el recipiente.
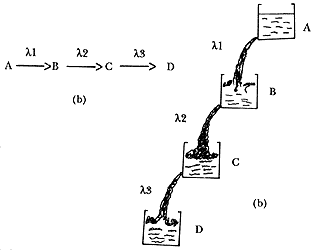
Figura 4. Analogía de una serie radiactiva. El tamaño de los orificios por los que escapa el agua es análogo de la constante de decaimiento. El equilibrio se alcanza si cada orificio es sucesivamente mayor de arriba hacia abajo.
De lo que hemos descrito hasta ahora podemos ver que, dado que se ha encontrado que las constantes de decaimiento son prácticamente constantes, podemos utilizar el decaimiento nuclear para medir el tiempo transcurrido desde que se tuvo una cierta cantidad inicial de núcleos padres. Para aplicar este principio a la determinación de edades de rocas y de la Tierra misma son necesarias varias cosas:
1) Debemos poder medir las concentraciones tanto del producto padre como del producto hijo final.
2) Las constantes de decaimiento requeridas deben ser conocidas.
3) El elemento que se utiliza como base del reloj radiactivo debe ser un radionúcleo natural.
4) El elemento que se utiliza como base del reloj debe existir con abundancia suficiente en las rocas y producir productos finales en la cantidad suficiente para poder ser medidos.
5) Asimismo, dicho elemento debe tener una vida media lo suficientemente larga de acuerdo con los lapsos de tiempo que se intente medir, para que sea posible encontrar cantidades tanto de padre como de hijo que puedan ser determinadas.
6) Si el decaimiento se produce a través de una serie radiactiva, las constantes de decaimiento deberán ser sucesivamente mayores, puesto que de otra manera tendríamos acumulaciones anómalas en los productos intermedios.
Veremos ahora estos requisitos con algún detalle:
En primer lugar, la determinación de las concentraciones de los elementos en rocas y minerales debe ser muy exacta si se han de emplear para la determinación de edades. Esto no puede conseguirse por métodos químicos porque su resolución no es lo suficientemente alta para estos propósitos. Afortunadamente, ya desde 1918 y 1919 dos investigadores, F. W. Aston en Inglaterra y A. J. Dempster en los Estados Unidos habían construido espectrógrafos de masas, aparatos que permiten la determinación de cantidades muy pequeñas de elementos y substancias. Este instrumento es esencial para las determinaciones del tiempo geológico.
¿Qué es y cómo funciona este aparato? El espectrógrafo de masas se basa en el siguiente principio: Toda partícula cargada que se mueve a través de un campo magnético sufre una fuerza perpendicular a ambos, al campo magnético y al vector de velocidad. La figura 5 ilustra este efecto:
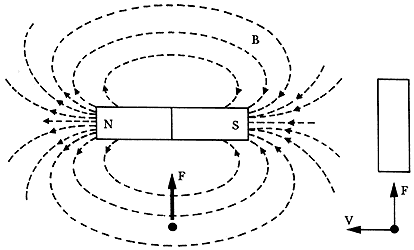
Figura 5. Una partícula cargada sufre una fuerza si se desplaza en presencia de un campo magnético. En la figura, una carga positiva q se mueve saliendo del plano del papel. La fuerza de Lorentz la desviará hacia arriba.
En esta figura se representa una partícula de carga q que viaja en una dirección perpendicular al plano del papel, saliendo de éste, y atraviesa las líneas de campo magnético (B) que genera el imán. La partícula sufre una fuerza F que tiende a desviarla.
Esta fuerza, llamada Fuerza de Lorentz, hace que en la presencia de un campo magnético la partícula siga una trayectoria curva, como se muestra en la figura 6.
En esta figura, el radio de curvatura depende de la masa y la carga de la partícula. Mientras mayor sea la masa, mayor es el radio de curvatura y mientras mayor es la carga menor es el radio. Ahora bien, dado un núcleo, su masa y su carga están determinadas por el número de protones y neutrones que lo constituyen, de manera que existe un cociente carga/masa (q/m) que caracteriza al núcleo en cuestión. Una vez fijo el campo magnético, núcleos de diferente cociente q/m incidirán sobre la placa detectora en diferentes puntos. Si la placa es de tipo fotográfico se formará una línea cuya intensidad dependerá del número de núcleos que haya incidido en esa región específica de la placa. En muchos de estos instrumentos la detección se hace electrónicamente, en cuyo caso el instrumento se llama espectrómetro de masas. En los instrumentos más modernos se pueden establecer abundancias del orden de partes por millón.
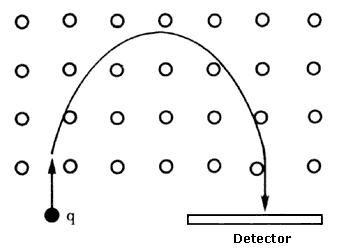
Figura 6. En el espectómetro de masas las partículas cargadas (ionizadas) inciden en un área en la que existe un campo magnético que las desvía hacia el área de detectores. El radio de curvatura depende del cociente entre carga y masa de cada partícula.
En cuanto a la determinación de las constantes de decaimiento o bien de las vidas medias, para núcleos de decaimiento rápido, éstas pueden ser medidas en el laboratorio con bastante exactitud, pero para núcleos que decaen más lentamente los valores deben ser obtenidos por métodos indirectos que ofrecen menos exactitud y por esto son verificados sistemáticamente. En geología, para medir tiempos del orden de la edad de la Tierra o de la formación de ciertas rocas se requieren vidas medias del orden de 108 a 1010 años. Edades más recientes, del orden de 50 000 años, pueden ser determinadas por medio del carbono 14, que tiene una vida media de 5 730 años.
Ahora bien, para la determinación de tiempos geológicos es necesario que el isótopo que se utilice exista naturalmente en las rocas o minerales cuya edad se intenta determinar. Existen muchos radionúcleos artificiales que han sido producidos en las explosiones nucleares recientes. Deben además ser de vida media lo suficientemente larga para no haber decaído desde su síntesis y encontrarse en cantidad suficiente en las rocas para poder determinarse con los métodos instrumentales actuales. Los productos hijos deben también encontrarse en cantidades que puedan medirse, pero su abundancia debe ser mucho mayor que la abundancia no radiogénica de esos mismos isótopos; de otra manera pueden contaminarse fácilmente. Un ejemplo de esto lo constituye el decaimiento de potasio-40 (K-40). Este elemento decae en dos productos estables: el calcio-40 (Ca-40) y el argón-40 (Ar-40). Ahora bien, el calcio es muy abundante en las rocas, de manera que distinguir entre las diminutas cantidades de Ca-40 de origen radiogénico (es decir, que proviene del decaimiento radiactivo) y el muy abundante Ca-40 de origen no radiactivo es muy difícil. Por el contrario, el Ar-40 es muy raro en las rocas y prácticamente todo el que se encuentra en ellas es de origen radiogénico. En consecuencia, el reloj de potasio-calcio no se emplea con frecuencia pero el de potasio-argón es muy utilizado.
Por lo que se refiere al uso de las series radiactivas, es necesario que en cada paso de estas series se estén desintegrando núcleos con la misma proporción o, como suelen decir los geocronólogos, que la serie esté en "equilibrio secular". Esto quiere decir que, en la analogía de los recipientes con agua de la figura 4, el diámetro de cada recipiente debe ser consecutivamente mayor o al menos igual al anterior, pues de otra forma en el recipiente en que el orificio es menor se comenzaría a acumular el agua sin que pudiéramos establecer una relación de tiempo por las cantidades de fluido presentes entre el primer y el último recipientes.
Los requisitos que hemos mencionado son satisfechos solamente por unos pocos radionúcleos. Los siguientes son los más importantes en geocronología:
| Potasio-40 (K-40) | Torio-232 (Th-232) |
| Rubidio-87 (Rb-87) | Uranio-235 (U-235) |
| Renio-187 (Re-187) | Uranio-238 (U-238) |
Estos isótopos se encuentran en las rocas de manera natural. Algunos isótopos radiactivos de amplia utilización en geología y arqueología como los del C-14 no se encuentran sino en aquellas rocas que tienen componentes orgánicas, pues el C-14 se produce en la atmósfera al incidir neutrones de la radiación cósmica con el nitrógeno presente en aquélla. El C-14 así producido es incorporado a la estructura de la materia orgánica por los procesos vitales (respiración, fotosíntesis, etc.) y permite de esta manera calcular la edad de estos sistemas por comparación con el C-14 presente en la materia orgánica actual. Desde la aparición de la civilización industrial y las pruebas nucleares, el contenido isotópico de gases en la atmósfera ha variado, de manera que los datos son corregidos por estos efectos. Sin embargo, dicha técnica no proporciona información para el estudio de la edad de la Tierra, de manera que no nos referiremos a ella en lo sucesivo.