VI. CONDICIONES DE PROTECCIÓN CATÓDICA. CRITERIOS DE POTENCIAL Y REQUERIMIENTOS DE CORRIENTE
CRITERIO PARA LA ELECCIÓN DEL POTENCIAL DE PROTECCIÓN
EL CRITERIO de potencial se refiere exclusivamente a la aplicación de la protección catódica para eliminar o reducir, dentro de límites aceptables, la corrosión generalizada de una determinada estructura. Hay que resaltar que no se considera aquí la forma de prevenir los casos de corrosión localizada, para los cuales el potencial de protección se elige o selecciona con criterios diferentes a los que se señalan en esta parte. De aquí que la validez del criterio de potencial queda restringida a los casos de corrosión generalizada.
Criterio basado en consideraciones termodinámicas
Desde un punto de vista termodinámico se podría escoger el valor del potencial de equilibrio de la reacción de corrosión como potencial de protección, en cuanto que limita de una manera superior el intervalo de potencial en el cual el metal no puede corroerse (está en condiciones de inmunidad termodinámica). De hecho este criterio no es utilizado por dos motivos principales:
a) En primer lugar, si se toma el potencial de protección como potencial de equilibrio de la reacción de disolución del metal, esto implica necesariamente conocer la composición química de la solución en contacto con la superficie metálica bajo las condiciones de protección catódica. Dicha composición química es variable y depende de las condiciones ambientales, estado de la superficie, etc., por lo que es muy difícil precisarla.
b) En segundo lugar, al menos en el caso en que el ambiente no contenga prácticamente iones del metal que se corroe, o que su contenido sea muy bajo (lo que es un caso normal en la práctica de la protección catódica de estructuras metálicas enterradas en el suelo o sumergidas en agua de mar), el potencial de equilibrio toma valores muy negativos y tiende a -µ infinito en concentraciones cercanas al valor cero.
Recuérdese que la relación entre el potencial de equilibrio de un metal que
se corroe y la concentración de sus iones está fijada por la ley de Nernst
Para la reacción de disolución del acero (hierro):
En la ecuación de Nernst, sustituyendo E° = - 0.44 V y n = 2, se tiene
que:
El profesor Marcel Pourbaix ha abordado el problema del potencial de protección, y le ha dado una solución basada en consideraciones termodinámicas. Ha propuesto considerar "inmune" a la corrosión a un metal que se encuentre a potenciales más negativos que el que correspondería al valor de su potencial de equilibrio en una solución que contuviera sus iones a una concentración l0- 6 moles/litro.
Así, aplicando la ecuación de Nernst, se tendría, para [Fe2+] = l0 -6:
Eprotección = -0.44 + 0.059/2 log 10 -6 = -0.62 V
El potencial de protección resulta ser entonces de -0.62 V respecto al electrodo de referencia de hidrógeno. En la figura 10 se presentó el correspondiente diagrama potencial pH (diagrama de Pourbaix) para el sistema Fe-agua, en el cual se delimita la zona de inmunidad y corrosión con el valor del potencial calculado en este apartado.
En los términos propuestos por Pourbaix, aplicando una corriente se impone al metal que se quiere proteger el potencial que corresponda a una concentración mínima de iones metálicos en la solución. La concentración límite adoptada es de l0 -6 moles/litro.
Por convención, habrá corrosión si la concentración de los iones metálicos en el electrolito es igual o mayor que l0 -6 moles/litro.
Esto permite calcular, basándose en la ecuación de Nernst, el potencial de
protección, el cual, sin embargo, es función del pH del electrolito. La información
puede obtenerse del correspondiente diagrama potencial -pH del metal en cuestión
(Cuadro 18).
CUADRO 18. Potencial de protección* a diferentes pH de algunos metales,
obtenido a partir de los correspondientes diagramas de potencial -pH a 25°C

En general, para la definición del potencial de protección no se utilizan criterios que supongan la condición de "inmunidad" del material, sino otros en los cuales se puede decir que está "cuasi inmune", y que correspondería a una velocidad de corrosión suficientemente pequeña y por tanto aceptable en la práctica.
El potencial de protección podría definirse entonces como aquel al cual la velocidad de corrosión debe mantenerse lo suficientemente baja, esto es, menor a un límite fijado.
Por ejemplo, si se pone como límite para el acero en solución acuosa una velocidad de corrosión de 12 micras/año (um/año), el potencial de protección a 25 y 50°C resulta ser, respectivamente, de -750 y -850 mV, contra Cu/CuSO4 (saturada).
Experimentalmente, la determinación del potencial de protección puede realizarse encontrando las características de polarización. catódica, potencial/logaritmo de la densidad de corriente, con lo que se determina el valor del potencial en el cual se inicia el comportamiento lineal (de Tafel) de las características catódicas. Este valor del potencial, de hecho, señala cuándo la velocidad del proceso de corrosión es despreciable.
Como un ejemplo, veamos el caso esquematizado en la figura 22, relativo al acero en una solución acuosa aereada (agua de mar, por ejemplo). Se intuye rápidamente que no es adecuado para efectuar la protección que se alcance un potencial como E 4, el cual corresponde a una elevada corriente que lleva a una protección completa, pero que produce un importante desprendimiento de hidrógeno. En este caso parece más indicado trabajar en el intervalo comprendido entre E1 y E2, en el cual se está en unas condiciones tales que no se disminuye sensiblemente el efecto de protección (como sucede para potenciales tipo E3 o superiores) y que al mismo tiempo mantiene la corriente catódica en valores pequeños y que por tanto resulta despreciable el desprendimiento de hidrógeno.
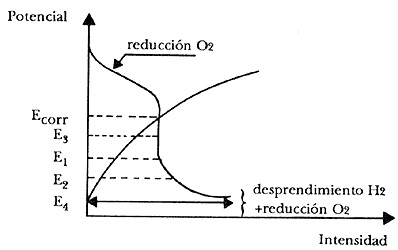
Figura 22. Diagrama potencial-intensidad de corriente en un sistema
de corrosión en condiciones de control catódico por difusión de O2
En otros casos puede resultar oportuno imponer una disminución del potencial mayor de la que es estrictamente necesaria para reducir la velocidad de corrosión, por debajo del límite aceptable desde el punto de vista técnico. Por ejemplo, para una estructura desnuda sumergida en agua de mar, una disminución de 150 a 200 mV respecto al potencial de corrosión libre lleva a reducciones de la velocidad de corrosión de al menos dos órdenes de magnitud y de ahí a un grado de protección aceptable, al menos en la mayoría de aplicaciones. Por tanto, en este ambiente debería de aconsejarse un potencial de protección comprendido entre -700 y -750 mV y no uno de -800 mV (vs. Ag/AgCI), como se hace generalmente.
En efecto, se observa que polarizando la estructura a -700 mV, el aumento en el pH que se produce en el cátodo como consecuencia de la reducción del oxígeno, no es suficiente para lograr la precipitación de las capas de carbonato y de hidróxido; en cambio, a -800 mV se obtiene este depósito, lo que provoca una disminución de la corriente límite de difusión del oxígeno y por tanto de la corriente de protección, la cual, a -800 mV, resulta muy inferior a la necesaria para mantener la estructura a un potencial de -700 mV (Figura 23).
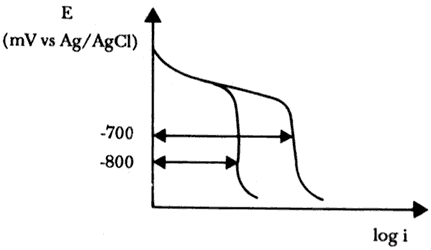
Figura 23. Densidad de la corriente de protección con diferentes potenciales.
En ciertas condiciones ambientales en las cuales la formación de depósitos calcáreos puede resultar obstaculizada (por ejemplo, por una fuerte acción abrasiva o en presencia de soluciones de salmuera poco incrustantes) puede resultar necesario operar con potenciales del orden de -900 mV para obtener los depósitos calcáreos y con ellos el efecto benéfico consecuente.
Algunos criterios utilizados en la práctica
Por lo revisado anteriormente, el potencial de protección puede definirse como aquel en el cual cualquier aumento del grado de protección implica poco costo, ligado directa o indirectamente al aumento de la corriente necesaria, con la ventaja que se deriva de la consecuente disminución de la velocidad de corrosión.
De hecho, en la gran mayoría de los casos (por ejemplo en la protección catódica en suelos, agua de mar, etc.) los criterios que tienen aplicación son aquellos que están basados en la experiencia práctica.
El Código de Práctica inglés de la British Standard Institution ("Code of Practice for Cathodic Protection" [C.P. 1021] agosto de 1973) recomienda, para diferentes materiales, los potenciales de protección que se presentan en el cuadro 19.

En particular, el valor normalmente indicado para la protección de estructuras de acero enterradas nuevas y bien protegidas con algún tipo de recubrimiento es aquel que lleva a un potencial inferior a los -850 mV vs. Cu/CuSO4 (criterio de los -850 mV) y a -900 mV en el caso de un suelo que contenga bacterias sulfato-reductoras (o sea, más agresivo).
Un criterio análogo se emplea para proteger el acero en agua de mar; se toma como protegida una estructura cuando se encuentra a un potencial de -800 mV respecto del electrodo de referencia de Ag/AgCI, que es el más usado en agua de mar. Si el acero está en contacto con el lodo del fondo marino y en condiciones en las cuales pueden desarrollarse bacterias sulfato-reductoras, el potencial de protección se aumenta a -900 mV vs. Ag/AgCI.
La experiencia muestra, sin embargo, que no siempre se utilizan criterios de este tipo. Por ejemplo, si una estructura enterrada no está protegida con un buen recubrimiento (una estructura vieja por ejemplo) o sencillamente no está protegida por algún recubrimiento, no es conveniente, especialmente en terrenos muy aereados, aplicar el criterio de los -850 mV vs. Cu/CuSO4, por que la corriente necesaria para alcanzar este potencial puede resultar muy elevada. En este caso, por ejemplo, se prefiere recurrir al criterio conocido como "desplazamiento del potencial", el cual consiste en disminuir 300 mV el potencial de la estructura con respecto al potencial de corrosión libre.
En la determinación del potencial de la estructura; a proteger se puede incurrir en algunos errores, ligados sobre todo a una mala situación del electrodo de referencia, los cuales sólo pueden conocerse o eliminarse si se conoce la magnitud del potencial que se mide.
El potencial de una estructura, respecto al electrodo de referencia colocado en su vecindad, es la suma de tres contribuciones esencialmente:
a) una contribución de tipo termodinámico que depende del electrodo de referencia utilizado. Esta contribución interesa sólo en cuanto que fija la diferencia al potencial cero en la escala convencional que toma como potencial cero el del electrodo de hidrógeno. Por ejemplo, en el caso de una estructura enterrada, el electrodo más utilizado como referencia es el de cobre/sulfato de cobre (Cu/CuSO4). El cero de potencial respecto a este electrodo se encuentra cerca de 300 mV por encima del cero en la escala del de hidrógeno (véase Figura 8).
b) Una contribución, debida esencialmente al sobrepotencial de activación y de concentración de la reacción que se produce en la interfase superficie metálica/electrolito. Este sobrepotencial está ligado a la naturaleza del proceso electródico, a su velocidad, etcétera.
c) Un término de caída óhmica que depende de la posición en la cual se sitúa el electrodo de referencia respecto de la estructura, de la geometría del sistema, de su conductividad, de la corriente que circula (en virtud de la protección catódica o de corrientes parásitas), etcétera.
El potencial que se desea conocer, con el fin de valorar las condiciones de protección de la estructura, es precisamente el de la estructura con respecto al ambiente que la rodea. Este potencial se puede medir directamente (considerando despreciable el término de la caída óhmica) si se coloca el electrodo de referencia en la vecindad inmediata, es decir, junto a la estructura.
En la práctica, el modo más empleado para determinar directamente, sobre una estructura en servicio, la contribución de la caída óhmica, consiste en "interrumpir" o en variar la corriente (en este segundo caso, sólo en sistemas con corriente impresa) con la cual se está polarizando la estructura que se desea proteger, a partir de lo cual se registrará la consiguiente variación de potencial. La variación instantánea del potencial, en el momento de abrir el circuito, corresponde a la contribución de la caída óhmica. Los tipos de electrodos de referencia más empleados en la práctica de la protección catódica, el de Ag/AgCl/agua de mar, Zn/agua de mar y Cu/CuSO4 (saturado), se han descrito ya en el capítulo II.
Medida del potencial en estructuras enterradas
Cuando se trata de medir el potencial de una tubería enterrada, se toma el electrodo de Cu/CuSO4 (saturado) como referencia y un milivoltímetro de resistencia interna elevada (mayor de 100 000 ohms). El polo positivo del aparato se une al electrodo de referencia y el negativo a la tubería. El valor que marque el aparato será el potencial de disolución del metal del tubo, en función del medio agresivo, en este caso el del suelo. La disposición y la forma de realizar esta medida se representa en la figura 24. El electrodo debe situarse justo encima de la generatriz superior de la tubería, de forma que quede perpendicular a ella.
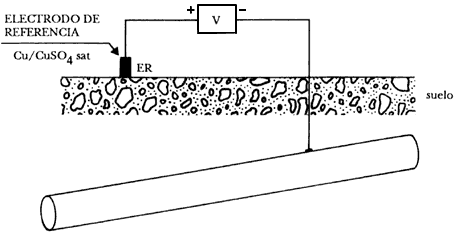
Figura 24. Realización práctica de medida de potencial de una tubería con
un electrodo de referencia de Cu/CuSO4 sat.
Como ya se ha indicado, las medidas de potencial pueden verse afectadas por la caída óhmica producida por el paso de la corriente eléctrica que genera el proceso de protección catódica. Esta caída de voltaje puede ser desde unos milivoltios a uno o varios centenares, según sea el proceso. La magnitud del error depende de la forma de la estructura a proteger, de la corriente que fluye entre ella y los ánodos, de la resistividad del medio y de la distancia entre el electrodo de referencia y la estructura. Si la distancia y la corriente son pequeñas, la caída de potencial puede ser despreciable.
La corriente que llega a la estructura que desea protegerse crea un campo eléctrico de líneas equipotenciales a su alrededor (Figura 25). Según esta figura, cualquier punto de la superficie del suelo elegida para colocar el electrodo de referencia, tendrá un potencial diferente al inmediatamente próximo. Cada uno de estos puntos tendrá a su vez una caída de potencial que dependerá de la resistencia del terreno entre el electrodo y la tubería. El electrodo de referencia deberá colocarse justamente encima de la generatriz superior del tubo. En el caso de un depósito enterrado es exactamente igual, ya que la acción del campo eléctrico no afecta la medida.
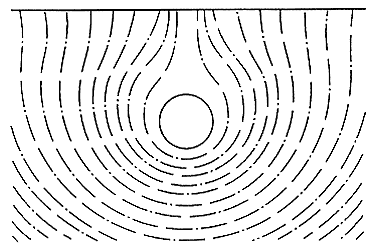
Figura 25. Campo eléctrico alrededor de una tubería.
Para asegurar una medida correcta del potencial, estas líneas equipotenciales deben ser perpendiculares a la superficie del suelo. Esto se consigue cuando la distancia entre la estructura enterrada y el ánodo es muy grande, en comparación con la profundidad a la que dicha estructura está enterrada (Figura 26 a). Si la separación es pequeña, las líneas equipotenciales sufren una distorsión, por lo que dejan de ser perpendiculares a la superficie del suelo y, por tanto, afectan mucho las medidas (Figura 26 b).
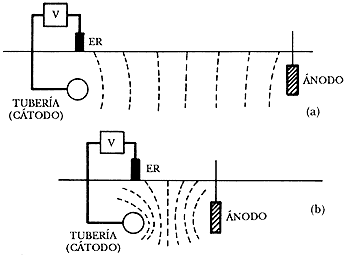
Figura 26. (a) La medida de potencial no se ve afectada por el campo eléctrico. (b) la medida de potencial se ve afectada por el campo eléctrico.
En el caso de depósitos de gases licuados de petróleo (GLP) enterrados, como van dentro de un cubeto de mampostería relleno con arena lavada de río, se topan con una resistencia elevada del medio y, por falta de espacio, con los ánodos próximos al depósito. En este medio tan resistivo, la salida de corriente de los ánodos de sacrificio, incluso si es de Mg, es muy pequeña. Por tanto, hay que colocar muchos ánodos de poco peso, para hacer un buen reparto de corriente, pues es muy pequeña la que suministran.
Si la corriente es muy pequeña, la caída de potencial será también muy pequeña, pero además por la configuración geométrica entre el depósito y los ánodos, la longitudinal superior debe verse libre de la acción del campo eléctrico (Figura 27). Por este motivo, cuando se realiza una protección catódica en estos depósitos, la medida de potencial debe realizarse en la longitudinal superior.
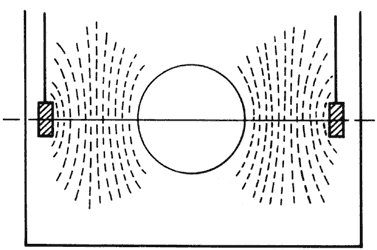
Figura 27. Campo eléctrico alrededor de un depósito de GLP enterrado.
Cuando el electrodo de referencia se desplaza del ánodo de sacrificio hacia la estructura protegida, en dirección de la corriente de protección, el potencial medido que incluye la caída óhmica se vuelve más noble; por el contrario, éste se hace aparentemente más activo cuando el electrodo de referencia se separa de la estructura protegida catódicamente y se aproxima al ánodo (Figura 28). La caída de potencial se traduce en lecturas falseadas del potencial que indican un grado de protección mayor que el que existe en realidad.
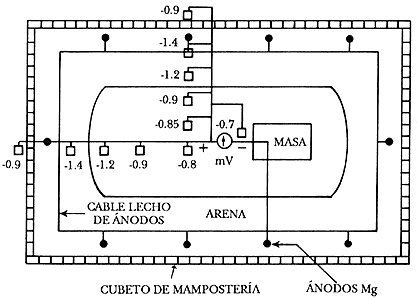
Figura 28. Cubeto de mampostería que contiene un depósito de almacenamiento
de GLP. Importancia de la posición de colocación del electrodo
de referencia de Cu/CuSO4(Tomado
de M. A. Guillén, Revista Iberoamericana de Corrosión y Protección 15
(5), p. 37, 1984.)
Medida del potencial en instalaciones marinas
El acero ha sido el metal base para la construcción de estructuras en el mar, como las plataformas, las boyas, las tuberías submarinas, los pilotes, los tablestacas, etc., cuyo diseño, construcción y protección contra la corrosión ha sido el objetivo de importantes investigaciones en el mundo.
La evolución en la utilización de estructuras de acero en el mar está íntimamente ligada al descubrimiento de yacimientos de petróleo o de gas y al nacimiento y desarrollo de las técnicas de protección contra la corrosión. La protección catódica es imprescindible para el mantenimiento de estas estructuras dada la agresividad del medio (agua de mar) en el que están sumergidas. De aquí la importancia de controlar el buen funcionamiento de la protección catódica de las instalaciones marinas "offshore", como se les conoce en el argot de la ingeniería de la corrosión.
La medida del potencial electroquímico de este tipo de estructuras persigue dos objetivos fundamentales:
1) Medición del potencial de la estructura protegida para verificar que el criterio termodinámico de inmunidad se cumple en todos los puntos.
2) Medición del potencial de algunos ánodos de sacrificio representativos, para verificar su buen comportamiento (la ausencia de polarización excesiva).
La figura 29 representa el principio de medida del potencial electroquímico. La estructura protegida se conecta al polo negativo de un voltímetro, mientras que el electrodo de referencia, sumergido en el electrolito por el cual circula la corriente de protección, se conecta al polo positivo. La posición exacta del electrodo de referencia en el campo eléctrico establecido entre el ánodo y el cátodo es de suma importancia. En efecto, el potencial leído corresponde a la superficie equipotencial sobre la cual se sitúa el electrodo de referencia. Así, en la figura 29, el circuito 1 corresponde a la medida del potencial en el punto A de la estructura, mientras que el Circuito 2 corresponde a la medida de potencial del ánodo. El circuito 3 representa una situación intermedia.
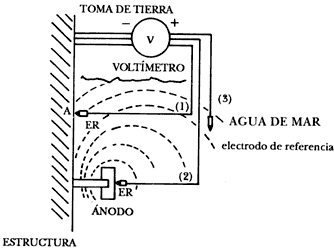
Figura 29. Principio de la medida del potencial electroquímico.
Teóricamente, un error de lectura causado por la caída óhmica en el circuito de medida es inevitable,aunque en la práctica este error será irrelevante si se toman las precauciones necesarias. En particular, la corriente que circule por el circuito de medida debe ser lo más pequeña posible. Para esto, la impedancia de entrada del voltímetro utilizado debe ser lo más elevada posible (mayor de 100 000 ohms). Además el contacto con la estructura debe realizarse en las mejores condiciones posibles, con objeto de evitar resistencias de contacto parásitas.
Si bien el electrodo de cobre/sulfato de cobre saturado (Cu/CuSO4sat.)
es prácticamente el único que se utiliza para la medición del potencial de estructuras
enterradas, en el caso de estructuras marinas (offshore) se puede escoger entre
varios:
a) El electrodo Cu/CuSO4
saturado puede utilizarse, aunque hay que renovar frecuentemente la solución
de CuSO4, pues
su contaminación por el agua de mar llega a falsear la lectura.
b) El electrodo de calomelanos saturado fue utilizado en un principio, aunque en la actualidad prácticamente no se usa en virtud de su fragilidad.
c) La práctica más corriente consiste en utilizar el electrodo de plata/cloruro de plata (Ag/AgCl) en agua de mar, con lo cual se evita el problema de contaminación. Hay que tener en cuenta con este electrodo además que el valor del potencial leído es función de la concentración de iones cloruro (véase el capítulo II) del agua de mar y por tanto de la salinidad. La variación, de todos modos, es pequeña para las salinidades habituales.
d) Para aquellos casos en que se requiera que los electrodos funcionen por lapsos largos en una posición fija, se prefiere utilizar el Zn de alta pureza. Un inconveniente de este electrodo es una cierta variación del potencial de un electrodo a otro, por lo cual se recomienda una calibración periódica de los mismos con un electrodo de Ag/AgCl.
El criterio de inmunidad del acero con respecto a los diferentes electrodos de referencia indicados en condiciones normales de aereación y salinidad, es el siguiente:
| -850 mV vs. Cu/CuSO4 saturado |
| -790 mV vs. Ag/AgCl en agua de mar |
| +250 mV vs. Zn |
Además del electrodo de referencia y de un voltímetro de alta impedancia de entrada, se requiere de cables eléctricos, cuyo calibre puede ser pequeño y de una buena conexión a la masa de la estructura que se puede lograr con pinzas de cocodrilo o por contacto por presión, por soldadura, etc. La utilización de voltímetros electrónicos minimiza los errores causados por las caídas óhmicas.
Algunos de los métodos utilizados para la medida del potencial tanto de estructuras como de ánodos, se presentan en las figuras 30-35.
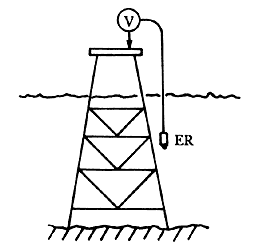
Figura 30. Medición del potencial. Electrodo móvil con voltímetro en la superficie.
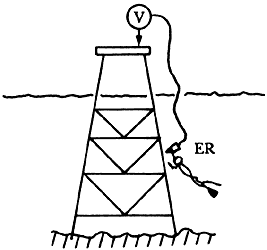
Figura 31. Medición del potencial con la ayuda de un submarinista.
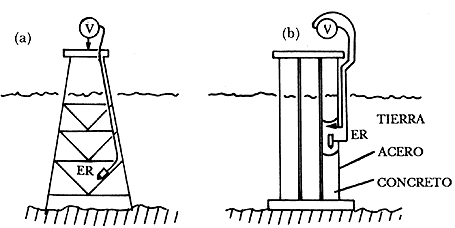
Figura 32. Electrodo fijo con voltímetro en la superficie. (a) Masa en la superficie. (b) Masa sumergida.
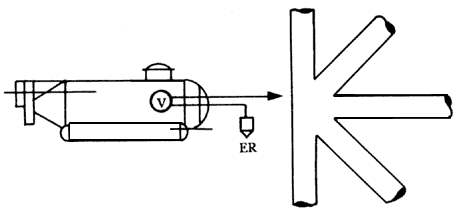
Figura 33. Medida del potencial con la ayuda de un submarino.
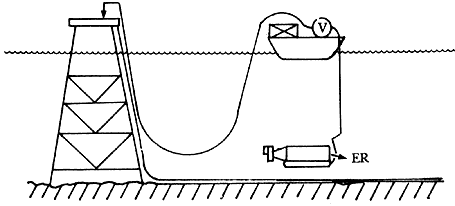
Figura 34. Medida del potencial con la ayuda de un submarino y toma de tierra (masa) en la superficie.
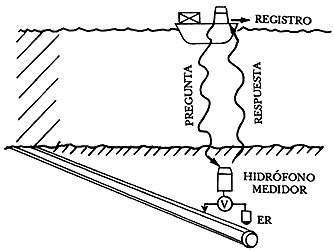
Figura 35. Control del potencial por transmisión acústica.
DENSIDAD DE CORRIENTE DE PROTECCIÓN
Pueden utilizarse diferentes métodos para la determinación de la intensidad
de protección (1p) o de la densidad de
corriente de protección. La figura 36 representa un método experimental de polarización,
adecuado para determinar la densidad de corriente de protección (Dp).
Aplicando una corriente eléctrica creciente se obtiene una serie de valores
del potencial del hierro o del acero en agua de mar o en cualquier otro electrolito.
Si llevamos sobre la curva de polarización obtenida para el hierro el potencial
de protección anteriormente calculado (véase el capítulo II), -0.61 V, se obtiene
la densidad de corriente de protección, que según la figura 36 resulta ser de
86 mA/ m2.
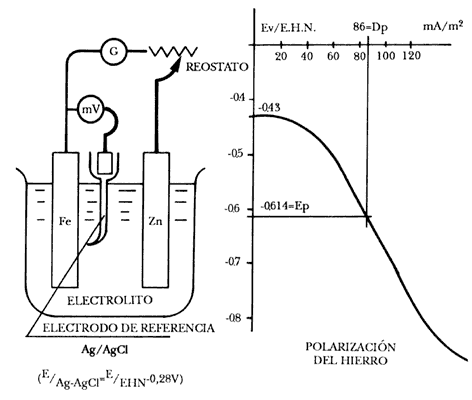
Figura. 36. Método experimental del trazado de una curva de polarización utilizable
para el cálculo de la densidad de corriente de protección (Dp).
Este valor es máximo, porque no tiene en cuenta los procesos de polarización que tienen lugar en función del tiempo y que dan lugar a modificaciones superficiales, como la acumulación de iones OH, de hidrógeno, los depósitos de magnesio calcáreos, etcétera.
Valores prácticos de la densidad de corriente de protección
Por cualquier método que pueda ser empleado, la densidad de corriente de protección ha sido determinada en función del estado superficial del acero, que puede estar pintado o no o recubierto con un sistema pasivo de protección. Algunos resultados prácticos se agrupan en el cuadro 20.
CUADRO 20. Densidad de corriente de protección en distintos medios agresivos


Hay que resaltar la influencia de la velocidad del agua que habrá que tener siempre muy en cuenta, así como la existencia de bacterias o de cualquier otro factor susceptible de incidir directamente en la corrosión y por tanto en la densidad de corriente para lograr la protección.
Las capas de pinturas que se aplican sobre el acero reducen la densidad de corriente necesaria para la protección y esta reducción variará en función del espesor y tipo de pintura. En el cuadro 20 se dan algunos valores indicativos.
La amplitud y diversidad de las instalaciones marinas y las características de las aguas de los distintos mares no hacen posible que se pueda presentar con detalle la infinidad de datos recogidos a lo largo de los años debidos a la experiencia de investigadores e ingenieros en este campo.
En lo que se refiere a las aguas dulces, las instalaciones son menos importantes y menos numerosas que las sumergidas en agua de mar. Algunos valores de densidad de corriente adecuada para conseguir la protección catódica en este tipo de agua se presentan en el cuadro 20.
La densidad de corriente necesaria para la protección catódica de estructuras enterradas, básicamente de tuberías, es un caso especial, ya que el suelo es un medio heterogéneo donde varía mucho la velocidad de corrosión. De un suelo natural se puede separar, fundamentalmente, arena, arcilla, cal y humus. Estos componentes pueden estar mezclados en el suelo en diferentes proporciones, lo que dará lugar a distintos grados de agresividad y, por tanto, a valores distintos de la densidad de corriente para lograr la protección. Si el oxígeno atmosférico no puede penetrar en el suelo, lo que con frecuencia es el caso en suelos arcillosos o turbosos, pueden existir bacterias. Estos microorganismos que se desarrollan en ausencia completa de oxígeno (condiciones anaerobias) como el Sporovibrio desulfuricans, originan graves problemas de corrosión al transformar los sulfatos presentes en el terreno, en sulfuros; los síntomas de este tipo de corrosión anaerobia son: un ennegrecimiento local del suelo por el sulfuro de hierro que se forma y a veces, un olor a ácido sulfhídrico.
Un factor importante para conocer la agresividad de un suelo es el conocimiento de su resistividad. (Para mayor información al respecto, véase el capítulo VII.)
Es en función de todos estos factores que se debe determinar la densidad de corriente de protección. En la última parte del cuadro 20 se presentan algunos valores de la densidad de corriente en suelos de diferentes tipos.
En la mayoría de los casos de tuberías enterradas la protección catódica se efectúa sobre ductos ya protegidos con un recubrimiento como pintura, alquitrán, etc. La corriente de protección resulta ser entonces un porcentaje pequeño con respecto a la necesaria para proteger a la estructura metálica desnuda, pues deberá servir para proteger las partes en las que el revestimiento presenta defectos: poros, rasguños, imperfecciones, etc. La corriente de protección resultará más baja mientras mayor sea la eficiencia del recubrimiento.
Podemos definir la eficiencia del recubrimiento (j) como el porcentaje de la superficie metálica efectivamente revestida o recubierta. Por ejemplo, si se dice que un recubrimiento tiene un 90% de eficiencia, querrá decir que hay un 10% de la superficie metálica que está descubierta, o sea no protegida por el recubrimiento y que, por tanto, se necesitará sólo un 10% de la corriente necesaria para proteger toda la estructura desnuda; entonces, la densidad de corriente de protección es proporcional a la fracción de superficie descubierta o no protegida, y, en general, se puede formalizar de la siguiente manera:
R
= i( l -j ),
|
en donde: |
i= | la densidad de corriente de protección de la estructura desnuda |
iR = |
la densidad de corriente de protección de la estructura recubierta | |
| j= | la eficiencia del recubrimiento (fracción unitaria). |
Naturalmente, la eficiencia de un recubrimiento puede variar con el tiempo. Por ejemplo, para tuberías enterradas sin mantenimiento puede pasar al 95 o al 90% después de 10 o 20 años.
El envejecimiento es aún más acelerado en estructuras que están en contacto con el agua del mar. Por ejemplo, en el caso de un barco bien revestido (con 5 capas de pintura), la eficiencia del recubrimiento puede pasar durante el primer año del 99.9 al 99% y así sucesivamente, sin que se le dé un mantenimiento preventivo. Obviamente, además del envejecimiento normal del recubrimiento, contribuyen a disminuir la eficiencia notablemente los daños mecánicos (abrasión) que por lo general son mayores en barcos grandes y veloces.
La eficiencia efectiva de recubrimientos porosos o dañados mecánicamente puede mejorar, cuando es posible la precipitación de sales (carbonato de calcio e hidróxido de magnesio), lo cual tiene lugar en agua de mar en las zonas descubiertas de la estructura, en las cuales se concentra la corriente de protección.
Se dice que una estructura o, en ocasiones, alguna parte de la misma está sobreprotegida cuando la densidad de corriente intercambiada en su superficie es mayor que la necesaria para una protección completa. En general, esta condición sucede cuando la protección catódica se efectúa mediante el sistema de corriente impresa.
Evidentemente la sobreprotección debe evitarse, tanto porque implica un consumo inútil de electricidad, un mayor consumo del ánodo, etc., como, y especialmente, por el daño indirecto que puede provocar: ampollamiento del recubrimiento, degradación del mismo, desprendimiento de hidrógeno con posibilidad de fragilización del acero, etc. Por ejemplo, en agua de mar, cuando en la estructura que se quiere proteger se miden potenciales más negativos de -1150 mV vs. Cu/CuSO4 saturado, es señal de una densidad de corriente demasiado elevada, por lo que pueden tener lugar efectos negativos en virtud de:
a) una alcalinización excesiva,
b) desprendimiento de hidrógeno.
A altas densidades de corriente tiene lugar la reducción del agua, según:
De hecho, en la superficie de la estructura protegida se obtienen valores de
pH de alrededor de 11, en virtud de que la reacción que tiene lugar en la estructura
protegida es la reducción del oxígeno:
En condiciones de sobreprotección, el pH aumenta provocando la corrosión de aquellos metales como el Al, el Zn o el Pb y sobre todo, el ampollamiento o degradación del recubrimiento.
La formación de ampollas en el recubrimiento se produce en especial cuando, aunque sea localmente, tiene lugar el desprendimiento de hidrógeno. De hecho, si este gas se forma en algún defecto del recubrimiento de la superficie metálica, puede llegar a ejercer una presión elevada y provocar el desprendimiento del recubrimiento y la base metálica quedar desprotegida.
El ampollamiento del recubrimiento también puede ser provocado por la migración del agua hacia la superficie metálica a través del recubrimiento, bajo la acción del campo eléctrico (fenómeno de electroósmosis). En cualquier caso, el ampollamiento del recubrimiento debe ser evitado, para lo cual se da normalmente un límite inferior al potencial al cual debe llevarse la estructura. En el cuadro 21 se presentan los valores límites del potencial para diversos tipos de pinturas. Por ejemplo, la pintura hecha a base de minio no puede aplicarse sobre estructuras protegidas catódicamente ya que puede reducirse el óxido de plomo y destruirse la pintura.
CUADRO 21. Valor límite del potencial aplicado para diversos tipos de pintura

En general, sin embargo, las pinturas pueden aplicarse con éxito aun en condiciones de sobreprotección cuando son muy adherentes y muy resistentes químicamente (se deben excluir por ejemplo las pinturas saponificables), además de que deben poseer un espesor suficiente para aumentar la impermeabilidad. Existen discrepancias sobre el comportamiento de los primarios inorgánicos de Zn que en general no se incluyen en la formulación de los esquemas de pintado de las estructuras sumergidas en agua de mar y protegidas catódicamente. Sin duda, en condiciones de protección normal, el primario inorgánico de Zn se comporta bien y puede utilizarse por ejemplo en sistemas de protección con ánodos de sacrificio de Zn o Al.
Por lo que se refiere a la influencia del espesor, en el cuadro 22 se indican los espesores mínimos de varios tipos de pinturas que resisten a un potencial de -900 mV vs. Ag/AgCI (valor aceptado por la Compañía de Seguros Lloyds para los cascos de los barcos). Estos valores parecen muy altos en cuanto a que, en la práctica, se utilizan sin grandes problemas espesores mucho menores.
CUADRO 22. Espesores mínimos para diversos esquemas de pintado resistentes a un potencial de -900 mV vs. Ag/AgCl