I. LA ESTRUCTURA ATÓMICA DE LA MATERIA
¿QUÉ es la materia? Según el diccionario, es "aquello que constituye la sustancia del universo físico". La Tierra, los mares, la brisa, el Sol, las estrellas, todo lo que el hombre contempla, toca o siente, es materia. También lo es el hombre mismo. La palabra materia deriva del latín mater, madre. La materia puede ser tan dura como el acero, tan adaptable como el agua, tan informe como el oxígeno del aire. A diferentes temperaturas puede presentar diferentes fases, pero cualquiera que sea su forma, está constituida por las mismas entidades básicas, los átomos.
Las radiaciones ionizantes y sus efectos también son procesos atómicos o nucleares. Por eso debemos describir a los átomos y sus núcleos antes de hablar de la radiación.
La pequeñez de los átomos embota la imaginación. Los átomos son tan pequeños que pueden colocarse unos 108, o sea 100 millones de ellos, uno después de otro, en un centímetro lineal. Su radio es del orden de l0-8 cm. A su vez, los núcleos tienen dimensiones lineales 10 000 a 100 000 veces más pequeñas. El radio nuclear es de 10-12 a 10-13 cm. En términos de volumen, los átomos ocupan como l0- 24 cm³ y los núcleos l0-38 cm³.
En un sólido, los átomos se encuentran en contacto entre sí y fuertemente ligados, de manera que su movimiento relativo es mínimo. Por esta razón los sólidos conservan su forma. En los líquidos, en cambio, aunque los átomos también se hallan en contacto, no están fuertemente ligados entre sí, de modo que fácilmente pueden desplazarse, adoptando el líquido la forma de su recipiente. Los átomos o las moléculas de los gases están alejados unos de otros, chocando frecuentemente entre sí, pero desligados, de manera que pueden ir a cualquier lugar del recipiente que los contiene.
Nuestra imagen del atómo recuerda la de un sistema planetario en el que el núcleo está en el centro y los electrones giran a su alrededor, aunque de hecho no puede decirse, a diferencia de nuestro Sistema Solar, exactamente dónde se encuentra cada electrón en cada instante, como se ilustra en la figura 1.
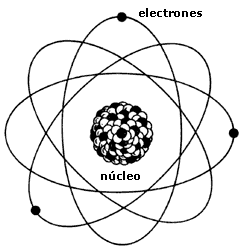
Figura 1. Nuestra imagen del átomo.
El núcleo de cada átomo está formado a su vez por protones y neutrones. Lo podemos imaginar como un racimo de partículas, pues neutrones y protones se encuentran en contacto unos con otros.
Los electrones tienen carga eléctrica negativa (-e), los protones la misma, pero positiva (+e), y los neutrones no tienen carga. Los núcleos son por consiguiente positivos. La fuerza fundamental que mantiene a los electrones unidos a su respectivo núcleo es la eléctrica; sabemos que cargas opuestas se atraen y cargas del mismo signo se repelen.
Los átomos normalmente son eléctricamente neutros, pues el número de electrones
orbitales es igual al número de protones en el núcleo. A este número se le denomina
número atómico (Z) y distingue a los elementos químicos. Ahora bien, los electrones
orbitales se encuentran colocados en capas. La capa más cercana al núcleo es
la capa K; le siguen la capa L, la M, la N, etc. Una clasificación de los elementos
la constituye la tabla periódica, en que a cada elemento se le asocia su correspondiente
Z (véase la figura 2). En el cuadro 1 se dan ejemplos de algunos elementos ligeros,
incluyendo el número de electrones que corresponde a cada capa; la capa K se
llena con 2 electrones, la L con 8, etc. Se conocen más de 100 elementos. Nótese
que nombrar el elemento equivale a establecer su número atómico.
| |
||||
| Elemento |
Z |
Número de electrones en
la capa |
||
| |
||||
| K |
L |
M |
||
| |
||||
| H (hidrógeno) | 1 |
1 |
||
| He (helio) | 2 |
2 |
||
| Li (litio) | 3 |
2 |
1 |
|
| Be (berilio) | 4 |
2 |
2 |
|
| B (boro) | 5 |
2 |
3 |
|
| C (carbono) | 6 |
2 |
4 |
|
| N (nitrógeno) | 7 |
2 |
5 |
|
| O (oxígeno) | 8 |
2 |
6 |
|
| F (flúor) | 9 |
2 |
7 |
|
| Ne (neón) | 10 |
2 |
8 |
|
| Na (sodio) | 11 |
2 |
8 |
1 |
| Mg (magnesio) | 12 |
2 |
8 |
2 |
| Al (alumino) | 13 |
2 |
8 |
3 |
| etcétera | ||||
| |
||||
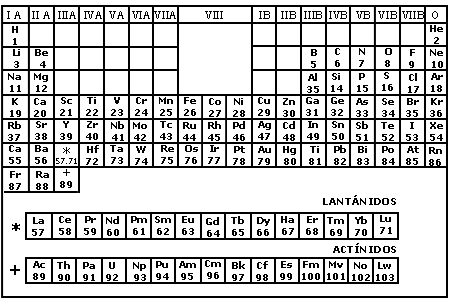
Figura 2. La tabla periódica de los elementos.
Si por algún proceso físico un electrón se separa de su átomo correspondiente, se dice que sucede una ionización. El átomo resultante, ahora con una carga neta positiva, se llama ion positivo, o átomo ionizado. La ionización puede tener lugar en cualquiera de las capas atómicas, denominándose ionización K, L, M, etc. Cuando sucede una ionización de capa interna, como la K, queda un espacio vacante en la capa. El átomo tiene la tendencia entonces a llenar esta vacancia con un electrón de una capa externa. Al suceder esto, hay una emisión de radiación electromagnética (luz visible, rayos ultravioleta, o rayos X), como lo muestra la figura 3.
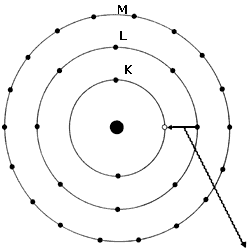
Figura 3. Si sucede una ionización en la capa K, un electrón de la capa L
llena la vacancia, emitiéndose un fotón.
En un compuesto químico se unen átomos de diferentes elementos para formar una molécula, de acuerdo con la valencia de cada tipo de átomo. También pueden formarse moléculas de átomos iguales, como en el caso del nitrógeno o del oxígeno, que en su estado natural existen como moléculas diatómicas (dos átomos).
Como ya se mencionó, el núcleo está en la parte central del átomo, y consiste de protones y neutrones. Cada elemento de un Z determinado puede contener en su núcleo diferente número de neutrones sin que ello afecte su número atómico; por ejemplo, el hidrógeno, el elemento más sencillo, puede tener cero, uno, o dos neutrones. El núcleo del hidrógeno más común sólo consiste de un protón; le sigue el hidrógeno pesado, o deuterio, con un protón y un neutrón; y el tritio, con un protón y dos neutrones. Todos ellos son hidrógeno, por ser de Z = 1, pero las variantes según N, el número de neutrones, se llaman isótopos del hidrógeno. En la Tierra, sólo 15 de cada 100 000 núcleos de hidrógeno son de deuterio. La llamada agua pesada está formada por deuterio en lugar de hidrógeno común. Por otro lado, el tritio, que es radiactivo, sólo se encuentra en ínfima cantidad; lo produce la radiación cósmica. La figura 4 muestra los isótopos del hidrógeno.
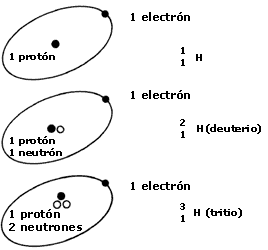
Figura 4. Los isótopos del hidrógeno.
El número de masa A de los núcleos es igual al número total de nucleones (así se llama genéricamente a los neutrones y protones). En otras palabras, A = N + Z, con lo cual se define totalmente de qué núcleo se trata. Hay más de 2 000 isótopos conocidos de todos los elementos. En el cuadro 2 se dan ejemplos de algunos isótopos de los elementos más
ligeros.
|
|
|||
|
Elemento
|
Z
|
N
|
A = N+Z
|
|
|
|||
| H |
1
|
0 |
1 |
|
H
|
1
|
1
|
2
|
|
H
|
1
|
2
|
3
|
|
He
|
2
|
1
|
3
|
|
He
|
2
|
2
|
4
|
|
Li
|
3
|
3
|
6
|
|
Li
|
3
|
4
|
7
|
|
Be
|
4
|
5
|
9
|
|
B
|
5
|
5
|
10
|
|
B
|
5
|
6
|
11
|
|
C
|
6
|
6
|
12
|
|
C
|
6
|
7
|
13
|
| C
|
6
|
8
|
14
|
|
N
|
7
|
7
|
14
|
|
N
|
7
|
8
|
15
|
|
O
|
8
|
8
|
16
|
|
O
|
8
|
9
|
17
|
|
O
|
8
|
10
|
18
|
|
etcétera
|
|||
|
|
|||
Para identificar sin ambigüedad a los núcleos, se usa la siguiente notación:
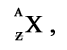
en donde X representa el símbolo químico (H, He, Li, etc.). Al indicar A y
Z, queda definido N = A- Z. Nótese, además, que se puede prescindir de escribir
Z, pues ya se tiene el símbolo químico, que es equivalente. En esta notación,
los isótopos del hidrógeno son 1H, 2H
y 3H. Los del oxígeno serán 16O,
17O y 18O. La llamada Tabla de los Núclidos clasifica
a todos los núcleos conocidos. En ella se asignan casilleros a los núclidos,
teniendo en el eje horizontal el número N y en el vertical Z, como lo muestra
la figura 5 para los elementos más ligeros.
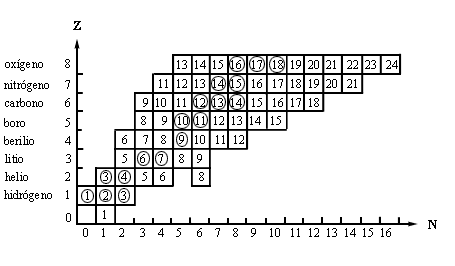
Figura 5. Tabla de los isótopos de los elementos ligeros. Cada renglón corresponde a un elemento. El número de cada cuadro es el número total de nucleones A. Los círculos indican isótopos naturales.
La masa de los núcleos es otra de sus características importantes. Para cuantificaría se define la unidad atómica de masa (u.a.m) como 1/12 de la masa del átomo de 12C, que tiene 6 protones, 6 neutrones y 6 electrones. En estas unidades las masas de las partículas fundamentales resultan ser:
Como se puede ver, la parte importante de la masa de un átomo se debe a los nucleones; los electrones contribuyen poco, siendo la masa del electrón aproximadamente igual a 1/ 1 835 de la masa del protón.
La masa, aquí en la Tierra, se manifiesta como el peso. Cuando uno pesa un objeto, está pesando todos sus componentes, pero principalmente los núcleos. El núcleo define la posición del átomo, y los electrones giran alrededor del núcleo.
Un mol de una substancia es igual a su peso molecular expresado en gramos. Se sabe que un mol de cualquier material tiene el mismo número de moléculas, a saber, 6.023 X 1023, llamado número de Avogadro. Una u.a.m. equivale a 1.66043 X 10-24 gr, que es precisamente el recíproco del número de Avogadro.
La masa de un isótopo dado nunca es igual a la suma de las masas de sus componentes. Este hecho extraño se debe a que la masa (m) se puede transformar en energía (E), y viceversa, según la muy conocida ecuación de Einstein:
donde c es la velocidad de la luz, 3 X 1010 cm/ seg. Si la masa del isótopo es menor que la suma de las masas de sus componentes, la diferencia de las masas es la energía de amarre del isótopo. Ésta es la energía que se requiere para romper al isótopo en sus componentes.
La unidad conveniente de energía es el eléctrón-volt (eV), que es la energía adquirida por una partícula con una carga electrónica (e) al ser acelerada en una diferencia de potencial de 1 volt. Sus múltiplos son:
10 3eV = 1 000 eV = 1 keV (kilo electrón-volt)
10 6eV = 1 000 000 eV = 1 MeV (mega electrón-volt)
Se puede demostrar que 1 Mev equivale a 1.6 X 10-6 ergs.
De acuerdo con la ecuación de Einstein, se puede calcular que 1 u.a.m: (la masa de un nucleón aproximadamente) equivale a 931 MeV, o bien a 1.49 X l0-3 ergs. Si se piensa en el gran número de núcleos que contiene la materia, ésta es una cantidad enorme de energía. En el Apéndice I se muestra el detalle de algunos de estos cálculos.
Como ejemplo de energía de amarre, consideremos el deuterio cuya masa medida es 2.014102 u.a.m. Por separado, el protón, el neutrón y el electrón totalizan 2.016491 u.a.m. Esto significa que para separarlos haría falta proporcionarles 0.002389 u.a.m., o bien 2.23 MeV. Por esta razón se dice que la energía de amarre del deuterio es 2.23 MeV, y este isótopo es estable. Por otro lado, hay isótopos a los que les sobra masa, y por lo tanto pueden romperse en distintas formas y todavía los fragmentos resultan con gran energía cinética.
La fuerza nuclear que actúa en estos procesos es una fuerza de atracción entre pares de nucleones (protón-protón, neutrón-neutrón y neutrón-protón). Asimismo, es independiente de las otras fuerzas, como la eléctrica y la gravitacional.