V. LA ATMÓSFERA. LA CONTAMINACIÓN DEL AIRE
LA MOTIVACIÓN fundamental que permitió la sobrevivencia del hombre fue la búsqueda de la mejor satisfacción de sus necesidades primordiales.
En nuestra sociedad actual, el avance tecnológico es enorme y en la obtención de satisfactores se ha perseguido generalmente el máximo beneficio, con el menor costo y esfuerzo. La acumulación de industrias, automóviles y otras fuentes de contaminación ha cumplido con aumentar la producción de bienes, pero a un enorme costo social, ya que ha originado una contaminación del ambiente que es incompatible con la salud humana y la sobrevivencia del ecosistema en que vivimos.
En las grandes urbes el fenómeno de la contaminación es crítico.
|
Aquél que piense que vivimos mejor ahora que antes,
porque producimos más bienes, que piense también que estamos envenenando
más, ahora que antes, el aire que aspiramos 13 veces por minuto
|
Sin comida, podemos vivir cerca de un mes. Sin agua, sólo unos cuantos días. Pero sin aire, moriríamos en minutos. Un aire envenenado es tan nocivo como la ausencia del mismo. En lugar de llevar oxígeno a nuestras células, la hemoglobina transporta veneno.
Quizá el caso más notorio en la historia de la contaminación ocurrió la semana del 4 al 10 de diciembre de 1952, cuando una masa de aire frío cubrió la ciudad de Londres. Debido a la baja temperatura, gran parte de la población prendió sus estufas de carbón, y la industria y la circulación de vehículos no se detuvieron. El día 6, la luz del Sol apenas penetraba la densa nube de contaminantes, que no podía salir del valle del Támesis debido a la menor temperatura de la masa superior de aire. La incidencia de ataques al corazón y las dificultades respiratorias creció. Cuando al fin el viento despejó el cielo, se estima que unas 4 000 personas habían muerto por razones atribuibles al fenómeno.
Ésta y otras catástrofes similares han hecho tomar conciencia a diversos sectores
de la población, aunque muchos otros aún ignoran las letales consecuencias de
la contaminación.

Figura V.1. En la ciudad de México se emiten al día un promedio
de cuatro mil toneladas de gases tóxicos que forman una capa contaminadora
de hasta 300 metros de espesor.
Vale la pena aclarar que la mano del hombre y la era tecnológica no son los únicos culpables de la impureza del aire. Se estima que cuatro erupciones volcánicas recientes (Krakatoa, 1883; Katami, 1912; Hekla, 1947; y Chichón, 1982) han arrojado más gases y partículas a la atmósfera que el hombre a lo largo de su historia.
En este capítulo revisaremos los aspectos químicos más relevantes de la contaminación atmosférica. Iniciamos con la descripción de la atmósfera, para luego considerar los diversos contaminantes y sus efectos y, finalmente, citar las medidas más generalizadas para su control.

Figura V.2. El volcán Iztlacíhuatl (5 286 m) en el valle de México.
La atmósfera que rodea la Tierra es una delgada capa de gases. Hasta unos 30 km de altura, el aire constituye un 99% del peso total de la atmósfera. Sólo existe el suficiente oxígeno para la subsistencia vital a alturas menores de los 6 km sobre el nivel del mar, y en los océanos (biosfera).
|
Comparativamente, la atmósfera es como la piel de
una manzana
|
La atmósfera se estructura en capas que se encuentran a diferentes temperaturas y compuestas por distintos gases:
a) La troposfera, entre 0 y 10 km sobre el nivel del mar, dentro de la cual se desarrolla la vida aérea.
b) La estratosfera, hasta 80 km de altura, es un "aire" muy enrarecido, con mucha menor densidad. En ella existe una capa de ozono, O3, de unos 20 km de altura, que resulta esencial para la vida. Esta capa es una especie de "escudo" que protege a la Tierra de radiaciones solares letales, conocidas como rayos ultravioleta.
c) La ionosfera, que se extiende hasta unos 500 km hacia arriba, donde la concentración de materia es aún menor. Recibe su nombre debido a que la radiación ultravioleta y otros fenómenos eléctricos producen la ionización de sus componentes. Por lo tanto, allí existen iones. Estos son los responsables de que las ondas de radio "reboten" hacia la Tierra, lo que hace posible la comunicación radiofónica.
Para efectos de análisis de la contaminación, prestaremos atención a la troposfera y a la capa de ozono (O3) en la estratosfera.
Cerca de la superficie de la Tierra, la composición del aire es la que se presenta en el cuadro V.1.
|
CUADRO V.1 Composición del aire (seco y limpio) al nivel del mar |
||
|
|
||
|
Fórmula
|
% en volúmen
|
ppm
|
|
|
||
|
N2
|
78.09
|
780 900
|
|
O2
|
20.94
|
209 400
|
|
Ar
|
0.93
|
9 300
|
|
CO2
|
0.0318
|
318
|
|
Ne
|
0.0018
|
18
|
|
He
|
0.00052
|
5.2
|
|
CH4
|
0.00015
|
1.5
|
|
Kr
|
0.0001
|
1
|
|
H2
|
0.00005
|
0.5
|
|
N2O
|
0.000025
|
0.25
|
|
CO
|
|
0.1
|
|
Xe
|
0.000008
|
0.08
|
|
O3
|
0.000002
|
0.02
|
|
NH3
|
0.000001
|
0.01
|
|
NO2
|
0.0000001
|
0.001
|
|
SO2
|
0.00000002
|
0.0002
|
|
|
||
Las concentraciones están dadas en partes por millón = ppm.
|
ppm= número de moléculas en un millón de moléculas
de aire
|
Si se desea obtener el porcentaje en volumen a partir de ppm, hay que dividir
entre 10 000. Entonces, fundamentalmente, el aire consiste de 78% en volumen
de N2, 21% de O2 y 1% de argón.
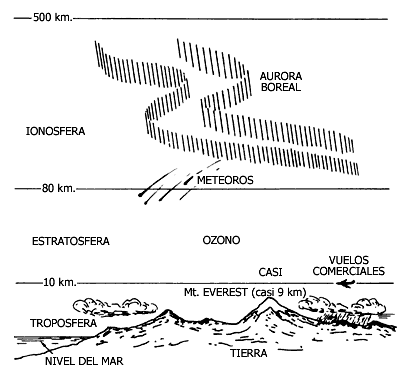
Figura V.3. Principales capas de la atmósfera (no está a escala).
ORIGEN Y EVOLUCIÓN DE LA ATMÓSFERA. LA CONTAMINACIÓN
Como ya mencionamos, la atmósfera de hoy ha evolucionado, no es la misma que aquélla de la Tierra en formación (véase el capítulo 1).
La primera atmósfera de la Tierra estaba constituida primordialmente por H2 y He, gases que escaparon a la fuerza gravitacional que consolidó al planeta. Al compactarse la Tierra, se elevó la temperatura interior y se inició una etapa de alta actividad volcánica que liberó hacia la atmósfera H2O, CO2, SO2, N2, CH4 y otras molécúlas ácidas. Con la presencia del agua se inició la lluvia, la cual "lavó" la atmósfera, que conservó primordialmente N2, H2, CH4 y, en menor proporción, NH3 y otros gases. Esta es la atmósfera reductora que permitió el arraigo de la vida en la Tierra hace 4 000 millones de años.
El proceso de fotosíntesis, que puede expresarse de la siguiente manera,
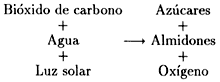
generó gran cantidad de oxígeno. Mucho hierro de la corteza se oxidó, formándose
los minerales que hoy usamos para extraer el hierro. La creciente presencia
de O2 y su conversión en O3 hizo posible que la superficie
del planeta fuera menos inhóspita. Al proliferar la vida en el mar y en la tierra
se formó la actual atmósfera, con una quinta parte de O2. Todo lo
anterior puede observarse en la figura V.4 y el cuadro V.2.
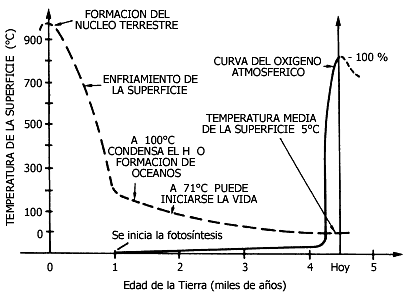
Figura V.4. Temperatura de la superficie terrestre (° C)
|
CUADRO V.2 Componentes de la atmósfera
|
||||
|
|
||||
|
Atmósfera
|
Formativa
|
Reductora
|
En enfriamiento
|
Boigénica
|
|
|
||||
|
Componentes
|
H2,
|
CH4, H2
|
||
|
mayores
|
He
|
N2
|
N2, CO2
|
N2, O2
|
|
|
||||
|
Componentes
|
Ne, Ar,
|
NH3, H2S,
|
H2O, CH4, CO,
|
Ar, CO2, H2O
|
|
menores
|
Kr, Xe
|
H2O, HCl,
|
Ar, O2, SO2
|
|
|
CO2, HCN
|
||||
|
|
||||
|
La contaminación del aire proviene de la adición
de sustancias que alteran su composición normal y producen efectos nocivos
en las personas, animales y otros sistemas
|
Entre los fenómenos atmosféricos hay dos que guardan relación con la contaminación: a) la inversión térmica; y b) las reacciones fotoquímicas. Veamos cada uno de ellos.
El aire frío es más denso que el caliente. Cuando sobre una ciudad circula una corriente fría, ésta empuja el aire que se encuentra debajo, produciendo un ligero calentamiento por compresión. Por así decirlo, el aire frío atrapa a aquél sobre la ciudad y no permite la salida de los contaminantes generados. Unos pocos días en esta situación bastan para generar una crisis de contaminación.
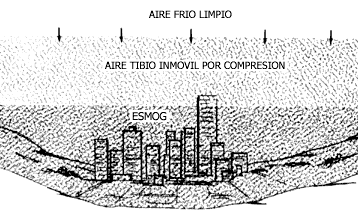
Figura V.5. Aire atrapado en una inversión térmica en un valle.
| Nos hamos permitido castellanizar el término "smog",
del inglés: smoke: humo; fog: niebla, como esmog. Este
efecto es más peligroso en ciudades asentadas en valles cerrrados, como
la de México |
Veamos por qué se conoce a este efecto como "inversión térmica".
En condiciones normales, la temperatura del aire crece conforme más cerca esté de la superficie. Al penetrar una capa de aire frío, esta tendencia se rompe; aquél se sitúa entre el aire tibio y comprime al que está por debajo. El fenómeno queda claro en la figura V.6.
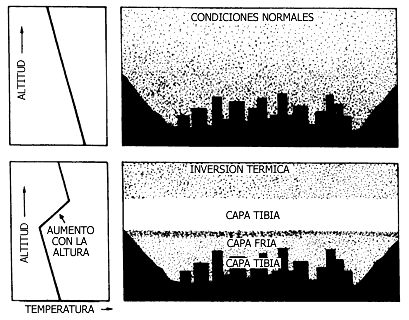
Figura V.6. Perfil de temperatura normal y bajo una inversión.
Como puede observarse, existe una pequeña zona donde la temperatura crece con la altura, una inversión respecto a la normalidad.
En Londres (1952), una inversión térmica de varios días junto con la continua emisión de SO2 y CO2 como producto de la combustión del carbón de coque, provocó el venenoso esmog.
Existe un cierto tipo de reacciones que tienen lugar gracias a la presencia de la luz: las reacciones fotoquímicas. Un ejemplo es la fotosíntesis, ya mencionada, y otro la reacción que ocurre en las películas fotográficas, cuando el obturador de la cámara se abre durante una fracción de segundo.
La energía de la radiación luminosa puede ser lo bastante alta como para ionizar un átomo:
En la atmósfera contaminada ocurren multitud de reacciones fotoquímicas, las
que forman productos muy irritantes, aun en proporciones de 1 mg/m³. Los
más peligrosos se forman a partir de óxidos de nitrógeno, hidrocarburos y la
acción de la luz, como los nitratos de peroxiacilo, conocidos como NPA. El proceso
de su formación arranca debido a la luz, que rompe un enlace en el NO2
atmosférico:7![]()
Este átomo de oxígeno liberado es muy reactivo, y forma ozono al chocar con oxígeno molecular:
|
El ozono en la baja atmósfera es también
un contaminante irritante
|
o bien, en presencia de un hidrocarburo (R'H) ocurre la reacción:
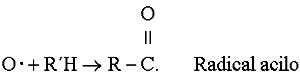
A su vez un radical acilo es fuertemente reactivo, de tal forma que puede adicionar
oxígeno molecular:
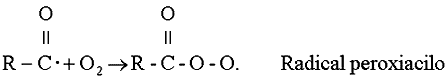
Estos radicales peroxiacilo pueden sufrir diversas reacciones en una atmósfera
contaminada, pero la más peligrosa es la que produce NPA:
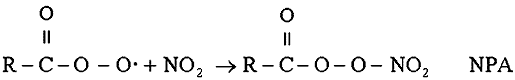
|
Aun en concentraciones de 0.001 ppm, el NPA produce
irritación ocular, alveolar, así como daños en las cosechas
|
PRINCIPALES CONTAMINANTES DEL AIRE
Pueden distinguirse dos tipos de contaminantes: los primarios y los secundarios. Los primarios son los que se emiten como resultado de un proceso (fábrica, motor de combustión, etc.), y los secundarios (como el NPA) los que resultan en las reacciones atmosféricas.
Prestaremos especial atención a los primarios, ya que su eliminación previene la formación de los secundarios. Así, los principales contaminantes atmosféricos son:
1) Óxidos de azufre; 2) óxidos de nitrógeno; 3) óxidos de carbono; 4) hidrocarburos; 5) plomo; 6) ozono; 7) partículas.
A continuación expondremos más detalles de cada uno de ellos y en los cuadros V.3, V.4, V.5 y V.8 presentaremos información relativa a nuestro país.
Se producen cuando el azufre elemental o sus compuestos se queman en el aire.
Parte del SO2 proviene de erupciones volcánicas (originalmente como H2S), así como de la acción de bacterias sobre la materia orgánica.
La otra parte es atribuible al hombre, por las siguientes acciones, entre otras: a) quemar carbón de coque con alto contenido de azufre; b) extraer metales de sulfuros; c) quemar combustibles sin reformar (diesel y combustóleo); y d) fabricar ácido sulfúrico.
Estudios recientes realizados en el D.F., demuestran que el PH8![[Nota 8]](../imgs/mcommnt.gif) de toda el agua de lluvia es menor que 5.5 (valor menor al de una atmósfera
limpia), de ahí que debido a la contaminación, en lugar de agua, sobre nuestra
ciudad "llueve ácido".
de toda el agua de lluvia es menor que 5.5 (valor menor al de una atmósfera
limpia), de ahí que debido a la contaminación, en lugar de agua, sobre nuestra
ciudad "llueve ácido".
Los medios químicos son los más eficientes para eliminar el SO2. Puede quemarse la piedra caliza para obtener óxido de calcio.
y usarlo para eliminar SO2, mediante la reacción:
El SO2 tiene un tiempo corto de residencia en la atmósfera. En presencia de oxígeno y de luz se oxida a SO3:
El trióxido también es peligroso, pues reacciona con el agua para dar ácido sulfúrico, sumamente corrosivo,
Con la lluvia, el SO2 y el SO3 son "lavados" de la atmósfera y se vierten sobre ríos y mares en forma de ácidos:
Con ello, la acidez aumenta, la vida acuática se daña, se provocan corrosión y deslaves. Con esta "lluvia ácida" se dañan incluso las construcciones, debido a la reacción
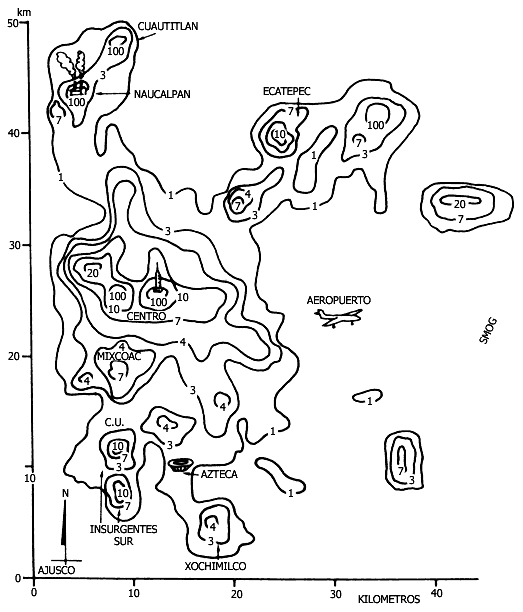
Figura V.7. Niveles de contaminación. Recientemente, las matemáticas han
ayudado a simular los niveles contaminantes. Aquí se muestra (sobre la ciudad
de México) la cantidad de partes de SO2 por cada 100 millones en
un diagrama de curvas de nivel. Por ejemplo, la línea con el número 100 (alrededor
de la Torre Latinoamericana) marca los lugares donde existen 100 ppm de SO2.
La presencia mayoritaria de N2 en el aire y la necesidad de este elemento para la síntesis de proteínas en los seres vivos marcan la gran importancia del nitrógeno en la biosfera.
Entre los óxidos de nitrógeno, el NO2 es el de mayor interés para efectos de la contaminación. Una fuente de NO2 está constituida por los motores de los vehículos. En la cámara de combustión se alcanzan temperaturas tan elevadas que N2 y O2 (del aire) se combinan, dando lugar a varios óxidos de nitrógeno.
Lo interesante por analizar, además de sus posibles efectos nocivos directos, es el papel que desempeñan en el llamado ciclo de nitrógeno. Un desbalance en dicho ciclo puede dar lugar a una catástrofe en la que se haga imposible la vida en la Tierra.
Toda vida animal es posible gracias a la vida vegetal. De las plantas tomamos las proteínas con las que animales y humanos fabricamos las propias. Pero ¿de dónde obtienen su nitrógeno las plantas?
|
Las proteínas contienen nitrógeno
|
El N2 atmosférico no puede ser empleado por la mayor parte de los vegetales para fabricar proteínas, pues es una molécula muy estable. Las plantas sólo pueden tomar el nitrógeno de varios compuestos, existentes en el suelo, pero no del N2 del aire.
Gracias a pequeñísimas bacterias y algas que pueden transformar el N2 en otros compuestos (bacterias y algas fijadoras de nitrógeno) resulta posible la existencia de la vida vegetal y, por ende, la vida animal y humana.
La fabricación artificial de fertilizantes nitrogenados hace posible que el hombre nitrifique el suelo y lo cultive sin depender de bacterias y de algas.
En la figura V.8 se presenta un diagrama del ciclo del nitrógeno en la biosfera.
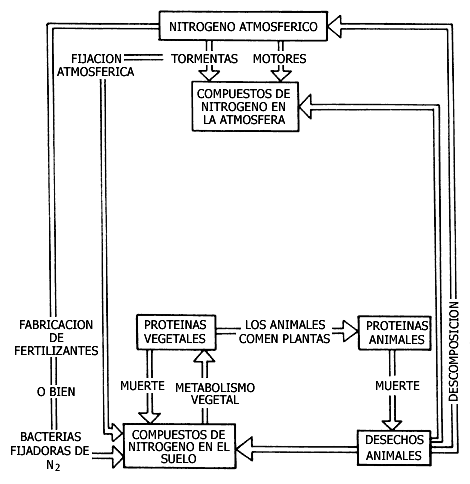
Figura V.8. Ciclo del nitrógeno en la biosfera.
Una vez revisado el ciclo, veamos cómo llegan a la atmósfera los óxidos de nitrógeno. En cualquier proceso de combustión en el aire (o en tormentas eléctricas) se forma cierta cantidad de NO:
A éste no se le considera peligroso para la salud, pero reacciona rápidamente con el oxígeno del aire, produciéndose NO2, un gas de color café, sofocante, con toxicidad directa en los pulmones:
El NO2 reacciona con el vapor de agua:
| 2NO2 + H2O
|
HNO3 | + |
HNO2 |
| ácido nítrico |
ácido nitroso |
y con el oxígeno y el agua de la atmósfera:
dando un carácter ácido al aire atmosférico, el que pasa al suelo al llover.
Estos ácidos pueden reaccionar ahora con amoniaco, produciendo partículas de nitrato de amonio:
Los ácidos y las sales del nitrógeno forman peligrosos aerosoles, que pueden
ser "limpiados" por la lluvia y llevados al suelo. Una vez allí, participan
en el ciclo de N2, nitrificando los vegetales. Desde este punto de
vista, es útil su formación, pero como el NO2 permanece en la atmósfera
durante un promedio de tres días, en este tiempo puede causar graves intoxicaciones
si se acumula en proporciones peligrosas.
|
CUADRO V.5 Índice metropolitano de la calidad del
aire (IMECA). Nivel aproximado de contaminantes
|
||||||||
|
|
||||||||
|
Nivel aproximado de contaminantes ( ppm )
|
||||||||
|
|
||||||||
|
Partículas
|
SO2
|
CO
|
O3
|
NO2
|
Medidas a tomar por niveles |
|||
|
|
Efecto en la
|
desfavorables de dispersión ( SEDUE )
|
||||||
|
IMECA
|
24 h mg/m3
|
24 h
|
8 h
|
1 h
|
1 h
|
salud ( PSI )
|
||
|
|
||||||||
|
100
|
275
|
0.18
|
13
|
0.1
|
0.2
|
Insalubre
|
Sintomas de
|
Vigilancia las 24 h del día de los
|
|
irritación en las
|
niveles de contaminación
|
|||||||
|
personas sanas
|
||||||||
|
200
|
420
|
0.35
|
21
|
0.21
|
0.7
|
Muy
|
Disminución de
|
Implantar el primer nivel de
|
|
insalubre
|
la tolerancia al
|
reducción de emisiones de fuentes
|
||||||
|
ejercicio físico
|
industriales (promedio30%)
|
|||||||
|
300
|
600
|
0.56
|
31
|
0.35
|
1.15
|
P
|
Aumento
|
Implantar el segundo nivel de
|
|
E
|
prematuro de
|
reducción de emisiones de fuentes
|
||||||
|
400
|
790
|
0.78
|
41
|
0.45
|
1.6
|
L
|
varias
|
industriales (promedio50%)
|
|
I
|
enfermedades
|
|||||||
|
500
|
950
|
1
|
50
|
0.6
|
2
|
G
|
Muerte
|
Implantar el tercer nivel de
|
|
R
|
prematura de
|
reducción de emisiones de fuentes
|
||||||
|
O
|
enfermos ancianos
|
industriales (promedio70%)
|
||||||
|
|
||||||||
El más nocivo es, sin duda, el monóxido, CO. Es un veneno letal, pues interfiere en el transporte del oxígeno a las células del organismo.
La hemoglobina de la sangre toma el oxígeno del aire alveolar:
|
O2 + hemoglobina
|
|
peor si allí existe CO, esté
puede tomar el lugar del oxígeno:
|
|
CO + hemoglobina
|
Lo grave es que la carboxihemoglobina es 140 veces más estable que la oxihemoglobina,
así que las moléculas de hemoglobina que se combinan con CO quedan inútiles
para el transporte de oxígeno, pues ese monóxido de carbono bloquea la entrada
de O2. Conforme las moléculas de hemoglobina son inhabilitadas por
el CO, no les es posible transportar O2 a las células y sobreviene
la muerte por asfixia.
|
El CO es incoloro e inodoro pero venenoso
|
Una concentración de 30 ppm de CO durante 8 horas basta para provocar fuerte
dolor de cabeza y náuseas (Cuadro V.6).
|
CUADRO V.6 Efecto del CO (%)
|
||||
|
|
||||
|
Concentración de CO
|
||||
|
en el aire
|
100 ppm
|
200 ppm
|
1 000 ppm
|
10 000 ppm
|
|
|
||||
|
% de moléculas de
|
17
|
20
|
60
|
90
|
|
hemoglobina bloqueadas
|
con la aspiración prolongada
|
|||
|
sobreviene la muerte
|
||||
|
|
||||
Es normal que en las grandes ciudades se tengan niveles prolongados de 30 ppm
o más en las calles transitadas, pues una fuente de CO es la combustión realizada
en los automóviles.
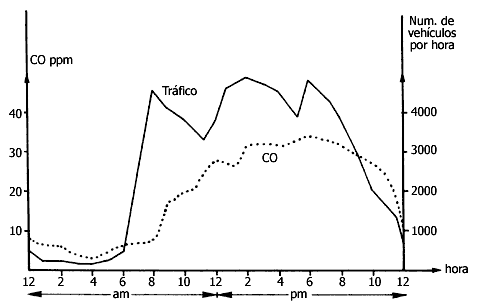
Figura V.9. Definitivamente, hay relación entre el CO atmosférico y el tránsito
de vehículos.
Cuando los autos no tienen ningún control para reducir la emisión de CO, por cada 100 litros de gasolina quemada se generan unos 30 gramos de monóxido de carbono.
En 1982 ocurrió una intoxicación masiva notable en la ciudad de México, cuando cientos de coches querían salir al mismo tiempo de un estacionamiento subterráneo. La emisión de CO y la lentitud del sistema de cobro propiciaron lo que pudo convertirse en una catástrofe, de no ser porque el cobrador resolvió dejar salir a los vehículos sin pagar.
El otro óxido de carbono, el CO2, es el contaminante en mayor proporción en la atmósfera. Sus efectos no son tan graves como los del monóxido, y como la propia naturaleza logra eliminarlo eficazmente, no causa ningún problema agudo de contaminación.
Los vegetales controlan el nivel de CO2 en la atmósfera al emplearlo
para sintetizar carbohidratos:
| 6CO2 + 6 H2O |
|
C6H12O6 + 6O2 |
| |
|
|
Si el proceso de fotosíntesis se detuviera, bastarían 2 000 años para que desapareciera todo el oxígeno de la atmósfera.
Recientemente ha preocupado el hecho de que la cantidad de CO2
en la atmósfera parece ir en aumento, como se observa en la cuadro V.7.
|
CUADRO V.7 Aumento de la cantidad de CO2
en la atmósfera
|
|
|
|
|
|
Año
|
CO2
|
|
|
|
|
1900
|
296 ppm
|
|
1980
|
320 ppm
|
|
|
|
La razón de ello es que el CO2 absorbe fácilmente la radiación calorífica
que la Tierra emite debido a la entrada de los rayos solares a su superficie.
A este fenómeno se le conoce como "efecto de invernadero", pues el vidrio o
plástico de un invernadero cumple la función de no permitir la salida del calor,
con lo que se logra que aun en lugares fríos puedan cultivarse plantas tropicales.
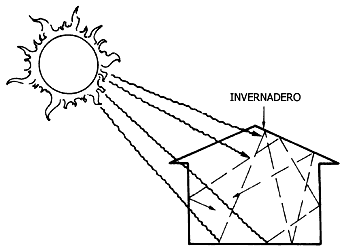
Figura V.10. Efecto de invernadero.
Así, se teme que si sigue creciendo el nivel de CO2 atmosférico,
el calor empiece a acumularse en la Tierra, y que la temperatura del planeta
aumente hasta hacerlo inhabitable, derritiéndose antes los casquetes polares
y aumentando la altura del nivel del mar en varios metros.
|
El transporte, una de las mayores fuentes de óxidos
de carbono
|
Las reacciones de formación de CO y CO2 a partir de gasolina (octanos),
junto con sus cocientes volumétricos de oxígeno a combustible, son:
| Relación |
|
| |
(O2/ C8
H18) |
| 2C8 H18
+ 25O2 |
12.5 |
| 2C8
H18 + 17O2 |
8.5 |
Así, cuando la gasolina se quema con poco aire, tiene lugar preferentemente
la segunda reacción, mientras que si existe exceso de aire se produce la primera.
De esta forma, es recomendable que el pistón reciba más de 12.5 moléculas de
O2 por cada molécula de gasolina. Así, es mínimo el CO producido.
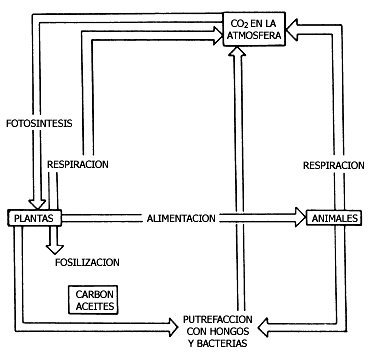
Figura V.11. Ciclo del carbono. El CO2 atmosférico se elimina
el en proceso de fotosíntesis de las plantas. Por ello es indipensable dejar
intactas grandes áreas arboladas en las ciudades.
Los coches, camiones y aviones cuentan, desde hace pocos años, con mecanismos para reducir la emisión de contaminantes. Estos son, entre otros:
· Reductor de emisiones de óxidos de nitrógeno
· Motor que funciona con gasolina sin plomo
La altura de la ciudad de México sobre el nivel del mar (2 240 m) origina que la cantidad de oxígeno por cada metro cúbico de aire se reduzca de 275 g a 212 g. Los motores de los autos están diseñados para operar al nivel del mar y la reducción del oxígeno atmosférico afecta su funcionamiento y los hace más contaminantes.
Se estima que la contaminación producida por los 2.5 millones de automóviles en la ciudad es equivalente a la que producirían 6.3 millones de vehículos al nivel del mar. De ahí la importancia de acciones, aunque aisladas, como la de "hoy no circula".
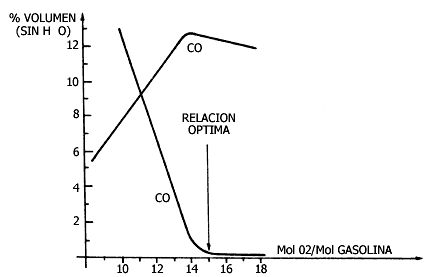
Figura V.12. Contaminantes producidos por la gasolina
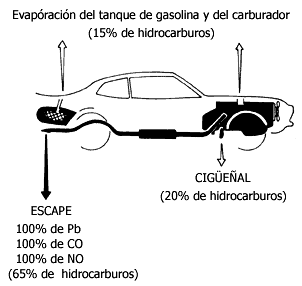
Figura V.13. Fuentes de emisión de contaminantes de un automóvil.
|
|
Ya se mencionó que la presencia de hidrocarburos en el aire conlleva la formación de peligrosos contaminantes secundarios, como el NPA.
En las ciudades, la mayor fuente de hidrocarburos proviene de la evaporación de la gasolina. Varios hidrocarburos aromáticos son cancerígenos (su inhalación provoca muerte por cáncer a los ratones de laboratorio).
|
La gasolina se escapa de cuatro partes del coche:
carburador, escape, cárter y tanque. La mitad de los hidrocarburos se
escapan debido a la mala afinación
|
Los hidrocarburos no saturados, como el etileno, intervienen en las reacciones
fotoquímicas que crean el esmog, ya que producen aldehídos:
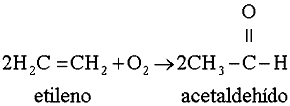
Su presencia en la atmósfera se debe a la adición de tetraetilo de plomo en las gasolinas (para elevar su octanaje). Dentro del pistón, debido a la alta temperatura, se forma el óxido de plomo, PbO2. Como éste es un sólido no volátil, que daña las bujías, a la gasolina también se le adicionan algunos hidrocarburos dorados, para que se forme PbCl2, que sí es volátil, y salga del pistón, hacia la atmósfera.
El plomo y sus sales son tóxicos para el organismo y llegan a afectar el sistema
nervioso central. Afortunadamente, el cuerpo humano logra deshacerse de unos
230 mg de plomo cada día, pero si la cantidad que
entra es mayor, se acumula y provoca intoxicación.
|
Pb: puede entrar en el organismo a través de la
piel
|
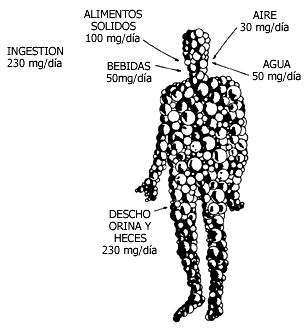
Figura V.14. Ingestión y desecho de Pb en un ser humano.
El ozono, O3, es el gas picante e irritante que a menudo se percibe cerca de los motores eléctricos. Ya mencionamos que se forma en la atmósfera baja debido a reacciones fotoquímicas, de manera que es un contaminante secundario.
Sin embargo, como parte de la estratosfera, nos es indispensable para detener los rayos ultravioletas que provienen del Sol.
|
El ozono es un escudo protector de la vida
|
Recientemente se ha descubierto que ciertos compuestos producidos por el hombre
llegan a la estratosfera y pueden destruir el ozono. Se trata de los cloro fluoralcanos,
también conocidos como freones:
| CCl2 F2
|
CCl3 F |
| freón 12 |
freón 11 |
los cuales se han venido usando como líquidos refrigerantes e impulsores en
latas de aerosoles. Como son muy volátiles e inertes, permanecen entre 10 y
30 000 años en la atmósfera, por lo que llegan a difundirse hasta la estratosfera,
donde se localiza la capa de ozono. Allí reaccionan fotoquímicamente y producen
átomos de cloro:
Ese cloro estratosférico destruye el ozono:
| CI · + O3
|
|
| CIO · + O |
|
| |
|
| suma |
O + O3 |
Se ha estimado que si el ozono estratosférico se redujera en 1%, habría 2% más casos de cáncer en la piel, debido a la mayor cantidad de rayos ultravioleta que llegarían a la superficie de la Tierra.
Desde fines de los años setenta, se detecta cada año, durante los meses de septiembre y octubre, una disminución drástica de la concentración de ozono estratosférico sobre la Antártida, a la que se denomina desde entonces el "hoyo de ozono".
De acuerdo con la interpretación más aceptada, en el invierno del hemisferio sur se forma un cinturón de vientos en la estratosfera, a 66 grados latitud sur. Al llegar la primavera, ese vórtice aísla el aire sobre el Polo Sur y evita la entrada del más cálido proveniente de las latitudes medias. La temperatura reducida permite la activación de los productos químicos clorofluorados que destruyen el ozono.
El hallazgo reciente (Nature, 16 de noviembre de 1989) es que existe también un anillo de bajo ozono alrededor del hoyo antártico, según indican los resultados de diversos vuelos de medición realizados desde la base de Punta Arenas, Chile.
Si el estudio posterior verifica tal pérdida de ozono alrededor del hoyo, los científicos habrán de estudiar sus causas y mecanismos. Recordemos que la vida en la Tierra pudo originarse y podrá persistir gracias a esta capa estratosférica protectora.
Para finalizar, revisaremos brevemente la contaminación de polvos suspendidos.
Cuando una partícula pequeña (o, en general, cualquier otro cuerpo sólido) cae en el aire, inicialmente se acelera, pero en virtud de una fuerza de resistencia alcanza después una velocidad constante, llamada velocidad terminal.
|
En el vacío todos los cuerpos caen acelerados, pero
esto no sucede cuando caen en el aire
|
Cuanto más pequeña es la partícula, su velocidad terminal es menor. Por ejemplo, una que tuviera radio de 1 mm necesitaría dos horas y media para caer 30 cm (en aire inmóvil). En pocas palabras, estos polvos finos se encuentran suspendidos en el aire, forman parte de él, y esa mezcla aire-partículas es un aerosol.
Al respirar, muchas partículas entran por nuestros orificios nasales. Sin embargo, podemos sobrevivir gracias a un eficaz mecanismo eliminador en nuestro sistema respiratorio. La mayor porción de las partículas es detenida antes de llegar a los alveolos. No obstante, las que tienen diámetros menores que 5 mm pueden llegar hasta el espacio alveolar y depositarse. Allí existen células "limpiadoras" que se mueven para englobar el polvo extraño y transportarlo hasta los ganglios linfáticos. La partícula puede disolverse en los líquidos celulares y distribuirse por el organismo, pero si no es soluble permanece en el pulmón o en el sistema linfático, produce inflamaciones y, cuando se acumulan, llegan a provocar dificultades respiratorias y cardiacas.
En especial, las partículas que contienen sílice o metales son las más peligrosas.
Así, lo importante para evitar la contaminación por polvos es no enviar a la atmósfera las partículas con diámetros pequeños (menores de 7 mm).
Para detectar la fuente de polvos en una fábrica se aprovecha el efecto de
Tyndall, para lo que se usa una luz intensa portátil sobre un fondo oscuro.
Una vez localizada la emanación de polvos, puede usarse (entre otros) algunos
de los equipos que se describen en las figuras V.15, V.16 y V.17.
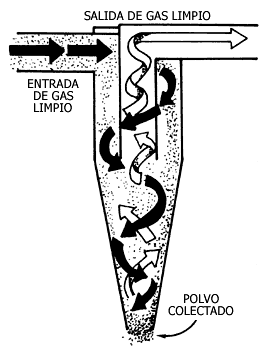
Figura V.15. Ciclón. La trayectoria espiral envía a las partículas
a los lados, de donde caen.
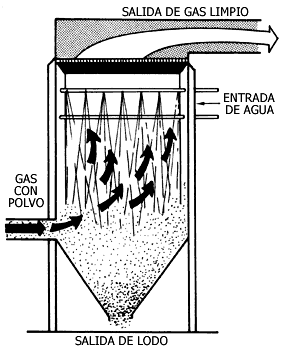
Figura V.16. Colector húmedo. El agua se atomiza en una regadera que
absorbe impurezas.
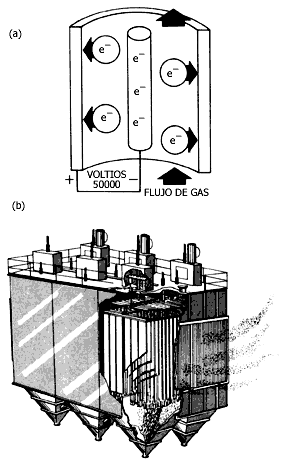
Figura V.17. Precipitador electrostático. Las partículas sólidas adquieren
carga eléctrica y "se pegan" a la pared.
Creemos oportuno concluir este capítulo con tres pasajes tomados del libro de Ortiz Monasterio. Esperamos que hagan reflexionar al lector.
· Si alcanzamos el imperioso equilibrio armónico entre nosotros mismos y el medio ambiente, se vislumbran años en que, utilizando la actual tecnología, podrán ser satisfechas las necesidades de: comida, habitación, empleo, educación, arte y permanente recreación en un medio natural. Si mantenemos nuestro actual comportamiento habremos estimulado el desequilibrio y la aterradora destrucción de la humanidad.
· En este mundo de extremas contradicciones te pido que te detengas, que reflexiones, que no te confunda la ilusión del progreso ni que te arrolle la masa.
· Nuestros problemas, entre ellos el de la contaminación ambiental, tienen solución, pero pronto no la tendrán.
Una vez concluido el ejemplo atmósferico, termina también esta segunda parte y, con ella, este intento de divulgación de la química terrestre.
Al lector valiente que haya llegado hasta aquí, además de agradecerle su paciencia, le deseamos que se lleve un corolario con dos ideas centrales:
1) Muy recientemente se han desarrollado nuevas teorías y nuevo conocimiento sobre el origen de la materia que puebla nuestro Universo, Sistema Solar, Tierra y país. Como la ciencia es una búsqueda interminable, aún no sabemos todas las respuestas. Es más, en México se ha hecho muy poco por estudiar el entorno que nos es propio. Estamos ante un asunto donde queda casi todo por hacer. ¡Tú, lector, puedes ser parte activa de este proceso de conocimiento!, cuyo objetivo es tomar mejores decisiones, por el bien de todos.
2) Si hemos y habremos de habitar este planeta, es indispensable conocerlo mejor, para convivir mejor con él y en él. La química nos ayuda a hacerlo y es nuestra aliada para este propósito. No es simplemente algo que nos fuerzan a estudiar en la escuela. Es parte de la cultura imprescindible de todo ciudadano. De otra manera, siempre serán otros los que tomen las decisiones por nosotros.
"Acuerdo que establece los lineamientos para determinar el criterio que servirá de base para evaluar la calidad del aire en un determinado momento", Secretaría de Salubridad y Asistencia, Diario Oficial, México, 29 de noviembre de 1982.
Bermúdez, G., "Patología urbana y enfermedades del campo", Información Científica y Tecnológica, 15 (abril de 1983).
Brill, W. J., "Fijación biológica del nitrógeno atmosférico", Ciencia y Desarrollo 17, 30 (noviembre-diciembre de 1977).
"Control de polvos tóxicos en la industria", Investigación Científica y Tecnológica, 25 (15 de marzo de 1981).
Chávez, E. A., "La crisis ambiental en México", Ciencia y Desarrollo 27, 30 (julio-agosto de 1979).
Ecología. 100 acciones necesarias, Comisión Nacional de Ecología, México, 1987.
Gay, C., La atmósfera que nos rodea. Nuestro hogar en el espacio, colección "La Ciencia para todos", 66, FCE, México, 1988.
Informe general de ecología, Comisión Nacional de Ecología, México, noviembre de 1988.
Legorreta, J., y M. A. Flores, "Crónica de un desastre anunciado", Siempre, 47 (12 de febrero de 1986).
"Ley federal de protección al ambiente", Diario Oficial, México, 11 de enero de 1982.
Lizárraga, J. A., "La destrucción de la capa de ozono", Ciencia y Desarrollo 25, 123 (marzo-abril de 1979).
Madras, M., et al., Química. Curso preuniversitario, McGraw Hill, México, 1980, p. 85.
Organización Mundial de la Salud, Contaminación de la atmósfera, OMS, Ginebra, 1962.
Ortiz Monasterio, F., Introducción al estudio de la contaminación en la nave espacial Tierra, Kaleidoscopio, México, 1973.
Páramo, V. H., et al., "Acidez de las precipitaciones en el D.F.", Ciencia y Desarrollo 72, 59 (enero-febrero de 1987).
Scientific American, "La biosfera", Alianza Editorial, Madrid, 1980.
Velasco, L. A., et al., "Sistema automático de adquisición de datos meteorológicos", Comunicaciones Técnicas del IIMAS, UNAM, 1981.
Velasco, L. A., "La contaminación atmosférica en la ciudad de México", Ciencia y Desarrollo 52, 59 (septiembre-octubre de 1985).