I. LA NATURALEZA Y SU EVOLUCIÓN QUÍMICA
LA TIERRA, planeta que habitamos, no es más que un gran conjunto de mezclas de sustancias químicas. La materia en ella existía, como lo han demostrado los geólogos, desde hace 4 500 millones de años.
Pero, ¿cómo y cuándo se formó la Tierra?, ¿y nuestro Sol?, ¿y la Vía Láctea con sus 200 000 millones de estrellas?, ¿y las otras galaxias?
Además, ¿de dónde provino toda la materia que forma el Universo?, ¿cómo y cuándo se formaron los elementos químicos y sus átomos?, ¿y la vida?, ¿somos los únicos?
Todas estas preguntas inquietan al hombre. Su raciocinio le induce a reflexionar acerca de su origen y el de todas las cosas.
EVIDENCIA DEL ORIGEN COMÚN DE LOS ELEMENTOS
Actualmente, la ciencia ha permitido al género humano encontrar respuesta a algunas de esas interrogantes. Tal vez no todas sean totalmente correctas, pero las evidencias actuales indican que parecen ser acertadas aunque podrían ser modificadas en el futuro, a la luz de nuevas concepciones y de nueva información.
Desde luego, no podemos viajar al pasado para buscar el origen de la materia. No obstante, en el Universo actual hay indicios que nos permiten plantear hipótesis relativas a lo que sucedió muchos años atrás.
Además de conocer la superficie terrestre, hemos podido analizar meteoritos y tenemos ya muestras lunares y marcianas. Por otra parte, el análisis de la luz de las estrellas nos ha revelado su composición química.
Los átomos de cada elemento químico y las moléculas que dichos átomos forman
se manifiestan de manera distinta, y por ello hemos podido reconocerlos a distancias
enormes, gracias a la astrofísica y a la cosmoquímica.
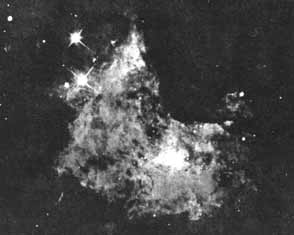
Figura I.1. Parte central de la nebulosa de Orión
Por otra parte, en el núcleo atómico se encuentra otra característica de cada elemento: su número de protones.
Recordemos que el núcleo está formado esencialmente por neutrones y protones,
estos últimos con una carga eléctrica positiva. Los átomos de un mismo elemento
tienen el mismo número de protones en el núcleo, aunque el de neutrones puede
variar. Por ello acostumbramos definir al núclido de la siguiente forma: es
un átomo con un número característico de protones y de neutrones.
Para referirse a un núclido determinado, se acostumbra emplear el símbolo químico
del elemento correspondiente y colocar a su izquierda dos cantidades: arriba
su número de masa A (A = número de masa o número de protones + neutrones),
y debajo su número atómico Z (Z = número atómico o número de protones
en el núcleo). Así el número de neutrones N es la diferencia
N = A - Z.
Existen 109 elementos conocidos, con Z desde 1 hasta 109,1![]() pero hay más de 1 300 variedades de núcleos. Cada una de éstas es un núclido.
pero hay más de 1 300 variedades de núcleos. Cada una de éstas es un núclido.
Un hecho sorprendente es que la abundancia de los elementos químicos, e incluso
de sus isótopos, sea similar en todos los objetos conocidos del Universo, una
vez que se toman en cuenta ciertos procesos secundarios. Por ejemplo, es obvio
que los meteoritos que han caído en la Tierra han perdido muchos elementos ligeros,
pero aquellos que se conservan existen en las mismas proporciones que en el
Sol. Asimismo, en la corteza terrestre, o en la lunar, los elementos también
reproducen la abundancia solar.
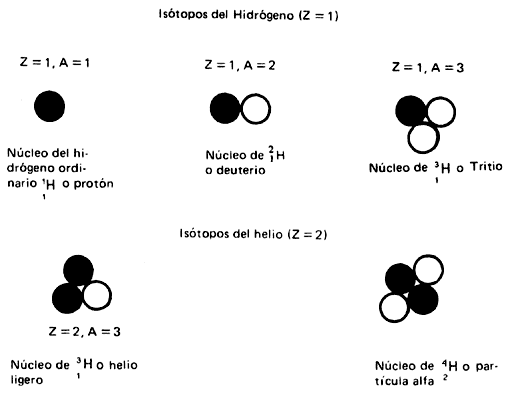
Figura I.2. Isótopos, protones y neutrones se mantienen unidos por el núcleo
gracias a la llamada interacción fuerte o fuerza nuclear. Por ello, para
formar o destruir un núcleo se requiere o se libera una gran cantidad de energía.
Como hemos visto, los átomos de un elemento no son todos iguales. Hay átomos
de hidrógeno, por ejemplo, con 1, 2 o 3 partículas en su núcleo. Desde luego,
en todos ellos hay sólo un protón, y eso es lo que caracteriza al hidrógeno.
Los diferentes isótopos de los átomos no son igualmente estables ni ocurren
en la naturaleza con la misma posibilidad. Por ejemplo, de cada 100 000 átomos
de hidrógeno, 99 985 son de ![]() y15 son de
y15 son de ![]() .
.
Los de tritio ![]() son inestables
y, por tanto, casi no se encuentran libres en la naturaleza. Por ejemplo, el
boro tiene dos isótopos muy estables, pero no ocurren con la misma abundancia.
De cada 10 000 átomos de boro 1 978 son de
son inestables
y, por tanto, casi no se encuentran libres en la naturaleza. Por ejemplo, el
boro tiene dos isótopos muy estables, pero no ocurren con la misma abundancia.
De cada 10 000 átomos de boro 1 978 son de ![]() y 8 022 son de
y 8 022 son de ![]() .
.
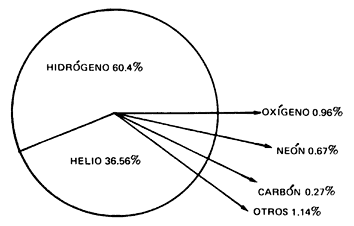
Figura I.3. Abundancia relativa de los elementos del Universo
(% en masa)
¿Por qué aparecen con esta abundancia? y ¿por qué sucede lo mismo en la Tierra, en el Sol o en cualquier otro lugar del Universo?, ¿por qué se repite este hecho para otros muchos elementos?
Por si fuera poco, en las estrellas (ya sea de nuestra galaxia, o de otras), así como en el medio interestelar, se ha detectado la presencia dominante del hidrógeno y helio. Los otros elementos se han encontrado en menores proporciones.
Estos hechos sugieren que la formación de los elementos químicos tiene que haber sido común para todo el Universo. Es decir, existió un origen común de toda la materia.
Todo hace pensar a los cientificos que hace unos 15 000 millones de años, la materia, que se encontraba concentrada con altísima densidad y temperatura, explotó violentamente. La explosión provocó su expansión y enfriamiento graduales.
Hace más de 60 años, en 1923, el astrónomo Hubble demostró que las galaxias se alejan unas de otras como los puntos trazados sobre un globo que se infla.
Vivimos, pues, en un universo en expansión. En 1946, George Gamow propuso que, retrocediendo en el tiempo, debió existir un momento en que toda la materia estuviera concentrada. Según Gamow, en la gran explosión se sintetizaron los elementos químicos en las proporciones actuales (en esto se equivocó, como veremos). Hasta 1965 no existió ninguna prueba de la ocurrencia veraz de la gran explosión.
Medio segundo después de la explosión,2![]() la materia no tenía su apariencia actual. Existía como partículas aisladas de
materia y antimateria interactuando continuamente entre sí y con la radiación.
Después, la temperatura de la "sopa" de materia y radiación era de unos 1010
K (10 000 millones de grados Kelvin). Se habían formado ya electrones, protones
y neutrones.
la materia no tenía su apariencia actual. Existía como partículas aisladas de
materia y antimateria interactuando continuamente entre sí y con la radiación.
Después, la temperatura de la "sopa" de materia y radiación era de unos 1010
K (10 000 millones de grados Kelvin). Se habían formado ya electrones, protones
y neutrones.
|
En la antimateria las partículas tienen la carga
opuesta a las de la materia; así, el positrón, el equivalente
del electrón, tiene carga positiva
|
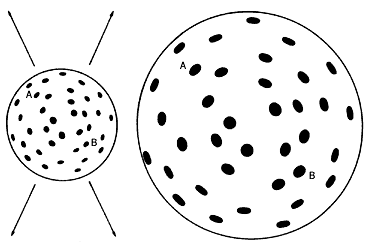
I.4. La gran explosión. Las galaxias se alejan unas de las otras.
LA FORMACIÓN DE LOS NÚCLEOS DE HIDRÓGENO Y HELIO
Las colisiones entre protones dieron lugar a los primeros núcleos con más de una partícula, los cuales se estabilizaron cuando la temperatura se redujo a 109 K.
Unos minutos después de la explosión, el Universo contenía ya una buena proporción de helio (entre 25 y 30% en peso). Sin embargo, como continuó la expansión y el enfriamiento, no fue posible que más partículas se adicionaran a los núcleos de helio para formar cantidades apreciables de elementos más pesados, como litio (Z = 3), berilio (Z = 4), boro (Z = 5), carbón (Z = 6), etcétera.
A temperaturas tan altas, los electrones existentes no permanecían ligados a los núcleos por atracción eléctrica. Ello sólo pudo ocurrir cuando el enfriamiento posterior alcanzó los 5 000 K. Entonces, los núcleos de hidrógeno y helio se vieron rodeados de sus electrones, y de esta manera se formaron los primeros átomos eléctricamente neutros. A partir de este momento dejó de existir la interacción frecuente, que había venido dándose entre las partículas y la radiación, la cual quedó "libre" para viajar por todas partes.
|
500 000 años después de la gran explosión se habían
formado, por fin, átomos de hidrógeno y helio
|

Figura I.5 El ciclo protón-protón es un mecanismo por el cual se sintetizaron
los núcleos de helio a partir de protones.
En 1965, casi por casualidad, los astrofísicos Penzias y Wilson, quienes buscaban
posibles interferencias a las transmisiones vía satélite, se encontraron con
una radiación que llegaba a la Tierra desde todas las direcciones. Esta se denominó
"radiación cósmica de fondo" y constituye la mayor prueba de la veracidad de
la gran explosión.
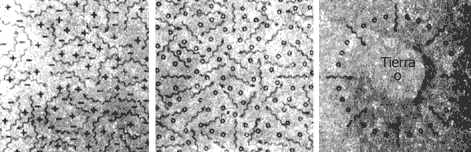
I.6. Radiación de fondo. Según la teoría de la gran explosión (izq.), el
Universo primitivo estaba lleno de protones y electrones que absorbían y emitían
radiación. Tras medio millón de años (centro), al formarse átomos estables,
la radiación no fue absorbida o emitida con tanta frecuencia y quedó libre en
el espacio. Esta radiación aún se difunde y fue detectada desde la Tierra (der.)
en 1965, lo cual confirió gran credibilidad a esta teoría.
¿Qué sucedió entonces para que se formaran los elementos más pesados que el helio en las proporciones actuales? Es un hecho que los elementos más pesados se forman en las estrellas.
GÉNESIS QUÍMICA EN UNA ESTRELLA
Unos 100 mil millones de años después de la gran explosión comenzaron a formarse las galaxias y, en su interior, gracias a los efectos de la gravedad, también la primera generación de estrellas.
Debido a que poseen masa, los cuerpos tienen la propiedad de atraerse mutuamente. Las estrellas nacen cuando una nube de gases se compacta por efecto de la gravedad. La fuerza de gravedad comprime los gases y los calienta, lo cual provoca que su presión se incremente.
En nuestra atmósfera, por ejemplo, ambas fuerzas están perfectamente equilibradas, es por ello que pese a la atracción terrestre, la atmósfera no cae al suelo.
En una estrella en formación o protoestrella, la gravedad domina, la nube de gases toma forma esférica y al comprimirse, su centro se calienta cada vez más; hasta este momento, la única fuente de energía es la contracción gravitatoria. Pero cuando la temperatura alcanza los 10 millones de grados, entra en juego el segundo recurso energético del que dispone la estrella: la fusión de protones para producir helio, que es un fenómeno similar al que ocurrió minutos después de la gran explosión. La fusión del hidrógeno es la fuente de energía más duradera y estable de las estrellas, pues la presión y la gravedad se equilibran. En esta etapa se encuentra nuestro Sol, el cual "quema hidrógeno como combustible". No obstante, su vida durará aproximadamente 5 000 millones de años más.
Con el tiempo, el corazón de la estrella se va enriqueciendo de helio y, por ello, el hidrógeno escasea. Cada vez es más improbable la fusión del hidrógeno, por lo que en el centro estelar cesa la generación de energía. El equilibrio previo entre la presión del gas (hacia afuera) y la gravedad (hacia adentro) toca a su fin. La gravedad gana la batalla y comienza a reducirse el corazón de la estrella.
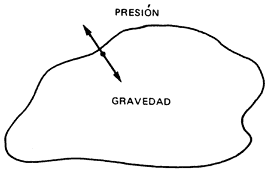
Figura I.7. Presión y gravedad. En una estrella presión y gravedad son fuerzas
que actúan en sentido inverso.
El Sol es una fábrica en la que cada segundo 600 millones de toneladas de H
se convierten en He. Con un diámetro de 1.4 millones de km, equivalente a poner
109 Tierras en fila, la temperatura de su superficie asciende a 6 000° C, pero
se calcula que en el centro es de 15 millones de grados.
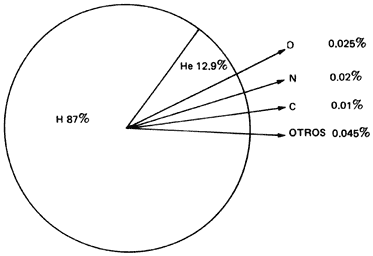
Figura I.8. Composición química actual del Sol (% de átomos)
|
El helio lleva este nombre porque se descubrió en
el Sol (helios en griego) antes que en la Tierra
|
LA SÍNTESIS DEL CARBONO AL HIERRO
La compresión gravitatoria eleva la temperatura de la estrella, con lo que pueden ocurrir nuevas reacciones de fusión. La más común es la transformación de helio en carbono, un núcleo con seis protones y seis neutrones.
Una vez que todo el helio del centro se ha convertido en carbono (Figura 1.9),
la estrella vuelve a contraerse hasta alcanzar temperaturas de más de 100 millones
de grados, a las que pueden ocurrir otras reacciones nucleares que convierten
al carbono en elementos más pesados, como oxígeno, nitrógeno, neón, etc. Así
se sintetizan todos los elementos químicos hasta llegar al hierro Fe (Z = 26
A = 56), donde el proceso se detiene.
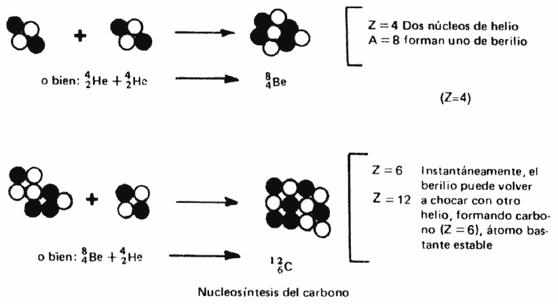
I.9. Nucleosíntesis del carbono. Aunque el Be es muy inestable, se ha detectado
en las estrellas en ínfima catidad, lo que apoya la realidad de este esquema.
|
El carbono, C, átomo indispensable para la vida,
tuvo su origen en las estrellas
|
Obviamente, llega un momento en que el hierro ocupa el centro de la estrella
y concluye su fuente de energía nuclear. La gravedad vuelve a dominar y la estrella
se contrae más y más. Si su masa es pequeña (como la del Sol o un poco mayor),
la contracción se detiene, formándose una estrella enana blanca, que
al enfriarse deja de emitir luz (enana negra).
|
En una enana blanca la densidad es tan enorme que
un cm3 pesa tanto como un camión
|
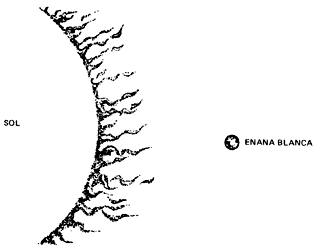
Figura I.10. Comparación del Sol con una enana blanca.
El núcleo de hierro es el más pesado que puede obtenerse de esta forma. Cualquier combinación de dos núcleos para obtener un elemento más pesado que el hierro requiere energía, en lugar de producirla. Pero si la masa de la estrella es grande (varias veces la del Sol), la contracción no puede detenerse. Los núcleos de hierro y los electrones en el corazón de la estrella se transforman en neutrones libres, los cuales logran detener el colapso. Sin embargo, las capas exteriores se precipitan hacia el centro generando tal temperatura y presión que se crea una onda de choque hacia afuera. La explosión, conocida como supernova, es tan energética que logra que uno, dos y hasta más de cien neutrones se adicionen a los núcleos de hierro, formándose así los elementos con más de 26 protones.
Todos los elementos sintetizados se desparraman por el espacio como polvo estelar,
esperando el día en que la gravedad vuelva a formar otra estrella. De hecho,
nuestro Sol es una de ellas: una estrella de segunda generación, pues
contiene buena proporción de elementos pesados que no se sintetizaron allí sino
en otras estrellas.
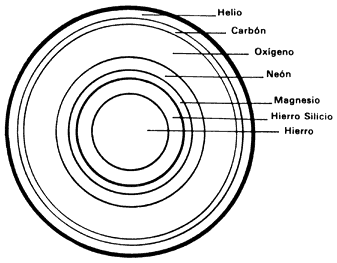
Figura I.11. Estructura de una estrella. Las estrellas adquieren una estructura
de capas, a la manera de una cebolla, con un centro de hierro y múltiples
reacciones ocurriendo a todos niveles. En esta figura se muestra un ejemplo
de composición de una estrella que ha "quemado" todo su hidrógeno.
|
La síntesis de elementos con más de 26 protones sólo
es factible suministrando energía. Ello ocurre en explosiones estelares.
|
Debido a la explosión, la estrella pierde mucha masa, pero su centro de neutrones
sobrevive, y queda como una estrella de neutrones. Finalmente, si la estrella
es lo bastante pesada, la contracción continúa indefinidamente. No parece haber
nada que la detenga. ¿Qué sucede después? Se supone que se forma un hoyo
negro, de donde ni siquiera la luz puede salir.3![]()
|
En una estrella de neutrones la densidad es tal
que un cm3 pesa unos ¡500 millones de toneladas!
|
LA TIERRA Y SU COMPOSICIÓN QUÍMICA
Los científicos están de acuerdo en que hace unos 4 500 millones de años nuestro Sol y todos sus planetas se formaron a partir de una nube de gases y polvo estelar. Sin embargo, su composición actual no es igual a la inicial. Por una parte, el Sol se ha venido enriqueciendo en helio, debido a las reacciones nucleares de fusión. Por otro lado, en la Tierra, debido a su (relativamente) pequeña masa, los elementos más ligeros han ido escapándose de su atracción gravitatoria. Además, el lento proceso de su enfriamiento, la gran actividad interna, los efectos climáticos y la presencia misma de la vida han hecho que la Tierra actual no sea muy semejante al planeta primitivo.
Uno de los modelos para explicar la formación de la Tierra y de los otros planetas propone el desarrollo de una nebulosa solar primitiva con una masa algo mayor que la actual del Sol, concentrada alrededor del eje de giro, pero que todavía no puede reconocerse como el Sol. Los planetas se formaron por la acumulación de granos interestelares y, en el caso de los planetas exteriores, por la atracción y adherencia de gases. Este proceso causó un calentamiento, con lo que una capa de hierro fundido se depositó en el centro, como sucedió en el caso de la Tierra.
Nuestro planeta se encuentra formado principalmente por silicatos (piedras,
compuestos de silicio, Si, y oxígeno, O) y Fe metálico. Es importante hacer
notar que en la Tierra ciertos elementos están presentes en cantidades completamente
diferentes de las del resto del Universo. Así, en nuestro planeta prácticamente
no hay H ni He y el C y N (nitrógeno) son poco abundantes. Los gases nobles
neón, Ne, kriptón, Kr y xenón, Xe son aún más escasos.
|
CUADRO I.1 Manuel Peimbert, astrónomo mexicano |
|
|

|
|
Figura I.12. Manuel Peimvert, astrónomo mexicano. |
El doctor Peimbert trabaja en el Instituto
de Astronomía de la UNAM y es el astrónomo mexicano más
citado por sus colegas de todo el mundo. Sus contribuciones más
recientes se han centrado en la evolución química de las
galaxias. En ellas, además de miles de millones de estrellas,
existe el llamado "gas interestelar". Peimbert se ha dedicado
ha estudiar cómo evoluciona la composición química
de este gas. A partir de este gas interestelar se forman las estrellas y éstas, durante su evolución, transforman en su interior los elementos químicos a partir de reacciones nucleares. Posteriormente pierden materia con una composición química diferente de la inicial, lo que modifica la composición química del medio interestelar. Existen tres fuentes principales que afectan la composición del gas interestelar. 1. Supernova. Se producen cuando estrellas de enorme masa hacen explosión al final de su evolución , con lo que se dispersa por el espacio no sólo la masa de la estrella, sino toda su energía. Las supernovas nutren así al medio interestelar de elementos pesados. 2. Nebulosas galácticas. Son masas luminosas de gas lanzadas al espacio por estrellas de masa intermedia al final de su evolución. Las nebulosas galácticas son el producto de un cataclismo y constituyen la materia arrojada al espacio por una nova. 3. Novas. Son estrellas cuyo brillo aumenta intensamente en periodos muy cortos -por ejemplo, en unos días- para luego ir disminuyendo lentemente a lo largo de varias decenas de años hasta recuperar el brillo original. En el proceso se provocan explosiones que lanzan al espacio diferentes porciones de su masa y energía. Se calcula que en nuestra galaxia se producen más de 1 000 novas por año, pero sólo unas cuantas -aproximadamente 20- alcanzan la magnitud de luminosidad suficiente para ser percibidas desde la Tierra. Entre los resultados más importantes obtenidos por el doctor Peimbert y sus colaboradores figuran los siguientes: a) La composición química inicial del gas durante la formación de las galaxias, antes de que se formaran las estrellas, era de un 23% de helio-4 y un 77% de hidrógeno. b) La fuente principal de átomos de carbono-12 y nitrógeno-14 en el gas interestelar proviene de nebulosas planetarias. La formación del helio pregaláctico ocurrió durante la gran explosión y las estrellas han sido responsables de la formación de helio adicional y de todos los elementos más pesados que este elemento. |
|
|
Para explicar tales hechos se ha propuesto que los elementos se condensan formando partículas sólidas microscópicas; posteriormente, debido a colisiones y adhesiones, éstas constituyeron el planeta. De esta manera, la abundancia de compuestos gaseosos en la Tierra sería pequeña.
| Se supone que Mercurio, el planeta más cercano al Sol, tiene mayor cantidad de Fe (en términos relativos) que los demás planetas, mientras que los más lejanos como Júpiter y Saturno se encuentran formados principlamente por agua, H2O, amoniaco, NH3, y metano, CH4, sólidos |
Para que los elementos se condensen en estado sólido es importante conocer la temperatura. Se han hecho diversas estimaciones de este proceso, y se supone que para condensar los silicatos y el de la temperatura de la nebulosa solar en la vecindad de la Tierra debería estar por debajo de 1 500 K. Al disminuir la temperatura se van condensando los demás elementos hasta llegar a los 600 K, que sería la temperatura de la Tierra primitiva (Cuadro I.2). Este proceso, sin embargo, no justifica la presencia del carbón en nuestro planeta, ya que para condensarlo en forma de metano (la molécula más simple con C y H) se requieren menos de 100K.
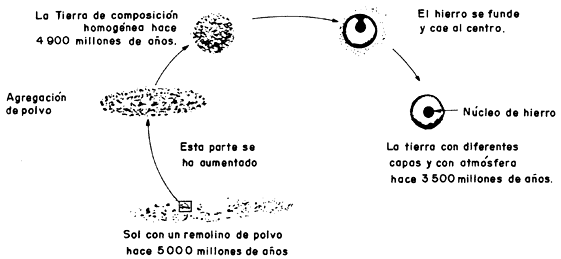
Figura I.13. La formación de la Tierra
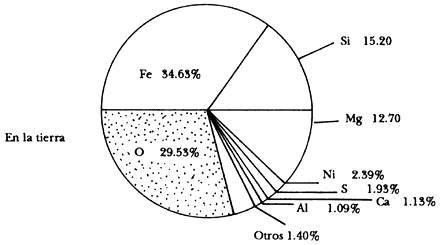
Figura I.14. Abundancia realtiva (en % de masa) de los elementos en la Tierra.
Pero, desde luego, en la Tierra hay C, y para explicarlo se ha sugerido que una vez que el C se combinó con oxígeno para formar CO, este último compuesto habría reaccionado con H2 para producir hidrocarburos, en una reacción del tipo Fischer-Tropsch, así llamada en honor de los químicos alemanes que la desarrollaron. Estas reacciones pueden usarse para producir comercialmente gasolina y otros hidrocarburos. Así, por ejemplo, tenemos:
Estos hidrocarburos de alto peso molecular son estables y sólidos a altas temperaturas.
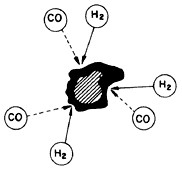
Figura I.15. La reacción Fischer-Tropsch. Una partícula de polvo formada
por silicato hidratado o magnetita, cataliza la reacción de CO y H2
para constituir hidrocarburos pesados, los cuales se depositan sobre la partícula
con lo que adquiere la forma de una sustancia alquitranada.
Si en la reacción de Fischer-Tropsch están presentes NH3 y H2O,
se forman compuestos orgánicos complejos. Así, el nitrógeno y el oxígeno se
incorporarían naturalmente a las breas y alquitranes, convirtiéndose en parte
de la Tierra aun cuando el NH3 y el H2O permanecieran
gaseosos a 600 K.
CUADRO I.2 Temperaturas de condensación en un gas de composición solar en
vías de enfriamiento.4![[Nota 4]](../imgs/mcommnt.gif)
| Temperatura K | Sustancias |
|
|
|
|
1 800-1 500
|
Calcio, aluminio, óxido de titanio, silicatos
|
|
1 450
|
Metal ferroso
|
|
1 400-1 300
|
Silicatos de magnesio
|
|
680
|
Fe + H2S
|
|
500-400
|
3Fe + 4H2O
|
|
160
|
Hielo
|
|
110
|
NH3 · H2O en forma sólida
|
|
60
|
CH4 · 8H2O en forma sólida
|
|
|
|
ESTRUCTURA INTERNA DE LA TIERRA
La estructura interna de la Tierra nos es desconocida. Sin embargo, a partir de estudios sismológicos y geofísicos se ha establecido la idea de que está formada por tres capas principales: la más externa, llamada corteza, que va desde la superficie hasta unos 17 km de profundidad y que comprende la atmósfera (gases), la hidrosfera (agua) y lo que algunos autores denominaron litosfera, que no es más que la parte sólida de la misma capa, formada principalmente por rocas ígneas. Una capa intermedia conocida como manto se extiende aproximadamente 2 900 km por debajo de la corteza y está constituida por silicatos metálicos, principalmente de magnesio, Mg, y Fe, así como por una gran variedad de óxidos y sulfuros metálicos. La capa más interna, lo que llamamos el centro de la Tierra, es el núcleo, formado por Fe y níquel, Ni.
Debido básicamente a diferencias de densidad, tanto el manto como el núcleo pueden subdividirse en dos capas, como se muestra en la figura I.16.
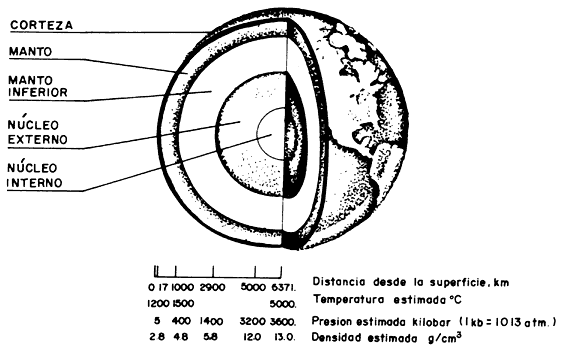
Figura I.16. Estructura interna de la Tierra
ABUNDANCIA DE LOS ELEMENTOS EN LA CORTEZA TERRESTRE
De todos los elementos que constituyen la Tierra, la humanidad sólo tiene acceso directo, por lo pronto, a los de la corteza (Figura I.17). Acerca de algunos de estos elementos, de sus compuestos y reacciones tratará la segunda sección de este libro.

Figura I.17. Abundancia de los elementos en la corteza terrestre
Como lo propuso el científico soviético A. I. Oparin en 1924, hoy se acepta que la vida surgió sobre la Tierra en los primeros tiempos de su historia, al sintetizarse y agruparse diversos compuestos de carbono en la atmósfera y en los océanos de la Tierra primitiva.
Hace unos 160 años ésta habría sido una hipótesis imposible, pues se creía que los compuestos químicos elaborados por los seres vivos eran esencialmente diferentes a los demás existentes en la naturaleza.
|
Las químicas, orgánica e inorgánica, se concebían
"divorciadas"
|
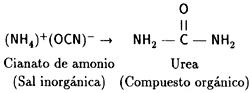
Se suponía que ningún compuesto orgánico podría obtenerse sin la ayuda de un
proceso vital. Sin embargo, en 1828 Federico Wöhler obtuvo el primero de ellos
(urea) a partir de materia inorgánica (cianato de amonio).
A partir de entonces, los compuestos orgánicos de carbono se manejaron ordinariamente en el laboratorio. No obstante, la hipótesis de Oparin acerca de la síntesis espontánea de aminoácidos, que son los componentes de las proteínas y formas primarias de vida en la Tierra primitiva, era demasiado temeraria.
En 1953 se dio la primera muestra de que ello no era imposible: Stanley L. Miller simuló un experimento en las condiciones supuestas para la Tierra hace unos 4 000 millones de años, y obtuvo varios aminoácidos.
Se cree que la atmósfera primitiva estaba compuesta de metano, amoniaco, agua e hidrógeno molecular, que es precisamente la atmósfera de Júpiter y Saturno, salvo que allí el agua está congelada. Las fuentes más abundantes de energía eran la luz ultravioleta, procedente del Sol, y las descargas eléctricas.
Con estos compuestos mezclados en un matraz, Miller obtuvo, en 1953, pequeñas
cantidades de cinco aminoácidos, algunos de ellos esenciales para la vida, como:
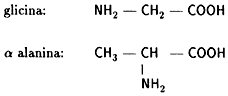 |
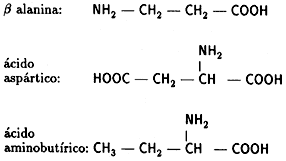 |
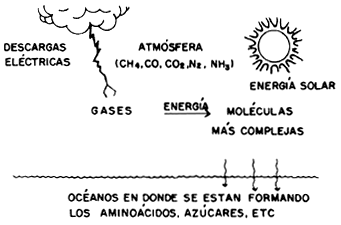
Figura I.18. Esquema del escenario primitivo donde supuestamente se originó
la vida en la Tierra.
También obtuvo muchos otros productos de naturaleza orgánica.
Posteriormente, y como resultado de estas reacciones que simulan las condiciones
originales de la Tierra, se han encontrado varias otras sustancias necesarias
para la vida. Por ejemplo, se han identificado péptidos (hasta de cinco aminoácidos
unidos en la misma cadena), bases púricas y pirimídicas (componentes de los
ácidos nucleicos) y muchos otros.
|
Péptidos: polímero de aminoácidos
|
Es cierto que de la existencia de un conjunto de compuestos orgánicos en los océanos primitivos hasta la formación de moléculas complejas capaces de autorreproducirse (vida), hay un largo trecho. Sin embargo; se cree que ello ocurrió durante unos 600 millones de años, de tal forma que hace unos 3 400 millones de años ya existía vida sobre la Tierra.
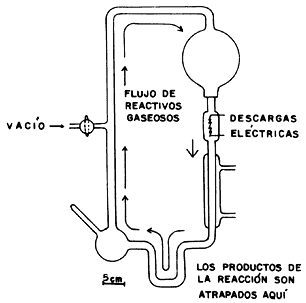
Figura I.19. Aparato de Miller. Se diseñó para investigar las reacciones
químicas en lo que supuestamente era la atmósfera primitiva.
Pero no son estas condiciones externas las únicas capaces de posibilitar la
formación de este tipo de moléculas. De hecho, en una situación prácticamente
opuesta, a bajas temperaturas, en hielo, L. Orgel obtuvo adenina a partir de
ácido cianhídrico. Hoy sabemos que al hacer burbujear ácido cianhídrico, HCN,
a través de una solución de hidróxido de amonio, NH4 OH, este proceso
tan "inusual" parece ser casi inevitable. La fórmula empírica de la adenina,
H5C5N5, corresponde a la de un ácido cianhídrico
pentamérico. Recordamos al lector que la adenina es un compuesto clave en el
código genético.
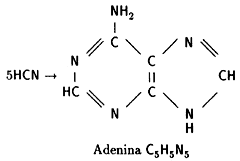
|
Paradójicamente, el HCN, una de las sustancias más
tóxicas para la mayoría de los seres vivos, puede ser la precursora
prebiótica de una de las moléculas más importantes para la vida: la
adenina.
|
En fechas recientes también se sostiene que la misma nube de polvo y gases que dio lugar al sistema solar ya contenía compuestos orgánicos, los cuales se han encontrado en cierto tipo de meteoritos. Asimismo, durante los últimos años la radiotelescopía ha servido para detectar en el espacio interestelar gran cantidad de moléculas, algunas de ellas orgánicas. Se han identificado más de 50 moléculas en el espacio interestelar. Algunas de ellas se presentan en el cuadro I.3.
|
CUADRO I.3 Moléculas en el espacio interestelar
|
|||
|
|
|||
|
|
|
||
|
|
|||
|
H2
|
Hidrógeno
|
HCHO
|
Formaldehído
|
|
CO
|
Monóxido de carbono
|
HCOOH
|
Ácido fórmico
|
|
CS
|
Monosulfuro de carbono
|
CH3OH
|
Metanol
|
|
SiO
|
Monóxido de silicio
|
NH2CHO
|
Formamida
|
|
NO
|
Monóxido de nitrógeno
|
CH3NH2
|
Metilamina
|
|
H2O
|
Agua
|
CH3CN
|
Acetonitrilo
|
|
CS2
|
Disulfuro de carbono
|
CH3CH2OH
|
Etanol
|
|
NH3
|
Amoniaco
|
CH3OCH3
|
Éter dimetílico
|
|
|
|||
La molécula más pesada descubierta hasta 1982 en el espacio es el cianooctatetrano, HC8N. Nunca ha sido sintetizada en la Tierra; sin embargo, ha podido caracterizarse a partir de datos espectroscópicos.
De cualquier forma, en los océanos de la Tierra se concentraron paulatinamente todas estas sustancias orgánicas y se formaron compuestos más complejos. Uno de ellos, el ácido desoxirribonucleico o ADN, desempeñaría un papel crucial. El ADN tiene dos propiedades clave:
1) Puede actuar como "patrón" para manufacturar cadenas de aminoácidos (proteínas).
2) Tiene la capacidad de duplicarse a sí mismo.
La presencia de ADN equivale a la existencia de vida; desde entonces, la evolución ha actuado hasta llegar al hombre.
En la Tierra se han encontrado fósiles microscópicos de bacterias con una antigüedad de 3 000 millones de años. Desde la aparición de las algas cianofitas; el oxígeno producido por ellas se fue acumulando en la atmósfera y dio lugar a su naturaleza actual, que difiere mucho de la primitiva.
En este momento no puede producirse el mismo fenómeno que al inicio, debido tanto a la diferente atmósfera como a que los rayos ultravioleta del Sol ya no penetran hasta alcanzar la superficie de la Tierra, como antes ocurría.
Recordemos que en las estrellas se sintetizan los átomos de carbono, de manera que, después de todo podemos afirmar, como lo hace Carl Sagan, que nosotros (y toda la vida en la Tierra) somos "hijos de las estrellas".
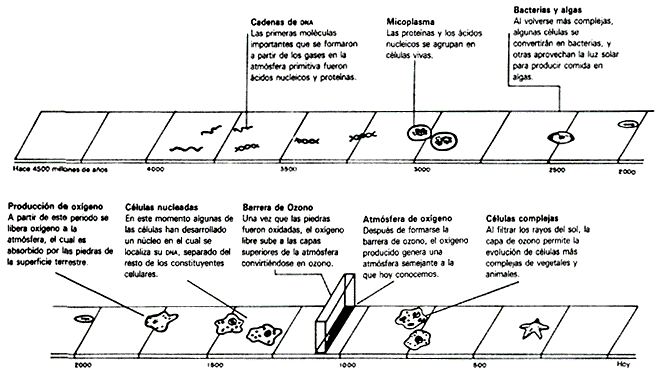
Figura I.20. La evolución
|
CUADRO I.4 El calendario cósmico
|
||
|
|
||
| Hace algunos años, Carl Sagan introdujo el concepto de "calendario cósmico", en le que el tiempo "se comprime" para mostrarnos, en un "año cósmico", toda la evolución del Universo. En este calendario, cada 1 000 millones de años reales corresponden a 24 días. | ||
| Si el 1 de enero a las cero horas hubiera ocurrido la gran explosión y el 31 de diciembre a las 24 horas fuera el día de hoy, tendríamos la siguiente sucesión de eventos: | ||
| 1 de enero | La gran explosión | |
| 1 de mayo | Origen de la Vía Láctea | |
| 9 de septiembre | Origen del Sistema Solar | |
| 14 de septiembre | Formación de la Tierra | |
| 25 de septiembre | Origen de la vida | |
| 2 de octubre | Formación de las rocas más antiguas conocidas en la Tierra | |
| 9 de octubre | Fecha de los fósiles más antiguos encontrados | |
| 12 de noviembre | Plantas fotosintéticas que producen O2 | |
| 1 de diciembre | La Tierra desarrolla una atmósfera con oxígeno | |
| 31 de diciembre | Surgimiento del homo sapiens, cuyos primeros registros históricos | |
| ocurrieron hace 10 segundos | ||
| ( 24 horas ) | Hoy | |
|
|
||
Figura I.21. La estructura helicoidal del ADN.
Allen, C., J. de la Herrán y A. Poveda, "Nacimiento, vida y muerte de las estrellas", primera parte, Ciencia y Desarrollo 31, 124 (marzo-abril de 1980); segunda parte, Ciencia y Desarrollo 32, 152 (mayo-junio de 1980); tercera parte, Ciencia y Desarrollo 33, 218 (julio-agosto de 1980).
----, "Origen y evolución de los elementos químicos en el Universo", Ciencia y Desarrollo 34, 212 (septiembre-octubre de 1980).
Attenborough, D., La vida en la Tierra. Una historia natural, Fondo Educativo Interamericano, México, 1981.
Canuto, V. M., "La estructura y evolución del Universo", Ciencia y Desarrollo 62, 33 (mayo-junio de 1985).
Espíndola, J. M., El tercer planeta. Edad, estructura y composición de la Tierra, colección "La ciencia para todos", 74, FCE, México, 1989.
Hacyan, S., El descubrimiento del Universo, colección "La ciencia para todos ", 6, FCE, México, 1986.
Hawking, S., Historia del tiempo. Del big bang a los agujeros negros, Grijalbo, México, 1988.
Miller, S. L., "Primera síntesis de compuestos orgánicos obtenida en el laboratorio en las condiciones de la Tierra primitiva", Ciencia y Desarrollo 40, 158 (septiembre-octubre de 1981).
Müller, R. A., "La radiación cósmica de fondo y el nuevo movimiento del éter", Investigación y Ciencia 22, 28 (julio de 1980).
Oparin, A., El origen de la vida, Editores Mexicanos Unidos, 1978.
Ponnamperuma, C., "El origen de la vida y la cosmoquímica", Revista de la Sociedad Química de México 26, 6 (1982).
Ponnamperuina, C., y P. Malton, "El origen de la vida", Investigación Científica y Tecnológica 50, 7 (1 de agosto de 1981).
Rodríguez, L. F., Un universo en expansión, colección "La Ciencia para todos ", 1, FCE, México, 1986.
Sagan, C., "El calendario cósmico", Revista Comunidad CONACYT, septiembre de 1980, pp. 50-58.
Thuan, T. X., "La formación del Universo", Mundo Científico 57, 387, 1986.
Zeilik, M., "El nacimiento de estrellas de gran masa", Investigación y Ciencia 21, 42 (junio de 1978).
El redescubrimiento de la Tierra, CONACYT, México, 1982.
El lector seguramente ha oído hablar de los hoyos negros. Si desea saber más acerca de ellos, consulte:
Asimov, K., Las amenazas de nuestro mundo, Plaza y Janes, Barcelona, 1980, pp. 57-65.
Firmani, C., "Los hoyos negros", Ciencia y Desarrollo 31, 167 (marzo-abril de 1980).
Brown, H. A., "Agujeros negros. Vórtices donde el tiempo no transcurre", Revista de Geografía Universal (abril de 1980), p. 363.
Hacyan, S., Los hoyos negros y la curvatura del espacio-tiempo, colección "La Ciencia para todos", 50, FCE, México, 1988.