II. CAMBIOS NUCLEARES Y SUS APLICACIONES
MUCHOS de los hechos y teorías expresados en el capítulo anterior se desarrollaron científicamente por el interés de comprender más sobre el núcleo atómico. Tenemos aún más dudas que respuestas.
Este capítulo se centra en la exposición de los avances más importantes en este terreno, y en la descripción del estado que guarda su desarrollo en México. Adicionalmente, intenta proporcionar ciertos elementos de juicio acerca de la utilización del conocimiento nuclear que, como muchas otras, tiene sus pros y sus contras. De esta manera, el lector podrá hacer su propia evaluación de la peligrosidad y potencialidades que tiene la energía nuclear, así como del problema ético que llega a suscitar este tema tan actual.
DESCUBRIMIENTO DE LA RADIACTIVIDAD
Los elementos que se ven en una tabla periódica pueden considerarse como "ladrillos",
a partir de los cuales se conforman todas las sustancias presentes en nuestro
planeta y el Universo. Sin embargo, no todos estos elementos son estables; únicamente
lo son 82 de ellos. Esto se debe a que, de forma natural, se producen cambios
en los núcleos de los átomos, algunos de los cuales se desintegran con enorme
velocidad mientras otros lo hacen con pasmosa lentitud.
|
La naturaleza entera puede construirse con los elementos
naturales; del hidrógeno al uranio
|
La primera evidencia de estos cambios en los núcleos fue encontrada en 1896 por el francés Henry Becquerel, como una consecuencia directa del descubrimiento, unos meses antes, de los rayos X. Becquerel encontró que una sal de uranio que guardaba en un cajón emitía ciertas radiaciones que velaban las placas fotográficas vírgenes. Parecía que el uranio despedía extrañas radiaciones. El término actual, "radiactividad", no apareció sino años después, en un trabajo de Pierre y Marie Curie, conocidos investigadores en este campo.

Figura II.1. Marie Curie.
En 1919, en el laboratorio de Ernest Rutherford se provocó por primera vez un cambio nuclear artificial. Desde entonces, y sobre todo a partir del descubrimiento del neutrón (Chadwick, 1932), los científicos nucleares encontraron un sinnúmero de nuevos núcleos atómicos y multitud de aplicaciones energéticas y no energéticas de los mismos. Algunas de ellas nos han sido de enorme utilidad, pero otras han puesto a la humanidad al borde de un cataclismo planetario.
DISCIPLINAS CIENTÍFICAS RELACIONADAS CON LOS
De la obra de Navarrete y Cabrera transcribimos las disciplinas en las que se acostumbra subdividir la ciencia nuclear. Esta información será útil al lector para que comience a identificar las áreas de aplicación de los fenómenos nucleares.
a) La radioquímica estudia las propiedades de los radioisótopos, los métodos para su obtención y purificación, su uso en la investigación química y los efectos químicos de las transformaciones nucleares.
b) La química de radiaciones estudia los efectos químicos producidos
por las radiaciones.
|
Los radioisótopos son núclidos naturales o artificiales
que emiten radiactividad, es decir, que son inestables
|
c) La química nuclear estudia la síntesis de nuevos núclidos y elementos artificiales.
d) La física nuclear estudia las partículas que forman el núcleo atómico, la configuración del mismo y los cambios de energía que tienen lugar en él.
e) La ingeniería nuclear estudia el diseño y funcionamiento de los reactores nucleares.
f) La física de neutrones estudia la producción, detección y comportamiento de esta partícula subnuclear.
g) La medicina nuclear estudia el comportamiento de compuestos radiactivos en el organismo humano, usados como trazadores con propósitos de diagnóstico o con fines terapéuticos en el tratamiento de padecimientos.
h) La radiobiología estudia el efecto de las radiaciones nucleares en las estructuras celulares de los seres vivos en general.
i) La seguridad radiológica estudia los métodos para el manejo de materiales radiactivos, de manera que pueda realizarse sin riesgos para la salud o el medio ecológico.
Como es frecuente en la ciencia, cada una de estas disciplinas no es independiente de las demás, sino que se complementan unas con otras.
La radiactividad natural es producida por los núcleos inestables de algunos elementos pesados.
En la naturaleza existen 274 núclidos estables. Sus valores de Z y N pueden graficarse (Figura II.2), lo que permite observar que:
a) Para los elementos ligeros, la estabilidad se presenta en los núcleos con una relación cercana a un protón por cada neutrón.
b) Según va aumentando el número de protones, para que los núcleos sean estables se hace necesario un mayor número de neutrones. La razón es que con ello se reduce la repulsión entre los protones.
A los lados izquierdo y derecho de la zona de estabilidad de la figura II.2 se encuentran los núclidos inestables. Unos lo son —lado izquierdo— porque tienen un exagerado número de neutrones. Lo que les sobra a los otros —lado derecho— son protones.
Estos núclidos inestables se transforman en estables a través de diversos cambios nucleares, que constituyen la esencia de la radiactividad.
a) Emisión de partículas alfa. Estas partículas son núcleos de helio, los cuales constan de dos protones y dos neutrones. Por lo tanto, cuando un núcleo inestable emite una partícula alfa, pierde cuatro unidades en su número de masa y su número atómico se reduce en dos unidades.
Así, si X y Y representan los símbolos de los elementos con Z
y Z - 2 protones, el llamado "decaimiento alfa" es una reacción
con el siguiente patrón:
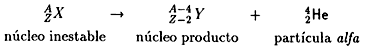
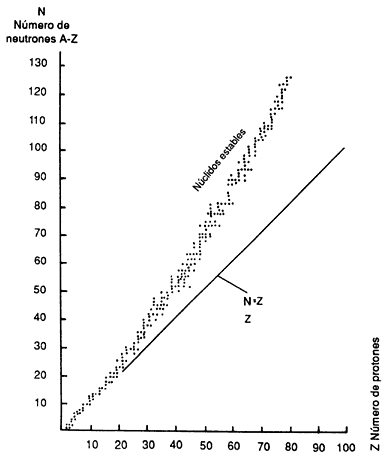
Figura II.2. Número atómico y de neutrones para los núclidos estables.
|
Nótese que una reacción nuclear se conserva
la carga y el número de masa
|
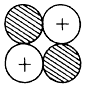
Figura II.3. Representación de una partícula alfa.
Un ejemplo peculiar es el decaimiento del uranio-235, que se convierte en torio-231:
b) Emisión de partículas beta. Los núclidos que se encuentran a la izquierda
de la curva de estabilidad, con un exceso de neutrones, se estabilizan mediante
la emisión de negatrones, o partículas beta, convirtiendo un neutrón
en un protón. Los negatrones no son sino electrones, despedidos a enormes velocidades
fuera de la atracción del núcleo. De esta forma, uno de los neutrones del radionúclido
experimenta la siguiente reacción:
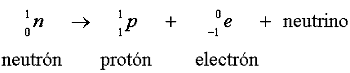
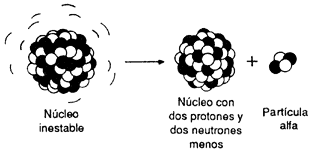
Figura II.4. Decaimiento alfa.
Durante este proceso, el radionúclido eleva en una unidad su número atómico
(pues cuenta con un protón adicional), y mantiene constante su número de masa.
La reacción general puede describirse así:
Un ejemplo particular es el torio-231, que se convierte en protactinio-23 1
por emisión beta:
c) Emisión de radiación gamma. Al igual que los electrones excitados de los átomos, que al volver a estados más estables emiten radiación electromagnética, los núcleos inestables también pueden hacerlo, salvo que en este caso la radiación es mucho más energética y se denomina gamma. El núclido no cambia su número atómico ni el de neutrones; simplemente reduce su energía.
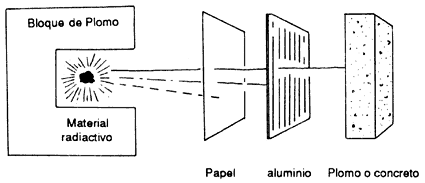
Figura II.5. Penetración a, b, y y.
En muchas ocasiones, el producto de una desintegración radiactiva alfa o beta es todavía un núcleo inestable, que tarde o temprano vuelve a decaer. El proceso se repite varias veces, hasta que se forma un núcleo estable con una proporción conveniente de neutrones y protones.
A este conjunto de decaimientos nucleares se le conoce como serie radiactiva. En la figura II.6 se presenta la serie radiactiva del uranio-238, en la que, después de varias emisiones alfa y beta se obtiene un núcleo estable de plomo-206.
Ésta es la razón de que en los yacimientos de uranio siempre existe plomo.
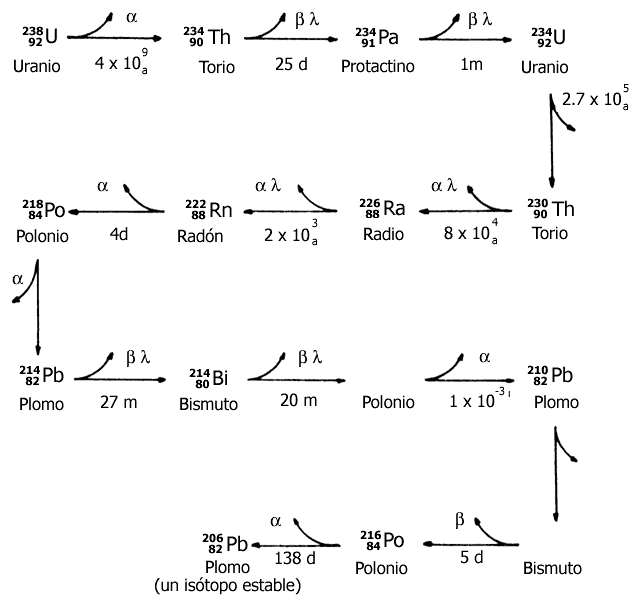
Figura II.6. Serie de desintegración radiactiva del uranio-238.
Una muestra de un material radiactivo, no importa de qué tamaño, siempre presenta una velocidad constante de decaimiento (la proporción de átomos que decaen en un cierto tiempo es siempre la misma). Al tiempo en el cual la mitad de los átomos radiactivos iniciales se han transformado, se le conoce como "tiempo de vida media", que es una característica de cada núclido.
En la figura II.6, los tiempos que aparecen debajo de cada una de las flechas son, precisamente, tiempos de vida media. Por ejemplo, para el uranio-238, el dato es de cuatro mil millones de años. Aproximadamente, este tiempo es igual a la antigüedad de nuestro planeta. Así, si una muestra de uranio-238 se hubiera formado en la nube que dio lugar al Sistema Solar, aún hoy existiría la mitad de ese uranio presente; la otra mitad se habría transformado en otros núcleos, según se indica en la figura II.6. Además, en ella podemos comprobar que los tiempos de vida media varían para cada núclido, siendo el polonio-214 el que menos tiempo toma en su decaimiento, apenas una milésima de segundo.
TRANSFORMACIONES NUCLEARES INDUCIDAS
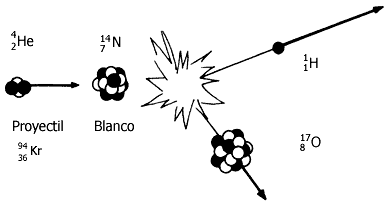
Figura II.7. Diagrama esquemático de la primera reacción nuclear inducida
En 1919, Rutherford detectó y realizó con éxito la primera reacción nuclear artificial (producida por la intervención del hombre). Al bombardear con partículas alfa una muestra de nitrógeno, encontró una partícula con las características del protón.
La reacción nuclear de Rutherford es la siguiente:
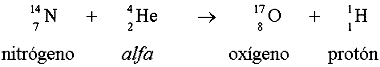
Se insiste que, en una reacción nuclear, la carga y el número de masa no se
alteran:
|
|
|
|
Debido a la alta velocidad de la partícula alfa, su colisión con el nitrógeno provoca que ambos núcleos se fundan (fusión de núcleos), pero el núcleo formado es inestable y elimina un protón.
A partir de este descubrimiento, se ha sometido a multitud de núcleos a "bombardeos" con diferentes partículas. Los resultados de esos experimentos siguen siendo de gran interés. Gracias a ellos han podido conseguirse asombrosos resultados, como:
El aprovechamiento de la energía nuclear y su utilización para nobles fines o para la fabricación de misiles militares,
la obtención de nuevos elementos químicos, más pesados que el uranio,
el hallazgo de nuevas partículas nucleares, que ha desembocado en el planteamiento de novedosas teorías acerca de la constitución de la materia, y
la utilización de los cambios nucleares en aplicaciones no energéticas, que han venido a apoyar el estudio del metabolismo humano y la eliminación de padecimientos, la comprensión de la forma en que suceden las reacciones químicas y nuevos métodos para analizar químicamente muestras con pequeñísimos contenidos de ciertos elementos.
En lo que resta de este capítulo hacemos algunas consideraciones en torno de esas aplicaciones.

Figura II.8. En 1935, Chadwick recibió el premio Nobel de física por su descubrimiento
del neutrón.
Si en la reacción de Rutherford se sustituye el átomo de nitrógeno por uno de berilio, como resultado no se detecta un protón, sino una partícula sin carga eléctrica: el neutrón.
El descubrimiento del neutrón vino a aclarar la constitución del núcleo atómico, compuesto esencialmente por protones y neutrones, como hemos visto.
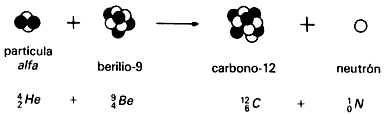
Figura II.9. Generación del neutrón
Otro ejemplo importante de reacciones nucleares inducidas lo constituye el descubrimiento de elementos químicos más pesados que el uranio: los llamados elementos artificiales.
Hacia 1940 ya se habían desarrollado diversas técnicas para acelerar partículas, llevándolas a velocidades de millones de metros por segundo. Estas partículas se hicieron chocar con núcleos pesados. Como resultado se obtuvieron nuevos núcleos, debido a la fusión de la partícula con el núcleo bombardeado. Por ejemplo, al acelerar núcleos de deuterio (hidrógeno con número de masa de dos unidades) y proyectarlos sobre uranio-238 se obtiene uranio-239, de acuerdo con la reacción:
Como vemos, el deuterio se convierte en hidrógeno- 1, transfiriéndose un neutrón al núcleo del uranio.
El uranio-239 es inestable. Después de media hora emite una partícula beta,
con lo que su número atómico aumenta en una unidad. Así, se convierte en un
núcleo con 93 protones, que fue "bautizado" como neptunio, Np:
Ésta es la forma en que el hombre ha podido obtener elementos como el neptunio, no presentes en la Tierra. Así, el conocimiento de la naturaleza le ha permitido a la humanidad obtener elementos no existentes en este mundo. ¡Asombroso! Hasta hoy se han encontrado 17 elementos más pesados que el uranio. El más reciente de ellos, en septiembre de 1987, vino a llamarse unniloctio (Cuadro II.2); tiene 108 protones en su núcleo y su tiempo de vida media es de dos milisegundos.
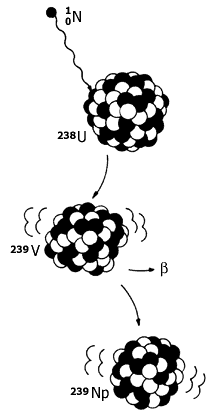
Figura II.10. El bombardeo de nuetrones sobre uranio-238 también produce neptunio
| CUADRO II.1. Síntesis de algunos transuránidos. Algunos ejemplos de reacciones empleadas para obtener otros elementos transuránidos | ||
|
|
||
|
|
|
|
|
|
||
|
Plutonio
|
|
decaimiento beta
|
|
Curio
|
|
bombardeo con partículas alfa
|
|
Novelio
|
|
Bombardeo con núcleos de carbono-12
|
|
|
||
El descubrimiento del neutrón proporcionó a los científicos nucleares una valiosísima partícula de bombardeo. Al no tener carga eléctrica, un neutrón puede chocar contra un núcleo sin sentir ninguna repulsión durante el proceso. De esta forma, hasta los neutrones lentos pueden producir reacciones nucleares. El grupo de Enrico Fermi, en Roma, se dedicó a bombardear con neutrones diversos elementos, con lo que produjo multitud de nuevos núcleos, la mayoría de ellos inestables.
En 1938, una de estas pruebas de bombardeo con neutrones llevó a Hahn y Strassman a encontrar un nuevo tipo de reacción nuclear, en la que el núcleo atómico se parte en grandes pedazos, dando lugar a dos o más núcleos ligeros.
Esta reacción es la inversa de la fusión y se denomina fisión.
|
· Fusión: dos núcleos ligeros se funden en uno solo
· Fusión: un núcleo pesado se parte en dos ligeros
¡no confundir! |
Una reacción de fisión del uranio-235 se presenta en la figura II.11.
La fisión libera enormes cantidades de energía. Un gramo de uranio-235 puede originar tanta como la que se obtendría al quemar ¡2 600 toneladas de carbón! El origen de esta energía será aclarado posteriormente.
|
Cuadro II.2 Nomenclatura de transuránidos con (Z
mayor que 100)
|
|||||
|
|
|||||
| Actualmente existen tres grupos de investigadores en el mundo que se dedican a la síntesis de nuevos elementos: | |||||
| El de Berkeley, en Estados Unidos, dirigido por Seaborg y Ghiorso. | |||||
| El de Dubna, en la Unión Soviética, encabezado por G. N. Flerov. | |||||
| El de Darmstadt, en Alemania Occidental, dirigido por G. Munzenberg y P. Armbruster. | |||||
| Los tres se disputan los descubrimientos de los elementos postlaurencio. Cada uno ha dado diversos nombres a los elementos 104, 105 y 106: joliotio, rutherfordio, kurchatovio, hannio y nielsbohrio. | |||||
| Para evitar disputas la Unión Internacional de Química Pura y Aplicada emitió en 1979 una serie de propuestas para nombrar a los elementos con Z mayor que 100: | |||||
| 1. Los nombres de los elementos deben relacionarse con su número atómico. | |||||
| 2. Los símbolos consistirán en tres letras (para evitar duplicidad con aquéllos de número atómico menor que 100). | |||||
| 3. Todos los nombres termirnarán con la letra "o", y se usarán las raíces numéricas siguientes: | |||||
|
0 = nil
|
3 = tri
|
6 = hex
|
|||
|
1 = un
|
4 = quad
|
7 = sept
|
9 = enn
|
||
|
2 = bi
|
5 = pent
|
8 = oct
|
|||
| debiendo colocarse juntas las raíces en el orden de los dígitos que forman el número atómico. | |||||
| Como un ejemplo tenemos: | |||||
|
Número atómico
|
Nombre
|
Símbolo
|
|||
|
|
|||||
|
104
|
unnilquadio
|
Unq
|
|||
|
105
|
unnilpento
|
Unp
|
|||
|
106
|
unnilhexo
|
Unh
|
|||
|
107
|
unnilsepto
|
Uns
|
|||
|
108
|
unniloctio
|
Uno
|
|||
|
109
|
unnilenno
|
Une
|
|||
|
|
|||||
La idea de que la reacción de fisión puede llevarse a cabo "en cadena" se reconoció desde 1938. En el proceso de fisión, además de obtenerse núcleos más ligeros, se generan como subproductos dos o tres neutrones. Estos pueden volverse a hacer colidir con núcleos de uranio-235, como se ejemplifica en la figura 11.12, para obtener una reacción sin fin (mientras haya uranio con el cual los neutrones puedan chocar).
La reacción en cadena de la fisión es la base de las aplicaciones energéticas del núcleo atómico y, también, desgraciadamente, de las bombas atómicas lanzadas sobre Hiroshima y Nagasaki en 1945.
Otro núclido fusionable es el de plutonio, elemento con 94 protones que se obtiene a partir del uranio-238 presente en un reactor nuclear.
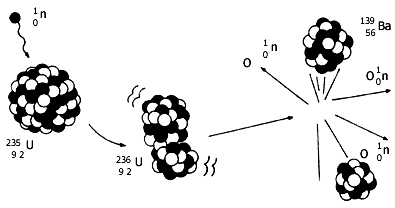
Figura II.11. Fisión. Cuando un neutrón es absorbido por el uranio -235,
éste se parte en dos fragmentos y se eliminan dos o tres neutrones. Los núcleos
ligeros se logran estabilizar mediante la emisión de radiación gamma.
Un tiempo después (de segundos a años), los núcleos ligeros se estabilizan mediante
la emisión de partículas beta y más radiación gamma.
La reacción en cadena puede controlarse y ser aprovechada. El dispositivo que permite mantener una reacción sostenida, no explosiva, se conoce como reactor nuclear. El combustible nuclear puede ser el uranio (una vez incrementada su proporción del isótopo 235, que es fisionable, respecto a la del 238, que no lo es).
Para que la reacción de fisión no salga de control, en el reactor se utilizan unas varillas que absorben muchos de los neutrones producidos y mantienen libre el número suficiente para que prosiga la reacción de forma controlada. El calor producido se elimina por medio de un refrigerador, que puede ser agua o un metal fundido, que se usa para producir energía eléctrica. Tal es el caso de la planta nuclear de Laguna Verde, en el estado de Veracruz: una instalación nucleoeléctrica.
En la actualidad, 14% de la energía eléctrica del mundo proviene de reactores nucleares y se estimaba que este porcentaje aumentaría a 40% para el año 2020, con lo que se consumirían unas 260 000 toneladas de uranio anuales. Sin duda, los accidentes nucleares recientes reducirán estas expectativas.
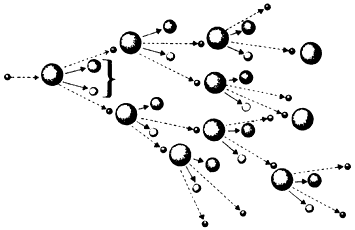
Figura II.12. Reacción nuclear en cadena. En breves segundos, un enorme
número de átomos de uranio-235 se fisiona, produciéndose formidables cantidades
de energía.
FACTORES EN CONTRA DE LA ENERGÍA NUCLEAR
El tema del aprovechamiento de la energía nuclear es sumamente debatido. Por una parte, se sabe que la industria nuclear ha crecido y ha sido impulsada gracias a que uno de los subproductos que se obtiene en los reactores es el plutonio, material que resulta ser el más conveniente para construir bombas de fisión. Una central nuclear de 1 000 megavatios produce alrededor de media tonelada de plutonio al año, lo que es suficiente para fabricar 50 bombas mortíferas.

Figura II.13. Reacción nuclear en cadena. En cosa de segundos, una explosión
atómica puede destruir una ciudad y contaminar con radiación nuestro planeta.
Los artefactos bélicos existentes en la actualidad pueden destruir todo rastro
de vida inteligente en la Tierra.
En cualquier país interesado en la fabricación de armas nucleares, la energía nuclear tiene una enorme ventaja política. La dificultad para construir una bomba reside en lo inaccesible de la materia prima y no en algún secreto de orden técnico. El uranio que puede encontrarse en la naturaleza no es un buen combustible nuclear; tiene demasiado poco uranio-235. Para que sirva es necesario aumentar la concentración de este isótopo en una planta de "enriquecimiento", que es costosísima. Estados Unidos tiene tres, la URSS dos, y Francia, Gran Bretaña y China poseen una.
Así, aunque México dispone de uranio natural, Laguna Verde no puede usarlo directamente. Será necesario llevarlo a Estados Unidos para enriquecerlo y volverlo a traer, lo que obviamente elevará su costo.
El problema militar de la fabricación de misiles se ha resuelto gracias al plutonio que se produce en las plantas nucleoeléctricas. Se dice que el Pentágono lo compra a 10 mil dólares el kilogramo. De esta manera, las potencias militares se interesan en la proliferación de los reactores nucleares, para sus poco éticos objetivos bélicos.

Figura II.14. Linus Pauling obtuvo el premio Nobel de química en 1954 y
después, en 1962, de la paz, como resultado de sus gestiones para impedir la
explosión de bombas atómicas en la atmósfera.
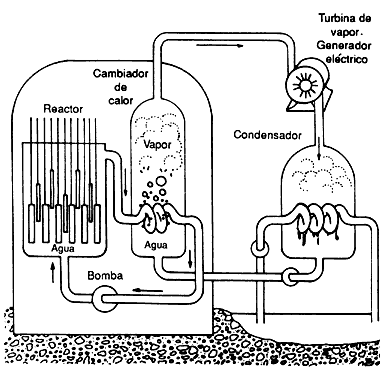
Figura II.15. Reactor nuclear de potencia. El combustible (material fisionable)
se encuentra en el corazón del reactor, rodeado por un moderador (agua, en la
figura). Las barras de control se colocan entre los elementos de combustible.
En el intercambiador de calor el agua se convierte en vapor, que se emplea para
mover una turbina generadora de electricidad. El vapor vuelve a condensarse
posteriormente.
Desde el punto de vista de la contaminación, aunque durante la fisión no se emiten los gases tóxicos propios de la combustión, los elementos radiactivos que se producen son sumamente peligrosos. En especial, el kriptón-85 es un gas que puede desprenderse hacia la atmósfera. Otros residuos sólidos, si no se almacenan con cuidado durante miles de años pueden contaminar el suelo, penetrar en la cadena alimenticia y transmitirse hasta el hombre.
Un ejemplo reciente del mal uso de los desechos nucleares lo constituye la
aparición de varilla para construcción altamente radiactiva en el norte de la
República Mexicana.

Figura II. 16. Otto Hahn, descubridor de la fisión.
Un punto más que merece atención es el de la seguridad del reactor nuclear. Los dos incidentes recientes, en Three Miles Island (Estados Unidos) y Chernobyl (Unión Soviética), pero sobre todo este último, demuestran que el centro del reactor se puede salir de control y fallar los mecanismos de protección. En Suecia, a 1 000 kilómetros de distancia de Chernobyl, la radiación producto de la explosión dejó llegar viento radiactivo de alto peligro. Se estima que el radio de muerte alrededor de la explosión fue de 28 kilómetros. Aunque se dice que no llegó a la centena el número de muertos en este accidente, se sabe que miles morirán de cáncer en los próximos 50 años.

Figura II.17. Construcción principal del reactor en Laguna Verde.

Figura II.18. ¿Contaminación? Three Miles Island (foto aérea).
A muy altas temperaturas, del orden de millones de grados, es factible provocar que los núcleos ligeros se unan para producir núcleos pesados. Como ya vimos en el capítulo previo, las reacciones de fusión son precisamente la fuente de energía de las estrellas.
El hombre puede provocar estas mismas reacciones si se alcanzan las temperaturas termonucleares. Una forma de hacerlo es por medio de una explosión nuclear de fisión. La llamada bomba-H es una bomba de fisión-fusión, que es mucho más destructiva. En primera instancia se produce una explosión por fisión, con la cual la temperatura se eleva lo bastante como para que empiece a ocurrir la fusión del hidrógeno, incluido también en la bomba. Su poder se mide en megatones, por su equivalente en millones de toneladas de TNT, un explosivo químico.
ENERGÍA DE AMARRE Y DEFECTO DE MASA

Figura II.19. Eclipse solar
|
¿Por qué tanta energía?
|
Ha llegado el momento de explicar el origen de la energía nuclear. ¿Cómo es posible que la fusión de dos núcleos ligeros genere tal cantidad de energía como la que emite el Sol? ¿Por qué se libera también tanta energía en un reactor de fisión o en una explosión atómica?
La respuesta a estas interrogantes fue dada por Einstein, muchos años antes de la explosión de Hiroshima. Se trata de un fenómeno de transformación de masa en energía: la teoría de la relatividad en acción.
Resulta ser que al unirse protones y neutrones para formar un núcleo ligero se pierde una pequeña cantidad de masa. Vale la pena ver un ejemplo.
Un núcleo de deuterio, con un protón y un neutrón, tiene una masa de 2.01345 (unidades de masa atómica, urna). Ello indica que una muestra de 2.01345 gramos de deuterio contiene 6.02 x 1023 núcleos.
Sin embargo, como la masa de un protón libre es de 1.00728 y la de un neutrón es de 1.00867, ambas partículas tendrán una masa total (cuando estén separadas) de 2.01595.
¿Por qué cuando se juntan en el deuterio pesan sólo 2.01345? La diferencia entre la masa de los nucleones separados y la masa de un núcleo se conoce como defecto de masa. En el caso del deuterio, este defecto de masa vale:
Einstein demostró que estas "pérdidas" aparentes de masa no ocurren por desaparición inexplicable, sino que esa masa perdida se transforma en energía, de acuerdo con su fórmula:
donde c es la velocidad de la luz en el vacío (3 x 10 8 m/s). De esta manera, la ínfima cantidad de masa que desaparece al formarse un deutério se transforma en una energía de:
Esta cantidad de energía (menos de un billonésimo de julio) puede parecer ridícula,
pero debe tenerse en cuenta que se refiere a la formación de un soló núcleo
de deuterio. Así, cuando se formasen 2.01345 gramos de deuterio se liberaría
una energía 6.02 X 1023 veces mayor: ¡224 mil millones de julios!,
cantidad suficiente para calentar y hacer hervir una alberca con casi 100 toneladas
de agua.
|
¡Y eso que el deuterio tiene la menor energía de amarre!
|
De igual manera que al formarse un núcleo por fusión de nucleones se libera una gran cantidad de energía, es necesario proporcionar esa misma energía para romper la unión entre las partículas de un núcleo.

Figura II.20. Albert Einstein en su escritorio en la Oficina de Patentes de
Berna, 1905.
A la energía necesaria para romper un núcleo y convertirlo en sus nucleones aislados se le conoce como "energía de amarre". Mientras mayor es el número de nucleones, mayor es la energía de amarre nuclear. Cuando la energía de amarre se calcula para todos los núcleos, se obtiene la curva que se muestra en la figura II.21. En las ordenadas se presenta la energía de amarre dividida por el número de nucleones. La curva presenta un máximo para núcleos con 56 partículas, como el del hierro-56 y un pico para el helio-4. Estos son los núcleos más estables, pues cada uno de sus nucleones ha experimentado el mayor defecto de masa y, por lo tanto, están más fuertemente "amarrados" al núcleo.
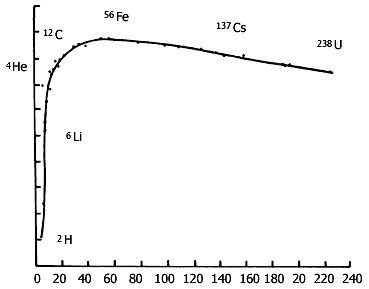
Figura II.21. Energía de amarre para cada nucleón, en función del número de
nucleones.
Salvo el pico en el helio, la curva es creciente hasta el hierro y decreciente después. Ello explica por qué el Fe es el último elemento que se logra obtener por nucleosíntesis en las estrellas y, por lo tanto, por qué las estrellas son continuas fuentes de energía, pues van fabricando núcleos cada vez más estables. Por otra parte, el hecho de que los núcleos más allá del hierro sean menos estables que éste, explica la liberación de energía durante la fisión: el pesado y poco estable núcleo del uranio se va convirtiendo al fisionarse en núcleos más ligeros, con una mayor energía de amarre por nucleón. De esta manera, los protones y neutrones del uranio se convierten en nucleones de otros núcleos, perdiendo cada uno de ellos una cierta cantidad de masa, que se transforma en energía.
APLICACIONES NO ENERGÉTICAS DE LA ENERGÍA NUCLEAR
A continuación exploraremos otras aplicaciones del núcleo atómico.
|
La Tierra se formó... ¿hace cuánto tiempo?
|
Determinación de la antigüedad de los minerales y materiales arqueológicos. Uno de los cálculos más fascinantes que han podido hacerse es el de la edad de la Tierra. Conociendo la proporción actual de plomo y uranio en el planeta puede estimarse que la Tierra se formó hace aproximadamente 4.5 miles de millones de años.
De forma similar, el hombre puede datar cualquier registro arqueológico y así
reconstruir su pasado y el de la vida en la Tierra. En particular, se usa el
isótopo carbono-14 para determinar la antigüedad de residuos orgánicos. Aunque
la vida media del carbono-14 es de sólo 5 730 años, se está produciendo constantemente
en la alta atmósfera debido a la llegada de rayos cósmicos a la Tierra. De este
modo, un hueso enterrado hace algunos miles de años contuvo inicialmente una
proporción de este isótopo, la que ha venido disminuyendo. El cálculo de su
contenido actual permite determinar su edad (Cuadro II.3).
|
CUADRO II.3 Algunos de los isótopos usados en datado
|
|||
|
|
|||
|
Tiempo de vida
|
Intervalo útil
|
Aplicaciones de
|
|
|
Isótopo
|
media ( años )
|
(años)
|
datado
|
|
|
|||
|
Carbono-14
|
5 730
|
500 a 50 000
|
Carbón, materia orgánica
|
|
Hidrógeno-3
|
12.3
|
1 a 100
|
Vinos añejados
|
|
( o tritio )
|
|||
|
Potasio-40
|
1.3 x 109
|
10 000 a miles de
|
Rocas, corteza terrestre
|
|
millones de años
|
|||
|
Renio-187
|
4.3 x 1010
|
40 millones a la edad
|
Meteoritos
|
|
del Universo
|
|||
|
|
|||
Estudio de las reacciones químicas. La radiactividad puede medirse con diversos instrumentos. Así, si en una muestra de moléculas se sustituye un átomo estable por un isótopo radiactivo, puede "seguírsele la pista" mediante la detección de radiactividad. Por ejemplo, si dejamos que una planta reciba CO2 con carbono radiactivo (carbono-14), se puede estudiar el curso de la reacción de fotosíntesis, investigando adónde fue este núclido, que se "delata" por su radiactividad.
Ésta ha sido una herramienta invaluable para estudiar el curso de las reacciones químicas. Ha permitido al hombre diseñar sus propias rutas de síntesis para fabricar los productos artificiales que hoy usamos. También en biología permitió conocer la función de un cierto elemento, material, fluido u órgano.
Trazadores. El adicionar pequeñísimas cantidades de un elemento radiactivo a una muestra permite que se lo rastree. Este método se emplea en la industria para medir velocidades de flujo, detectar fugas en tuberías y verificar procesos de mezclado.
Análisis por activación. Muchos de los elementos químicos son nocivos para el hombre. Su presencia, aun en cantidades ínfimas, puede ser letal cuando están disueltos en el agua, una vez que se acumulan en el organismo. La técnica de análisis por activación neutrónica permite medir partes por billón de estos peligrosos elementos en las aguas de los ríos, y así determinar la industria o proceso que desencadenó la contaminación.
Medidores de nivel, densidad, desgaste y espesores. En la industria
moderna se han incorporado medidores automatizados —para medir el nivel
dentro de los tanques cerrados, el espesor (por ejemplo, en la fabricación de
papel) y el desgaste de los equipos— que emplean reacciones nucleares como
principio de funcionamiento.
|
En la industria papelera, un dispositivo nuclear contrloa
el grosor del papel
|
Aplicaciones terapéuticas de los radioisótopos. Cuando está presente
en un tejido u órgano determinado en cierta cantidad, el material radiactivo
es capaz de destruir las células existentes y de evitar la formación de tejido
nuevo. Este recurso se emplea desde hace varios años para la destrucción de
tumores cancerosos, con la llamada "bomba de cobalto-60", el uso de oro-198
(cáncer de próstata) y del fósforo-32 para la leucemia. En el cuadro 11.4 se
enumeran otras aplicaciones médicas.
| CUADRO II.4 Aplicaciones médicas
de algunos radiosiótopos |
|
| |
|
| Isótopo |
Utilización en medicina |
| |
|
| Arsénico-74 |
Localización de tumores cerebrales |
| Cromo-51 |
Determinación del volúmen
total de la sangre |
| Cobalto-58 |
Determinación de vitamina B12 |
| Radio-226 |
Terapia y tratamiento del cáncer |
| Fósforo-32 |
Detección del cáncer
en la piel |
| Hierro-59 |
Velocidad de formación de glóbulos
rojos |
| Iodo-131 |
Diagnóstico de mal funcionamiento
tiroideo |
| Sodio-24 |
Detección de obstrucciones circulatorias |
| |
|
DESARROLLO Y PERSPECTIVAS DE LA ENERGÍA NUCLEAR
Este tema reclama una profunda reflexión, no sólo en lo que concierne a ventajas e inconvenientes, sino a posibilidades y proyecciones del futuro nuclear de México. Así las cosas, vale la pena iniciarlo con un poco de historia.
Las ciencias de la radiactividad se inician en México hace casi 30 años, cuando un grupo de científicos hizo patente la urgencia de iniciar actividades relacionadas con los radioisótopos.
Con el propósito de desarrollar las ciencias nucleares y de reunir a los científicos mexicanos en esa área, en 1964 se construye el Centro Nuclear, en las cercanías del pueblo de Salazar, en el Estado de México, donde se encuentra la sede del Instituto Nacional de Investigaciones Nucleares (ININ). En éste se preparan isótopos radiactivos artificiales de ciertos elementos y se les envía a diferentes instituciones (hospitales, universidades, industrias), según el uso que se les dé y bajo el control de la Comisión Nacional de Salvaguardias.

Figura II.23. Reactor nuclear del ININ.
Tres años más tarde, en 1967, se crea en la UNAM el Centro de Estudios Nucleares
y se aprueba el primer plan de estudios relacionado con este campo: la maestría
en ciencias nucleares, con sede en la Facultad de Química. Muy poco tiempo después,
el IPN inicia también una maestría en ingeniería nuclear.
|
Hasta 1989, en México se habían graduado 29 maestros
en ciencias nucleares
|
No obstante, el desarrollo real de esta área en el país ha sido escaso. Tal vez los motivos hayan tenido diversos orígenes (políticos —el sindicato de este sector se enfrentó en diversas ocasiones al Estado y éste no impulsó decididamente esta área—, económicos —las reservas de petróleo garantizaban energía más barata— y sociales —recientemente acrecentados y encabezados por grupos ecologistas).

Figura II.24. Maqueta de un reactor nuclear.
En la década de los setenta se decide la construcción de un reactor de potencia en la localidad de Laguna Verde, estado de Veracruz. La culminación de la obra ha ocurrido ya y el costo inicial previsto se ha encarecido notablemente. Resulta así casi imposible cumplir la meta fijada para el año 2000, en el que se preveía contar con 20 000 megavatios electronucleares instalados.
Los riesgos que depara el manejo de los reactores nucleares y sus desechos, la reducción notable de su fabricación en el mundo occidental y la conexión que su operación tiene con la carrera armamentista, indican que las aplicaciones energéticas del núcleo atómico tienen un futuro incierto. Esto es válido en México y en el mundo, a pesar de que existen países, como Francia, que no han detenido el paso en este renglón. Por lo pronto, se ha dado en el país un amplio debate acerca del arranque de la planta de Laguna Verde.
Pero desde luego, de alguna parte habremos de obtener la energía que hoy nos surte el petróleo. Si no se considera conveniente la vía nuclear, habrá que iniciar muy pronto un programa muy dinámico que nos permita satisfacer la demanda energética para el siglo XXI, cuando ya no exista petróleo o su escasez haga que se eleve a precios prohibitivos.
El hombre siempre ha vivido con radiaciones y seguirá viviendo con ellas. Los radioisótopos estaban presentes en la Tierra desde su formación. Todo lo que ha provenido de ella, incluyendo nuestros propios cuerpos, es naturalmente radiactivo. Cada segundo, más de 7 000 átomos en el cuerpo de un adulto promedio sufren decaimiento radiactivo. En el mismo tiempo, aproximadamente 300 rayos cósmicos han pasado a través de su cuerpo, produciendo alguna alteración en algún núcleo o en alguna célula.
En el agua que bebemos existe, de forma natural, radiación proveniente de uranio y radio. La leche contiene potasio, y es más radiactiva que el agua. Esto no significa que debamos evitar tomar leche, pues esta actividad radiactiva siempre será parte de la leche sana.
En todos nuestros hogares hay radiactividad, producida por el gas radón, que penetra del suelo o con el polvo.
El problema es que en años recientes se ha creado un número de fuentes artificiales de radiación, desde las bombas atómicas hasta ciertas carátulas de reloj que pueden verse en la oscuridad.
El hombre puede recibir cierta cantidad de radiación sin ser esencialmente afectado. Lo malo es que se rebase el límite permitido, a lo cual contribuye el mismo hombre al manejar indiscriminadamente peligrosos residuos nucleares, al hacer pruebas atómicas en la atmósfera y el subsuelo, y al cometer errores en el diseño y manejo de los reactores nucleares.
No cabe duda de que seguiremos necesitando energía. Ésta es una característica de la vida moderna. Muy pronto las reservas de petróleo se acabarán y habrá que estar preparados con otras fuentes energéticas. La energía nuclear es una opción, a pesar de que conlleva complejidad, peligro e implicaciones militares y ecológicas. Será preciso tener en cuenta que los recursos de uranio también se agotarán y podrían ser más limitados que los petroleros: la actual producción mundial de uranio es similar a la alcanzada en 1960.
Sin embargo, es cierto que otras posibilidades energéticas no nucleares también afectan la ecología (por ejemplo, la construcción de una planta hidroeléctrica implica la inundación de una enorme extensión de terreno), y las decisiones al respecto están asimismo influidas por parámetros económicos y políticos, más que por el interés social.
Tal vez la humanidad, en su proceso de evolución, aún no ha alcanzado la madurez racional suficiente como para aprovechar adecuadamente sus conocimientos acerca de la naturaleza. Quizá nunca la alcanzará si se obstina en dedicar enormes cantidades de recursos a las áreas bélicas nucleares, y tan exiguos a la batalla contra el hambre y las condiciones subhumanas de vida.
Nada habrá que hacer si algún día una superpotencia decide oprimir el botón. Este será un hecho irreversible, en el cual la ambición de poder triunfará sobre la moral y sobre la supervivencia del género humano.
El núcleo atómico ha sabido aprovecharse para erradicar males y enriquecer la calidad de la vida, pero también se le ha utilizado como amenaza y como arma para lograr la rendición. Decidir el uso que habrá de hacerse del conocimiento adquirido queda en manos de las nuevas generaciones. Esperamos que sea para bien de la humanidad.
Aguilar, G., S. Cruz y J. Flores, Una ojeada a la materia, colección "La ciencia desde México", 3, FCE, México, 1986.
Brandan, M. E., Armas y explosiones nucleares: la humanidad en peligro, colección "La ciencia desde México", 61, FCE, México, 1988.
Bulbulian, S., La radiactividad, colección "La ciencia desde México", 42, FCE, México, 1987.
Bulbulian, S., y M. Navarrete, "La radiactividad en México", Ciencia y Desarrollo 8 (48), 6 (1983).
Choppin, G. R., "Fissao nuclear", Rev. Iber. Ed. Quím. 2 (4), 105 (1967).
Dickson, T. R., Química ecológica, Limusa, México, 1980.
García Fernández, H., La bomba y sus hombres, Editorial Alhambra Mexicana, México, 1987.
Lartigue, J., et al., "Energía nuclear I. Aplicaciones no energéticas", Cuadernos de Posgrado 21, División de Estudios de Posgrado, Facultad de Química, UNAM, México, 1986.
Lezama, J., y B. Espejel, "Los radionúclidos: su producción y su uso", Ciencia y Desarrollo 47, 122 (1982).
Martínez Gutiérrez, J. D., "Los domadores del átomo", Ciencia y Desarrollo 74, 29 (1987).
Navarrete, M., y L. Cabrera, Introducción al estudio de los radioisótopos, Comisión Federal de Electricidad, México, 1979.
____, "Biografía de la radiactividad: un tema de nuestro siglo", Ciencia y Desarrollo 48, 63 (1983).
Rabinowitz, J. L., y J.C. Díaz Zagoya, Aplicaciones de los radioisótopos en química, biología y medicina, Secretaría Ejecutiva del Consejo de Estudios de Posgrado, UNAM, México, 1984.
Solache, M. J., "La radiactividad natural", Ciencia y Desarrollo 8 (48)16 (1983).