III. EL AGUA Y LA VIDA
EL AGUA no se encuentra en la naturaleza en su forma químicamente pura, compuesta solamente por moléculas H2O, que sólo se da en el laboratorio. Puesto que disuelve ávidamente a la mayoría de los compuestos sólidos, líquidos o gaseosos, en su forma natural se encuentra normalmente impregnada de ellos. Esto en sí es bueno, pues es precisamente el oxígeno disuelto el que permite la vida acuática; los sólidos en solución modulan su actividad química y son aprovechados por los seres vivos. Es interesante hacer notar que el agua químicamente pura no es apropiada para la vida.
Pero esta propiedad de disolver compuestos extraños a ella es la que provoca serios problemas de contaminación: los desechos domésticos o industriales incorporados a las masas de agua llegan a hacerla inadecuada y hasta peligrosa para la vida. Conocer los límites de impurezas que para cada uso pueden aceptarse y estudiar la manera de eliminarlas es una tarea de higiene extremadamente importante para conservar los recursos acuáticos. En este capítulo veremos los peligros que se ocultan en el manejo descuidado del agua. Tomar conciencia del daño que puede causarse es importante, pues una vez contaminada el agua el costo de purificación es muy alto.
Tiempo atrás, cuando la cantidad de agua parecía ser ilimitada o su costo de abastecimiento muy bajo, poco importaba tirar un poco de agua sucia al mar. Hoy en día la amenaza de la escasez y la conciencia de los altos costos de suministro han llevado a establecer reglamentos estrictos de control para las descargas a ríos, mantos y mares. El problema no es lejano, ni la responsabilidad es solamente del vecino: todos debemos participar.
Los contaminantes del agua pueden ser de muy diversa índole: residuos sólidos, líquidos o gaseosos; sólidos en suspensión; materia tóxica; microorganismos infecciosos; desechos radiactivos... Estas sustancias dan al agua propiedades indeseables, como corrosividad, incrustabilidad, toxicidad, mal olor, mal sabor y mala apariencia.
Los sólidos en suspensión, cuando son excesivos, reducen la penetración de
la luz y por consiguiente limitan la fotosíntesis de las plantas marinas, ocasionando
su degradación, lo que a su vez disminuye la aportación que hacen de nutrientes
al medio acuático. Cuando el daño es excesivo, las plantas mueren y se provoca
la corrupción del medio; el oxígeno disuelto prácticamente desaparece y con
ello la posibilidad de sustentar vida. Éstas son las "aguas estancadas",
de mal olor y apariencia.

Figura 26. El crecimiento excesivo de la vegetación acuática provoca la reducción
del oxígeno disuelto.
Los productos químicos causan alteraciones que pueden llegar a alcanzar gran peligrosidad. Por ejemplo, los plaguicidas tienen componentes de gran agresividad química cuya función es precisamente eliminar formas nocivas de vida. Sin embargo, al ser arrastrados por la lluvia o por las aguas de riego actúan sobre formas de vida que también los resienten, aunque a ellas no estaban dirigidos. Inclusive pueden ser asimilados por los peces a los que causan daño, así como también a los animales que los consumen, incluido el hombre.
Los fertilizantes contienen fósforo, nitrógeno y potasio, todos ellos necesarios para el crecimiento sano de las cosechas. Pero al ser arrastrados a esteros y lagunas provocan un crecimiento desmedido de las especies acuáticas, alterando el equilibrio ecológico. El medio acuático, al no poder soportar un excesivo crecimiento, se deteriora, mueren muchas plantas y causan descomposición, consumo de oxígeno disuelto en la putrefacción y afectan al ecosistema.
Los detergentes son unos de los peores enemigos del agua, pues en su estructura química contienen compuestos que no se degradan fácilmente. Los fosfatos que los forman generan verdaderas montañas de espuma que interfieren seriamente con la vida acuática, arruinan el valor estético de los cuerpos de agua y son un verdadero dolor de cabeza en los sistemas de tratamiento para su purificación.
Otros contaminantes dañinos son los metales pesados, como el mercurio, el cadmio, el plomo, el arsénico, el cromo, etc. que provocan graves anormalidades en la salud. El cadmio, por ejemplo, trae consigo enfermedades cardiovasculares; el mercurio, que por asimilación de los peces se transforma en metilmercurio o mercurio orgánico, provoca la pérdida de control en los movimientos, ceguera y, finalmente, la muerte. El arsénico es cancerígeno en pequeñas cantidades y letal en dosis medias, como lo son también el plomo y el cromo.
Hay que destacar también la contaminación por microorganismos patógenos (nocivos) que producen el cólera, la hepatitis, la fiebre tifoidea y la diarrea, que fácilmente pueden ser fatales, sobre todo en los niños. Microorganismos mayores como las amibas y la triquina también habitan en las aguas contaminadas. Una vez un amigo mío, biólogo, tomó una muestra de agua de una fuente de esta ciudad y por curiosidad la observó al microscopio: ¡tenía ante sus ojos una colección de bichos digna del mejor microzoológico!
La actividad humana depende del agua para su sustentación, pero es la principal causante de la inhabilitación de este recurso, por ignorancia o negligencia.
Las aguas contaminadas pueden restaurarse a una condición de reuso. Al respecto es necesario identificar cuál ha sido el daño y dar así al agua el tratamiento adecuado para la eliminación de cada una de las características indeseables según el destino que se pretenda dar. Estos tratamientos suelen ser muy complejos y costosos, así, se ha encontrado que se ayuda en la economía del reuso del agua destinando aguas de diferente calidad según vayan a ser empleadas en el riego, la industria o el consumo humano, aunque ciertamente menor será la complejidad y el costo si se parte de aguas menos deterioradas.
Con el fin de comprender mejor el problema de contaminación y tratamiento de agua, veamos qué calidad de ésta puede aceptarse para diferentes destinos: con fines recreativos, para la agricultura, la industria y el consumo humano. Será necesario introducir parámetros con los que se midan estos criterios con el objeto de dar medidas cuantitativas de la "calidad del agua"; ello podrá parecer un poco árido, pero confío que el esfuerzo de comprenderlos dará al lector una mejor sensibilidad de la magnitud del problema.
El agua que se usa con fines recreativos:
La vida humana se ha mantenido muy ligada al agua. Los artistas de las distintas civilizaciones han reflejado en la literatura y en el arte su fascinación por este elemento.
La contemplación del agua añade un placer estético a las experiencias humanas:
es agradable oírla, observarla, caminar o descansar junto a ella, tocarla y
entrar en su contacto. Ciertamente aumenta la belleza del paisaje del que forma
parte en las ciudades o en el campo.

Figura 27. No hay razón alguna para que la actividad humana deteriore el
medio ambiente. En la fotografía se aprecia la armonía entre el riachuelo corriendo
por la cañada y el acueducto al fondo, obra del siglo XVII, en el lugar llamado
El Sitio, Estado de México.

Figura 28. En los acueductos se construían cajas de agua para que la gente
pudiese aprovechar la obra de conducción. Esta caja de agua es parte del acueducto
de Zempoala. (siglo XVI).
La presencia de contaminantes reduce el valor estético del agua hasta casi hacerlo desaparecer. Más aún, la conciencia del daño que puede causar el agua sucia hace que el hombre la rehuya, perdiendo así su valor recreativo. Esta contaminación puede ser aparente cuando las aguas contienen desechos que la tornan desagradable a la vista, o estar oculta, cuando no se aprecia a simple vista pero se sabe que contiene elementos peligrosos para la salud, químicos o bacteriológicos.
Un objetivo fundamental de los programas de conservación de los recursos acuáticos es la preservación de sus valores estéticos y de la calidad del agua, así como el reconocimiento e identificación de los niveles de contaminación que pueden deteriorarla. El agua que no es adecuada para la recreación no lo es para ningún otro fin.
Para que el agua alcance valor estético debe estar libre, al menos, de sustancias
ajenas (basura, espuma), malos olores y exceso de vegetación acuática. Pero
al ver el agua uno desea tocarla, entrar en su contacto, así que, en
el caso de la que persigue fines recreativos, debe ser adecuada al menos para
lo que se llama un contacto secundario, esto es, que puedan realizarse
con ella actividades que no signifiquen un riesgo alto de ingestión: pescar,
mojarse los pies... El criterio establecido dicta que las especies marinas que
se extraigan de ella deben ser adecuadas para el consumo humano y que además
haya un límite máximo de microorganismos de 400 bacterias coliformes fecales
por 100 mililitros de agua.4![[Nota 4]](../imgs/mcommnt.gif)
Para un contacto primario, es decir, cuando existe la posibilidad de inmersión y por tanto de ingestión accidental, cuando se pasea en bote por ejemplo, el contenido de bacterias coliformes debe ser cuando más de una cuarta parte de lo anterior (100 bacterias por 100 mililitros) para que no exista un riesgo para la salud. Para actividades de natación, en las que es prácticamente inevitable la ingestión, la norma dicta que el contenido de bacterias coliformes sea a lo sumo de 200 por 100 mililitros (ml).
Pero no es éste el único factor: la acidez es importante también. Los líquidos tienen esta propiedad que se mide en una escala llamada pH y varía de 0 en los líquidos extremadamente ácidos hasta 14 en los más básicos; el valor de 7 corresponde a un líquido neutral, como la saliva. Las lágrimas sirven para reducir el efecto del contacto de partículas extrañas al ojo y tienen un valor de pH de 7.4. Aun cuando las lágrimas tienen asombrosa capacidad de amortiguamiento, una variación de pH de tan sólo 0.1 unidades causa molestias, así que para el contacto prolongado se recomienda que el pH del agua no sea inferior a 6.3 ni menor que 8.3.
Otro parámetro importante es la temperatura. El agua caliente es más peligrosa que la fría por ser más agradable al contacto; así, se ha encontrado que para un nadador corriente, que no gasta mucha energía, la máxima temperatura recomendable es de 30 grados Celsius. En las aguas termales, más calientes que este valor, deben controlarse cuidadosamente los movimientos y el tiempo de inmersión y por ningún motivo realizar ejercicios vigorosos.
El agua que se emplea en el campo en la producción de buenas cosechas y como bebida del ganado debe ser de tal calidad que no provoque daño o enfermedades, y en esto la presencia de sustancias extrañas tiene mucho que ver.
Aparte de las lluvias, en el campo las tres cuartas partes del abastecimiento del agua provienen de corrientes y la otra cuarta parte de pozos, por lo que el hombre, para hacer un mejor uso del recurso, ha construido presas y sistemas de distribución. Así es posible establecer un proceso productivo continuo a lo largo del año sin depender exclusivamente de las lluvias de temporal. Los costos, no obstante, son grandes, por lo cual todavía la mayor parte de la población agrícola queda a expensas de las lluvias.
En cualquier caso, para el adecuado funcionamiento de las labores del campo es necesario vigilar la calidad del agua; al respecto se han establecido criterios que rigen los principales factores que deben controlarse, especialmente el contenido de sales (o salinidad) incrementado por la irrigación río arriba o los lavados de terrenos y los microorganismos presentes introducidos a las aguas de riego por las descargas de los drenajes.
Desde tiempos remotos los agricultores han sabido que las aguas con gran contenido de sales son inadecuadas para plantas y animales. La salinidad afecta el crecimiento de las cosechas y el desarrollo del ganado, pues en grado excesivo los envenena. Cada tipo de planta y de animal tiene un grado de tolerancia, aunque el de las plantas es de hasta 5 000 miligramos por litro (mg/l) y para los animales de 10 000 mg/l.
En las tablas siguientes se muestran los límites de tolerancia en plantas y
animales:
|
Efecto de la salinidad en las plantas
|
|
|
|
|
|
Salinidad (mg/1)
|
Efecto
|
|
|
|
|
<500
|
Ningún efecto apreciable
|
|
500 a 1 000
|
Efectos adversos en cultivos sensibles
|
|
1 000 a 2 000
|
Efectos adversos en la mayoría de los cultivos
|
|
2 000 a 5 000
|
Sólo puede utilizarse en plantas tolerantes
|
|
|
|
|
|
|
|
|
|
|
Característica
|
Recomendación
|
|
|
|
|
Salinidad
|
<10 000 mg/1, dependiendo del animal y
|
|
del contenido de sales en el agua
|
|
|
Elementos peligrosos
|
|
|
arsénico
|
<0.05 mg/1
|
|
cadmio
|
<0.01 mg/1
|
|
cromo
|
<0.05 mg/1
|
|
flúor
|
<2.40 mg/1
|
|
plomo
|
<0.05 mg/1
|
|
selenio
|
<0.01 mg/1
|
|
|
|
La salinidad del agua es más agresiva en las regiones áridas y semiáridas que en las húmedas, pues en éstas no suele haber acumulación de sales y los efectos nocivos normalmente desaparecen.
Hay dos compuestos que deben tomarse en cuenta: el sodio y los cloruros. El primero puede ser un elemento perjudicial sobre todo en los terrenos arcillosos, pues reduce su permeabilidad; aguas con poca salinidad pero ricas en bicarbonatos pueden acarrear este problema. Los cloruros son particularmente malos para los plantíos de frutales, aunque inocuos para las demás cosechas.
La contaminación por microorganismos puede acarrear graves problemas no solamente a la salud de las plantas y animales sino también a la del hombre, consumidor de ellos. Las descargas de drenajes en aguas de riego o mantos freáticos ha causado la inhabilitación de extensas zonas para la agricultura.
La presencia de microorganismos debe vigilarse particularmente en los cultivos en que las raíces o las extremidades de los vegetales son consumidas por el hombre o los animales. Un límite aceptable parece ser de 5 000 coliformes por 100 ml (de los cuales hasta 1000 sean coliformes fecales) en un promedio mensual.
Debe mencionarse que hay otros parámetros que es recomendable vigilar, por ejemplo la acidez del agua cuyo pH debe estar entre 4.5 y 9.0; los pesticidas que frecuentemente se emplean para controlar las plagas son arrastrados a las corrientes de aguas de riego; en el uso normal no causan problemas, aunque deben controlarse los derrames. El problema de las aguas contaminadas por residuos industriales es materia de consideración aparte, pues normalmente estas descargas son extremadamente agresivas y por tanto deben eliminarse por completo.
El agua es también en la industria uno de los insumos más importantes. Interviene
en un sinnúmero de procesos: para enfriar, para diluir o para lavar otros ingredientes
en la transformación de los productos. La pureza del agua requiere cuidado especial,
cuando interviene directa o indirectamente. La limpieza del agua industrial
ha dado lugar a una importante industria de productos: en 1988 la industria
de productos para el tratamiento de aguas tuvo ventas en los Estados Unidos
por más de 2 400 millones de dólares, y la tendencia en los siguientes años
fue marcadamente creciente.

Figura 29. La industria es una gran consumidora de agua; en algunos procesos la calidad del agua debe ser controlada cuidadosamente.
Por ejemplo, muchos procesos industriales generan una gran cantidad de calor que es necesario eliminar para proteger los productos que se manufacturan; el agua, con su gran capacidad calorífica, es un refrigerante ideal, fácilmente accesible y barato. En estos casos se ponen en contacto el producto que se pretende enfriar con un serpentín dentro del que circula agua. Ésta, a su vez, es llevada a unos dispositivos que son, en esencia, equivalentes a los radiadores de los automóviles (aunque no necesariamente tengan la misma forma) donde el agua cede su calor a la atmósfera. En estos casos el agua debe estar libre de sales disueltas, pues por efecto de la temperatura éstas se desprenden del líquido y se depositan en las paredes de los tubos provocando oclusiones.
En su fase vapor, el agua se utiliza con diversos fines: generar electricidad, aprovechando su poca compresibilidad, para mover turbinas generadoras; para calentar procesos que requieren operación a temperaturas de hasta 100 grados centígrados (y un poco más si se "sobrecalienta" el vapor manteniéndolo a presión); o en la extracción de productos, pues el vapor es un buen disolvente. En estos casos el agua, para la formación de vapor, suele primero limpiarse de sales, en particular bicarbonatos y dársele una acidez moderada (entre 8.0 y 10.0 de pH) para reducir el efecto de ataque a los metales.
El agua para dilución es muy importante en la industria textil, que la emplea como excipiente en los tintes, uso que requiere agua extremadamente limpia, prácticamente agua destilada (menos de 150 mg/1 de sólidos totales disueltos), pues de lo contrario pueden estropearse los tintes.
En los procesos químicos el costo del agua es mucho menor que el de los demás insumos, por lo que se le da un especial cuidado a su tratamiento sin que los costos representen una contribución significante. Lo malo es que cuando el agua se descarga, ya contaminada, los costos se vuelven prohibitivos en opinión de muchos industriales. Vale decir que la legislación actual ha puesto particular énfasis en controlar el renglón de la contaminación, aunque el daño hecho hasta ahora ya es enorme y tomará muchos años de esfuerzo sostenido eliminarlo.
En la industria enlatadora de alimentos, la primera operación importante es el lavado de los productos que serán enlatados, para eliminar cualquier traza de tierra, insectos y otras impurezas, lo que se hace con un lavado a fondo con chorros de agua o de vapor, ambos de calidad potable (sin bacterias patógenas y un contenido de sales no superior a 1 500 mg/l). Esta industria utiliza muchos sistemas de tratamiento, incluyendo la desinfección y la filtración.
El agua para el abastecimiento público
El agua interviene tan íntimamente en los procesos vitales que los contaminantes que contiene son incorporados de manera profunda por los seres vivos. Un caso espectacular y bien conocido es el del mercurio, que los peces asimilan y transforman en el temible metilmercurio o mercurio orgánico. Cualquier ser que consuma tales peces lo incorpora fácilmente a su cuerpo, provocándose un daño progresivo y letal.
Las autoridades sanitarias cuidan que el tratamiento de las aguas para abastecimiento público pase por diferentes procesos de limpieza que aseguren un consumo seguro. Al respecto se han establecido parámetros que deben vigilarse; enseguida describiré los más representativos. Existen procesos de tratamiento específico que serán tratados en el capítulo IV.
El color indica la presencia de materia disuelta, ya sea orgánica o inorgánica, que puede ser nociva; el olor se debe a la materia orgánica. Uno y otro pueden y deben eliminarse por completo. Relacionada con estos parámetros está la turbidez o medida de la cantidad de partículas sólidas disueltas; un contenido de sólidos totales disueltos mayor que 500 mg/l, especialmente de cloruros y de sulfatos, da un sabor desagradable y hace aguas corrosivas. Es muy importante que el agua destinada al consumo público esté libre de aceites y grasas, pues estas sustancias son muy aromáticas y le confieren pésimo olor y sabor. El remedio a estos problemas lo ofrecen los procesos de coagulación, sedimentación y filtración.
La temperatura del agua varía según la región geográfica y el clima. En general, mientras no exceda los 30°C no representa un problema mayor.
Los organismos coliformes y los coliformes fecales, que ya han sido mencionados, constituyen malas especies. De hecho éste fue el primer parámetro sobre el que se puso atención (en 1880) para dictaminar la calidad sanitaria del agua. Aquellos bichos son habitantes normales de las descargas fecales de los animales de sangre caliente (los coliformes fecales) o de materia orgánica en descomposición (los coliformes a secas) y responsables de las enfermedades que se asocian con el agua. En general, la presencia de organismos coliformes fecales indica contaminación reciente y potencialmente peligrosa. Otros coliformes indican focos más distantes de contaminación o menos recientes de origen no fecal (insectos, plantas o drenajes lejanos). Los límites fueron explicados al principio de este capítulo y se recordará que 400 coliformes por 100 ml es la máxima cantidad permisible. Este contaminante se elimina por desinfección con cloro.
La alcalinidad del agua se debe a los bicarbonatos, carbonatos y otros iones en ella disueltos. La alta alcalinidad causa corrosión e incrustaciones, dentro de los límites tolerables. Puede eliminarse por coagulación. El contenido aceptable de estas especies químicas debe ser menos de 30 mg/l.
Un producto de cuidado es el amoniaco, pues reacciona vivamente con el cloro que se añade para desinfectar el agua y reduce por lo mismo su eficiencia. Además, indica la probable contaminación por descargas de drenaje en la fuente de agua (el amoniaco es componente de la orina).
Los metales pesados (arsénico, bario, cadmio, cobre, fierro, plomo y mercurio entre otros) son extremadamente venenosos y por desgracia poco puede hacerse en las plantas normales de tratamiento de aguas para eliminarlos. Lo mismo puede decirse de especies químicas como los fenoles, cianuros, metilos o sustancias radiactivas. El control de estos efluentes debe realizarse en las plantas industriales donde se generan.
La dureza del agua se la confiere su paso por las distintas formaciones geológicas que le ceden sales, especialmente carbonato de calcio. La tolerancia que a ella tienen los humanos es muy variable: más de 500 mg/l de carbonato de calcio es una cantidad excesiva y un valor deseable es de menos de 150 mg/l. En regiones como Zacatecas la dureza es muy alta y causa una desagradable coloración en la dentadura además de un excesivo consumo de jabón y costosas incrustaciones en las tuberías. Hay otros parámetros que deben vigilarse, como el oxígeno disuelto: éste en sí no tiene mayor efecto en la calidad potable del agua, pero una sustancial reducción de él puede indicar fuentes de contaminación por desechos orgánicos.
El agua es constituyente necesario de todas las células, animales y vegetales y la vida no puede existir en su ausencia ni siquiera por un periodo limitado. El agua que contienen los organismos vivos varía entre los extremos de 97% en los invertebrados marinos hasta 50% en las esporas.
El hombre adulto contiene en su organismo 70% en promedio, distribuido de la siguiente manera:
| tejido nervioso | 84% |
| hígado | 73% |
| músculos | 77% |
| piel | 71% |
| tejido conectivo | 60% |
| tejido adiposo | 30% |
En los fluidos biológicos, tales como la saliva, plasma y jugos gástricos,
el contenido de agua es hasta de 99.5 por ciento.
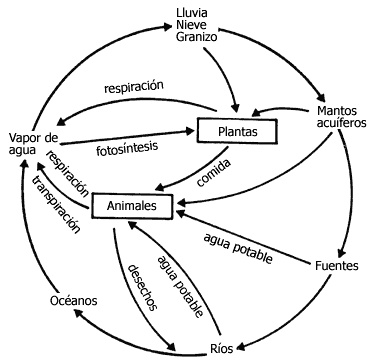
Figura 30. Los seres vivos participan en el ciclo hidrológico global del
planeta. En la figura se ilustra de qué manera las plantas y los animales contribuyen
al movimiento del agua.
Aproximadamente el 50% del contenido de agua en los organismos se encuentra en las células, 35% en materia no acuosa, 5% en el plasma y el 10% restante distribuido en el cuerpo. Es el agua la que da la turgencia a las células.
El agua es el solvente que promueve la digestión, en la que se rompen los carbohidratos y las proteínas. Los lípidos, aunque no cambian químicamente, se solubilizan en el medio acuoso para su asimilación.
Otro papel muy importante que desempeña el agua es el control de la temperatura del cuerpo mediante el aprovechamiento del calor latente del agua. Este proceso impide que existan zonas demasiado calientes o demasiado frías. La reserva de un humano adulto es de unos 45 kg, de los que se pierden entre 300 y 400 gramos por la respiración y entre 600 y 800 gramos por la evaporación cutánea. Ello disipa un 20% del calor producido por el cuerpo.
Los organismos vivos no pueden sobrevivir sin una alimentación mínima de agua, aunque ésta varía grandemente en los reinos animal y vegetal. Un humano adulto ingiere aproximadamente 2.5 litros de agua diariamente por medio de los líquidos y sólidos que toma. En la tabla se muestra la cantidad de agua que adquiere un adulto por cada 1.5 kg de comida "sólida" (que contiene 57% de agua).
|
|
||
|
Peso ( en g )
|
Cantidad de agua (en g )
|
|
|
|
||
| Pan |
300
|
100
|
| Leche |
200
|
175
|
| Carne |
100
|
76
|
| Papas |
300
|
225
|
| Verduras |
150
|
133
|
| Fruta |
50
|
40
|
| Queso |
60
|
21
|
| Pescado |
60
|
49
|
| Embutidos |
80
|
9.5
|
| Grasa |
40
|
0
|
| Azúcar |
40
|
0
|
|
|
||
Además, un adulto genera diariamente cerca de 350 gramos de agua acompañados por la liberación de 1.31 kilocalorías de energía por la combustión de la comida. Esta combustión se produce por medio de una serie de reacciones químicas en las que se forman proteínas de los aminoácidos y glicógeno de la glucosa y en las que resultan hidrógeno y oxígeno que se recombinan en agua.
El agua sirve para irrigar, distribuir nutrientes y remover desechos. La circulación del agua procede por la absorción intestinal, el flujo de la sangre y la diuresis. Las enfermedades relacionadas con el agua están conectadas con las irregularidades en la distribución sanguínea, la composición del agua intracelular y extracelular y la deshidratación.
La ingestión de agua y su generación interna por medio de reacciones químicas se acopla con la pérdida del agua por la excreción, transpiración y pérdida de vapor por la respiración para dar lugar al ciclo hidrológico propio de los organismos. Éste, a su vez, se acopla al ciclo hidrológico de la naturaleza.
El subciclo relacionado con las plantas se completa con el proceso de la fotosíntesis, en el cual se asimilan el vapor de agua y el bióxido de carbono. Los estudios que se han hecho con isótopos trazadores han demostrado que el oxígeno liberado se reconvierte en agua.
Esta breve descripción muestra las diferentes formas en las que el agua se liga con la vida, actuando como solvente, dispersante y lubricante. Es además un insumo y producto de las reacciones bioquímicas.
Por lo tanto no es de sorprender que un cambio en las propiedades del agua afecte, en algunos casos fatalmente, a los seres vivos. Por ejemplo, cada especie tiene un límite de temperatura del agua arriba del cual le es peligrosa. En los mamíferos, esta temperatura es de aproximadamente 40 grados centígrados.
La pureza del agua es fundamental: algunas especies químicas son nocivas, y la tolerancia varía según su efecto sobre la vida. Puesto que el agua es tan buen solvente, los contaminantes fácilmente se incorporan a ella y por tanto son llevados a los organismos y asimilados por ellos.
El agua químicamente pura es inadecuada para la vida por varios motivos. En primer lugar, es extremadamente reactiva y ataca los delicados procesos vitales. Existe además un equilibrio de sales en las células, que el agua químicamente pura rompería con consecuencias fatales, pues tendería a asimilar los sólidos disueltos, robándolos a las células. En el otro extremo, un agua con demasiadas sales tiene un efecto similar por la misma razón. Así, el Mar Muerto tiene una salinidad tan alta que no existe la vida en su seno.
Serían necesarios muchos estudios más para conocer con mayor precisión el papel del agua en la vida. Por ejemplo, sobre la manera como el agua participa en la organización de las estructuras moleculares biológicas, estabilizando los biopolímeros. Se sabe que se requiere 30% de agua para mantener la estructura de estas cadenas moleculares, que se derrumban por la deshidratación. Se supone que las fuertes interacciones eléctricas que provocan las ligaduras de hidrógeno contribuyen a esta estabilización e inclusive se han caracterizado algunas de ellas en los elementos constituyentes. Empero, el panorama para los científicos es todavía incompleto.