APÉNDICE G
El átomo de cualquier elemento consiste en un pequeño núcleo de carga positiva, rodeado por un número tal de electrones que el átomo, en su estado normal, es eléctricamente neutro. Bajo la acción de las fuerzas eléctricas entre el núcleo del átomo y sus electrones, éstos se mueven en órbitas casi circulares.
El núcleo mismo consiste en un cierto número A de partículas masivas llamadas nucleones. El símbolo A representa también el numero másico del átomo. Existen dos clases de nucleones: protones y neutrones. Cada uno de éstos tiene número másico 1. El neutrón es eléctricamente neutro, mientras que el protón tiene carga positiva. La carga del protón, e, es igual y opuesta a la carga del electrón, -e. Sin embargo, la masa del protón es aproximadamente 1 840 veces la masa del electrón.
El número de protones en un núcleo se designa por la letra Z y se llama número atómico de un átomo. Al número de neutrones en el núcleo se le designa con la letra N. Por lo tanto, expresado en forma matemática:
La figura G-1 da una idea de la estructura de algunos átomos. Un átomo
de hidrógeno de número atómico 1 y número másico 1 —representado por el
símbolo 1H1— consiste en un solo protón en el núcleo
y un electrón que se mueve en una órbita alrededor del núcleo. Un átomo de helio
de Z = 2 y A = 4 —representado por 2He4—
está compuesto de dos protones y dos neutrones en el núcleo, y dos electrones
en una órbita u órbitas alrededor del núcleo. Un átomo de sodio —11Na23—
número atómico 11 y número básico 23, consiste en un núcleo que contiene veintitrés
nucleones y once electrones en órbitas alrededor del núcleo.
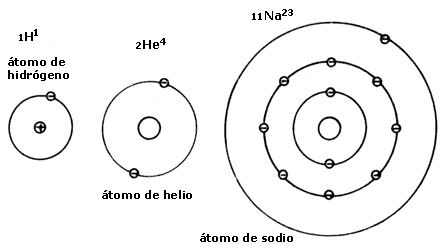
Figura G-1. Diagramas esquemáticos que ilustran la estructura de varios
átomos. El círculo más interno representa al núcleo, p es el símbolo
para el protón y n el del neutrón. Un electrón se representa por un pequeño
círculo con el signo menos dentro.
Un elemento está compuesto de átomos, todos con el mismo número atómico, o el mismo número de protones en el núcleo. Cuando el número de neutrones es diferente, estamos hablando de un isótopo del elemento.
El convenio adoptado para representar toda la información referente a un núcleo
puede ilustrar con el caso típico del hidrógeno, el cual tiene tres isótopos
de números másicos 1, 2 y 3 (Figura G-2 ). Este elemento es tan significativo
tanto en física como en química, que a sus tres isótopos a menudo se les conoce
por diferentes nombres. El isótopo de número másico 1 se conoce como hidrógeno,
el de A = 2 como deuterio, y el de A = 3 como tritio.
Aun sus núcleos tienen diferentes nombres y símbolos. Al núcleo del hidrógeno
se le llama protón (símbolo p), al del deuterio deuterón
(símbolo d), y al del tritio tritón (símbolo t).
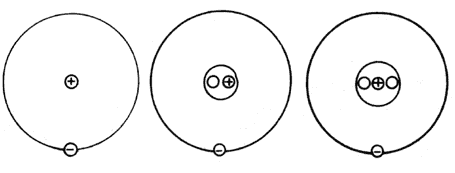
Figura G-2. Tres isótopos del hidrógeno.