III. EL ELECTRÓN, LA RADIACTIVIDAD Y EL NÚCLEO
COMPRENDER las ideas básicas que hay detrás de la fusión nuclear implica entender un poco la estructura de la materia. Como hemos visto, hacia fines del siglo pasado los científicos habían establecido por fin la existencia de los átomos, sugeridos por los griegos más de dos mil años antes. Sin embargo, los átomos seguían siendo concebidos como los constituyentes más elementales, y por lo tanto indivisibles, de la materia. Después, en una secuencia de descubrimientos impresionantes realizados en apenas tres lustros, se hizo evidente que los átomos poseen una estructura interna y no son, por tanto, elementales.
La cascada de importantes hallazgos científicos comienza el 5 de noviembre
de 1895, cuando Röntgen descubre los rayos X, y termina en 1911 al anunciar
Rutherford la existencia del núcleo atómico. En varios de estos descubrimientos,
el tubo de rayos catódicos —corazón del cinescopio de nuestros televisores
actuales y conocido entonces como tubo de Crookes, en honor a su inventor—
desempeñó el papel central. En forma análoga, la balanza de torsión había servido
mucho a la ciencia desde 1777, año en que Coulomb inventó ese aparato tan útil
y tan simple. Y ya relatamos en el capítulo anterior cómo otro simple instrumento,
el espectroscopio de Kirchhoff y Bunsen, resultó crucial para el desarrollo
de la química y de la física del átomo en los finales del siglo XIX.
La balanza de torsión, el espectroscopio y el tubo de Crookes, con su gran influencia
en el desarrollo de la física, nos ilustran al menos dos hechos importantes:
la unidad de esta ciencia, por un lado, y la posibilidad de hallar nuevos fenómenos
cuando se emplean aparatos simples de manera ingeniosa y perspicaz, por el otro.
Figura 3. El tubo de Crookes que se utilizaba en el laboratorio de Thomson.
En 1897, J. J. Thomson descubrió la naturaleza de los rayos catódicos y con ella la primera partícula en verdad elemental: el electrón. Cuentan que Thomson era un físico experimental muy torpe con las manos y que no sabía manipular los aparatos del laboratorio. Sus alumnos preferían que sólo les diera indicaciones, para que luego ellos realizaran las mediciones experimentales. No obstante, Thomson demostró que los rayos del tubo de Crookes están constituidos en realidad por minúsculas partículas, los electrones. Por este trabajo, en 1906 se otorgó a Joseph John Thomson el premio Nobel de Física. En años posteriores, al menos siete de aquellos alumnos que le habían impedido destruir aparatos y que alguna vez siguieron fielmente sus consejos obtuvieron sendos premios Nobel. Qué duda cabe, ¡J. J. Thomson fue un gran maestro!
En Baviera, por la misma época, otro curioso jugaba también con su tubo de Crookes. El ingeniero mecánico alemán Wilhelm Röntgen se dio cuenta, en 1895, que los rayos catódicos podían inducir luminiscencia a distancia. Había hallado una radiación muy penetrante y misteriosa, tan misteriosa que la llamó X. Durante siete semanas experimentó sin descanso con los rayos X; mostró que eran altamente ionizantes y que no podían desviar los campos eléctricos o magnéticos. Un mes después, en enero de 1896, habló por primera vez en público de su descubrimiento; al acabar la charla, tomó la radiografía de la mano de uno de los asistentes, un médico suizo. De inmediato Röntgen se volvió famoso y sus rayos X más todavía. Al instaurarse en 1901 el premio Nobel, Röntgen recibió el primero en el campo de la física.
Una curiosa similitud existe entre la historia de la fusión fría y el descubrimiento
de los rayos X: en ambos casos la conmoción y la confusión entre el gran público
fueron grandes. Con frecuencia se malinterpretó la naturaleza de los rayos X
y se les supuso propiedades que no tenían. Los legisladores de Nueva Jersey,
en EUA, por ejemplo, intentaron aprobar una ley que prohibiera
el uso de binoculares de rayos X en el teatro, para así resguardar el pudor
de las damas; y el famoso Superman, héroe pop norteamericano nacido en
1938, fue dotado, entre sus facultades superiores, con una potente vista de
rayos X. Desgraciadamente, como veremos después, las similitudes entre los descubrimientos
de los rayos X y de la fusión fría ahí terminan.
Volviendo al tema de la estructura de la materia, el siguiente descubrimiento importante para nuestra historia fue aquel del físico francés Henri Becquerel. Intrigado con los resultados de Röntgen se preguntó si acaso los materiales fluorescentes podrían emitir rayos X. En 1896, luego de una fascinante serie de acciones fortuitas, Becquerel descubrió un nuevo tipo de radiación producida por el uranio. Posteriormente, la célebre polaca Marie Sklodowska y su marido Pierre Curie convirtieron en cuantitativos los estudios cualitativos de Becquerel. Fue madame Curie quien denominó radiactividad al nuevo fenómeno. Ella es la única mujer que ha recibido dos veces el premio Nobel, el primero compartido con su esposo y con Henri Becquerel en 1903. Los descubrimientos de Thomson, Becquerel y el matrimonio Curie nos hicieron ver claramente que el átomo, contra lo que su nombre indica, es un sistema divisible.
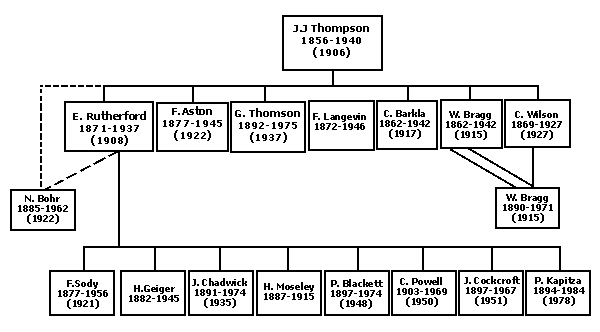
Figura 4. Árbol genealógico-científico de J. J. Thomson y de E. Rutherford. La raya simple indica que el maestro dirigió la tesis doctoral del alumno, la línea punteada que dirigió su estancia posdoctoral y la doble raya que, de hecho, ¡es su progenitor! Entre paréntesis aparece el año en el que el científico obtuvo el premio Nobel.
Otro paso importante en esta historia lo dio un alumno de Thomson, el neozelandés Ernest Rutherford, quien habría de ser conocido como el padre de la física nuclear. Rutherford es una de las personalidades más avasalladoras de la física, y por tanto de la cultura de este siglo. Nacido en Nueva Zelanda, en los linderos del Imperio británico, por sus brillantes estudios obtuvo una beca para estudiar en Cambridge, a donde llegó en 1895 para trabajar bajo la mirada vigilante de J. J. Thomson, el descubridor del electrón.
Ya formado como investigador en los famosos laboratorios Cavendish, en la misma universidad donde antes habían trabajado Newton y Maxwell, le ofrecieron regresar a la periferia del Imperio, ahora como profesor de la Universidad McGill de Montreal. Ahí investiga sobre la radiactividad y sus descubrimientos lo llevan de regreso a la metrópoli; en 1906 va a trabajar a Manchester, otra cantera prestigiosa de la ciencia inglesa, donde habría de generar toda una nueva forma de hacer física, amén de descubrir el núcleo atómico y ganar el premio Nobel ¡de química! —gran paradoja, para uno de los más grandes físicos—. Regresa a Cambridge en 1919, ahora como director de los Cavendish y ocupa este puesto hasta su muerte en 1937. Tres son pues las etapas bien marcadas de la vida del gran físico: McGill, Manchester y Cambridge; en cada una de ellas obtuvo resultados que harían vanagloriarse a cualquiera.
Rutherford estudió los efectos de la radiactividad y de los rayos X sobre la conductividad eléctrica de los gases. En 1898 encontró que había al menos dos tipos de radiactividad, que él llamó rayos alfa (a) y rayos beta (b). Los rayos b son muy penetrantes, a diferencia de la radiación alfa, que puede detenerse con ayuda de muy delgadas laminillas de aluminio. Los rayos beta se desvían al entrar en un campo magnético, en la misma dirección que los electrones que forman los rayos catódicos en el tubo de Crookes y en dirección contraria a la de los rayos a. Con estos y otros datos, Rutherford demostró, primero, que los rayos b son electrones y, posteriormente, que los rayos alfa son iones de helio.
Por aquel entonces, se había ya encontrado un tercer tipo de radiactividad, la gamma (g), que descubrió en Francia Pierre Villard en 1900. Esta radiación es muy penetrante y un campo magnético no puede desviarla. El mismo Rutherford y su estudiante portugués Da Costa Andrade demostraron que los rayos gamma son de naturaleza idéntica que los rayos X, es decir, los forman ondas electromagnéticas como la luz, aunque de mucho mayor frecuencia; de ahí su gran penetración.
Otro descubrimiento temprano y trascendente de Soddy y Rutherford, publicado en 1903, llega muy hondo al corazón de la química. Afirman que un elemento radiactivo, al emitir rayos beta o alfa, se convierte en un elemento químico distinto. Los elementos de la tabla periódica de Mendeleyev no eran, en consecuencia, inmutables. Esta afirmación, sencilla pero difícil de aceptar, contradecía uno de los axiomas básicos de la ciencia de aquella época. Parecía que la vieja alquimia renacía...
En efecto, la alquimia primitiva surge en Egipto al principio de la era cristiana y su origen se debe, qué duda cabe, al esfuerzo de los primeros metalurgistas por convertir en el laboratorio a los metales menos nobles en oro. Alejandría era entonces el cruce de todos los caminos intelectuales de la época: la filosofía helenística, el misticismo de Oriente y la tecnología egipcia —no por casualidad khemia, posible origen de la palabra química, significa Egipto—. En su afán por conservar sus secretos tecnológicos, los viejos alquimistas árabes comenzaron a emplear un lenguaje cifrado, cada vez más críptico y apto sólo para iniciados. El camino al misticismo estaba así abierto y la alquimia se alejó del laboratorio y por ende de la ciencia. Rutherford, sin embargo, vuelve la transmutación de los elementos al cauce científico, contradice uno de los postulados básicos de la química de su tiempo, y por ello recibe el premio Nobel de Química en 1908. Al recibirlo dice: "He visto muchas transformaciones en mi vida, pero ninguna tan rápida como la que acabo de experimentar, de físico a químico en un instante."
Pero el más grande logro de Rutherford fue probar la existencia del núcleo
atómico. Este hallazgo lo realizó con la ayuda de sus discípulos, el alemán
Hans Geiger y el neozelandés Ernest Marsden, entonces de sólo 25 y 18 años de
edad, respectivamente. A sugerencia de Rutherford, Geiger y Marsden midieron
la dispersión de rayos alfa por hojas delgadas de oro, encontrando un resultado
sorprendente: ¡había alfas dispersadas hacia atrás! Según Rutherford, dada la
enorme velocidad de esas partículas, era como si las balas de una pistola rebotaran
en hojas delgadas de papel. Geiger y Marsden publicaron sus resultados en 1909.
Dos años después, y luego de muchos cálculos, para los cuales empleó la mecánica
de Newton, Rutherford llegó a la conclusión siguiente: el campo eléctrico tan
intenso que se requiere para desviar las veloces partículas alfa sólo puede
producirlo una carga positiva muy concentrada en el corazón del átomo, un núcleo
que es 10 000 veces más pequeño que el átomo, es decir que ocupa una región
cuyo radio es cercano a 10-13cm.* ![]() Tal carga positiva está equilibrada por los electrones negativos que en alguna
forma circundan a este núcleo atómico.
Tal carga positiva está equilibrada por los electrones negativos que en alguna
forma circundan a este núcleo atómico.
Los grandes cambios de la cultura del hombre, y en particular de su ciencia, han surgido siempre cuando con argumentos sencillos pero contundentes se muestra que algo importante anda, en esencia, mal. Eso ocurrió con el modelo atómico basado en la física clásica que Rutherford imaginó: el átomo como un sistema planetario en miniatura: unos electrones con carga negativa orbitan alrededor de un núcleo, cuya carga es positiva y cuya masa es miles de veces mayor que la electrónica. Intuía, pues, que en lugar del Sol, estaba el núcleo atómico; que en vez de los planetas, se encontraban los electrones negativos, y que la fuerza de unión entre unos y otros, electrones y núcleo, ya no era la atracción gravitatoria como entre planetas y astro, sino la fuerza eléctrica de Coulomb, que entre cargas de signo opuesto es atractiva.
Si bien los experimentos en que Rutherford hacía chocar violentamente partículas alfa contra laminillas de oro y la existencia ya entonces bien conocida de los electrones sugerían de manera natural al gran físico neozelandés un modelo atómico como el antes descrito, concebir el átomo como un sistema planetario microscópico es incorrecto e insostenible si se cree al mismo tiempo en la estabilidad de la materia y en la física clásica —cuyos pilares son la mecánica de Newton y el electromagnetismo de Maxwell.—
El argumento que liquida el modelo planetario del átomo o que entierra a la física clásica es simple. La teoría electromagnética clásica nos dice que una carga acelerada como el electrón que da vueltas alrededor del núcleo debe radiar energía en forma de ondas electromagnéticas. La energía que estas ondas acarrean surge de la del propio electrón, por lo que éste pierde velocidad y se acerca al núcleo. Las órbitas electrónicas se acortan entonces más y más, y el electrón no recorre ya una elipse como si fuera un planeta sino una espiral que se encoge a cada instante. El destino final e irremisible de los electrones es el núcleo positivo que les atrae, y el átomo cesa de existir en un tiempo mil veces menor que el que tarda en llegar a nuestros ojos la luz de un foco que se enciende a un metro de distancia de nosotros. Los átomos clásicos a la Rutherford no son, pues, estables.
Para remediar tan incómoda situación, el gran físico danés Niels Bohr propuso en 1913 algunos postulados no ortodoxos y un tanto ad-hoc. Bohr suponía la existencia de unas cuantas órbitas electrónicas especiales: mientras el electrón se halla en ellas no radia, y sólo puede hacerlo al brincar de una a otra. Es decir; bajo ciertas condiciones dinámicas, aunque el electrón dé vueltas alrededor del núcleo y sufra la aceleración centrípeta, su energía se mantiene constante y no cae hacia el núcleo. El átomo de Bohr; por lo tanto, es estable. A pesar de lo poco intuitivo de estos postulados, el modelo de Bohr pudo explicar el espectro del átomo de hidrógeno, analizado experimentalmente por Balmer a finales del XIX.
Los postulados de Bohr y la física clásica son incompatibles. Todo parecería indicar; dados los logros del nuevo modelo y sus postulados no ortodoxos, que una nueva forma de pensar se hacía necesaria cuando se trataba de entender sistemas físicos microscópicos, como el átomo. Esos nuevos conceptos se fueron delineando de manera paulatina hasta quedar firmemente establecidos a finales de los años veinte con la mecánica ondulatoria de Schrödinger, la mecánica de matrices de Heisenberg y la simbiosis de ambas lograda por Dirac. Entonces surge la nueva física, la física cuántica.