IV. LA CORROSIÓN INDUCIDA POR CONTAMINACIÓN DEL AGUA
LAS aguas naturales son medios complejos, en evolución permanente,
que se pueden considerar en una primera aproximación como disoluciones de diferentes
especies químicas en agua. Las especies más abundantes son los iones, cationes
como Ca²+, Mg²+, Na+, Fe²+, etc., y iones como HCO-3,
CO23; SO24
Cl-, etc., así como gases, O2, CO2,
etc. y a veces H2S.
La agresividad de un agua depende de su capacidad para conducir la corriente eléctrica. Un agua poco conductora ocasionará que la actividad de las pilas de corrosión que se puedan formar en la misma sea pequeña, ya que el circuito eléctrico que se cierra a través de ella presenta una resistencia eléctrica elevada. En el agua de mar; cuya conductividad es muy alta por la gran cantidad de iones presentes, la actividad de los procesos de corrosión es tan alta, que en lapsos muy cortos se pueden originar fenómenos muy graves.
Un agua dulce y una de mar constituyen casos extremos, y entre ambos existen una gran variedad de aguas cuya agresividad frente a los metales varía en función de su composición y factores como la concentración de oxígeno disuelto, pH, temperatura, concentración de cloruros y sulfatos, agitación y velocidad del medio, etcétera.
El agua de mar se caracteriza por la gran estabilidad de sus propiedades fisicoquímicas, y sobre todo por su salinidad, que varía entre 30 y 37%. Por salinidad se entiende la cantidad de sales anhidras contenidas en 1 kg de agua de mar, lo cual puede determinarse evaporando 1 kg de esta agua de mar y pesando el residuo seco.
De manera aproximada, una composición química "tipo" de un agua de mar se presenta en el cuadro IV.1.
| |
|
| Compuesto |
Concentración, gramos/litro |
| |
|
| Cloruro de sodio, NaCl | 27.0 |
| Cloruro de magnesio, MgCl2 | 3.2 |
| Sulfato de magnesio, MgSO4 | 1.6 |
| Sulfato de calcio, CaSO4 | 1.3 |
| Sulfato de potasio, K2SO4 | 0.8 |
| Cloruro de potasio, KCI | 0.5 |
| Carbonato de Calcio, CaCO3 | 0.1 |
| Varios (bromuros, fosfatos) | 0.5 |
| |
|
| Total | 35.0 |
| |
|
El agua de mar, en la proximidad de las costas, puertos y lagunas costeras puede estar muy contaminada. En el cuadro IV.2 se presentan algunos resultados obtenidos de la agresividad de las aguas de diferentes puertos frente a diferentes metales. Destacan como las aguas más agresivas las del puerto de Barcelona, debido a su fuerte contaminación.
CUADRO IV.2. Penetración media del ataque, en µm/año, al cabo de dos años de inmersión en aguas de diferentes puntos geográficos.
|
|
|||
|
Lugar de inmersión
|
Acero
|
Zinc
|
Cobre
|
|
|
|||
| Barcelona, España |
0.43
|
0.053
|
0.052
|
| La Rochelle, Francia |
0.18
|
0.070
|
0.030
|
| Portsmouth, Inglaterra |
0.17
|
0.057
|
0.037
|
| Miami, EUA |
0.25
|
0.059
|
0.050
|
| Drobak, Noruega |
0.11
|
0.029
|
0.018
|
|
|
|||
Hay que señalar que la velocidad media de corrosión en un agua de mar no contaminada es de 0.12 µm/año.
Así, la contaminación desempeña un papel determinante en la agresividad de una determinada agua frente a los metales de uso más común. Tanto es así, que una posible indicación del grado de contaminación de un agua de mar puede llegar a establecerse por su velocidad de corrosión.
No se trata aquí de enlistar los diferentes contaminantes que pueden estar presentes en un agua de mar ni su origen, sino tan sólo de hacer notar que a la natural agresividad de la misma puede sumarse el efecto de dichos contaminantes. Por su especial importancia e incidencia pueden citarse entre éstos a los iones nitrato, NO-3 provenientes, por ejemplo, de los abonos químicos nitrogenados, que por su naturaleza oxidante depolarizan la reacción catódica de reducción del oxígeno, acelerando el proceso de corrosión. Asimismo, la presencia de fosfatos, provenientes de los detergentes, ha dado lugar a la proliferación de algas, muy especialmente en lagunas costeras, las cuales consumen gran parte del oxígeno disuelto presente en el agua, haciendo que el medio se vuelva anaerobio, con la consiguiente putrefacción de estas lagunas, que agravan los problemas de corrosión en el fondo de mares y lagunas por la posibilidad de crecimiento de bacterias sulfato-reductoras. El acero y el acero galvanizado son especialmente atacados en estas condiciones, ocasionándose problemas en todas aquellas estructuras sumergidas que no estén suficientemente protegidas (por ejemplo, con protección catódica). Si bien la corrosión microbiológica o bacteriana no es un problema nuevo en los fondos marinos, su incidencia en la falla de muchos sistemas sumergidos ha ido en aumento en los últimos años, al crecer la contaminación en las zonas aledañas a las costas.
En lo que se refiere a los problemas en otro tipo de aguas naturales, las redes de distribución de agua potable comprenden tuberías, válvulas, medidores, bombas, etc. Los materiales más utilizados son: concreto, hierro, acero, cobre, PVC, etc. La acción del agua sobre algunos metales como el hierro puede provocar problemas de corrosión. Asimismo, el equilibrio calco-carbónico del agua proporciona a ésta propiedades agresivas o incrustantes que se reflejan en las tuberías de las redes de distribución, efectos que pueden sumarse a los motivados por procesos microbianos.
Muy a menudo la incidencia de la corrosión se refleja en su vertiente económica: inutilización de tuberías, válvulas, bombas e incluso captaciones subterráneas. Países como Dinamarca y Suecia han calculado un costo anual de entre 5 250 000 y 5 650 000 dólares por habitante por problemas de corrosión en 1983. Por otra parte, la calidad del agua puede cambiar en relación con la finalidad a que es destinada (puede tener mal gusto, sólidos en suspensión, color, etc.), a causa de alteraciones de las características organolépticas de la misma, y existe incluso el riesgo de pasar en forma de solución, dependiendo de las características de las tuberías, metales pesados que pueden ser tóxicos (Cd, Pb, etc.). Por esta razón, en muchos países no se autoriza actualmente la instalación de tuberías de Pb.
Como puede verse, las formas de corrosión pueden ser muy diversas. El problema es complejo porque los factores motivadores son muy diversos. Entre los más importantes se encuentran las condiciones del flujo, la composición de los ductos y las características biológicas y fisicoquímicas del agua. Cabe señalar que la presencia en el agua de determinadas floras bacterianas (bacterias sulfato-reductoras y ferrobacterias) incide directamente en el aumento de la corrosión del sistema. Las características químicas del agua pueden favorecer más la presencia de esta flora bacteriana que acelerará el fenómeno. Así, por ejemplo, el mecanismo de los procesos de corrosión del hierro por procedimientos químico-biológicos puede explicarse y entenderse con ayuda del esquema presentado en la figura IV.I.
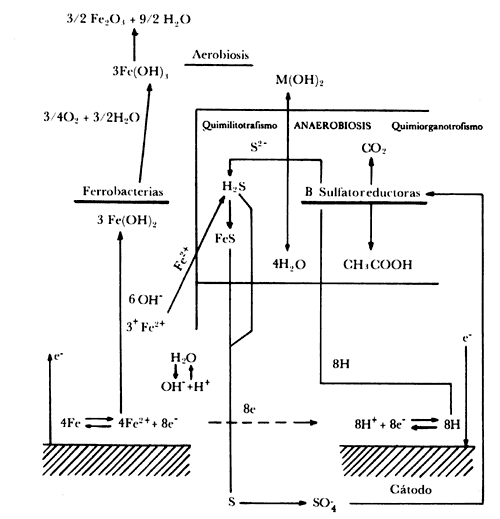
Figura IV. 1 Mecanismo químico biológico en los procesos de corrosión del hierro en medio acuoso
En relación con las características fisicoquímicas del agua, cabe enumerar las siguientes: temperatura, pH, sales disueltas, oxígeno y bióxido de carbono disueltos, y prácticamente todos los cationes y aniones que intervienen en la composición mineralógica normal del agua: cloruros, bicarbonatos, carbonatos, sulfatos, sodio, calcio, magnesio, etcétera.
Las sales corrosivas más importantes son los cloruros, Cl-. Muchas aguas subterráneas contienen cloruros provenientes de procesos de contaminación (infiltración de aguas superficiales provenientes de actividades mineras, de tiraderos industriales y de fenómenos de intrusión marina, fundamentalmente), y las aguas superficiales están cada vez más contaminadas por deposiciones antropogénicas. Concentraciones de cloruros superiores a 100 mg/1 en aguas de dureza mediana pueden causar problemas de corrosión, crecientes en forma exponencial, de tal manera que concentraciones de iones cloruro de 1 g/1 provocan rápidamente la destrucción por corrosión de metales como el hierro y el acero inoxidable.
Asimismo, la presencia de sales disueltas modifica la estructura de las posibles incrustaciones existentes, volviéndolas porosas y heterogéneas, de tal forma que no constituyen una protección de las superficies metálicas. También se pueden formar zonas de aireación diferencial, al absorberse el oxígeno presente en el agua.
En cuanto a los sulfatos, en principio son poco corrosivos, aunque intervienen en el ciclo del azufre, S (véase la figura IV.1), y en sistemas anóxicos pueden contribuir a la formación de ácido sulfhídrico, H2S compuesto muy agresivo que provoca problemas de corrosión muy serios. El poder corrosivo de los sulfatos, SO24 aumenta al asociarse a los Cl-, especialmente en aguas blandas, de baja alcalinidad y que no estén saturadas con CaCO3. La presencia de Ca2+ en el agua, asociada al equilibrio calco-carbónico puede contribuir; en aguas incrustantes, a proteger el sistema frente a la corrosión.
El tradicional axioma de que un agua incrustante no es corrosiva debe manejarse con cuidado. La presencia de un agua estable o sobresaturada en relación al CaCO3, aun cuando es una condición satisfactoria para la prevención de la corrosión, es un remedio que tiene muchas limitaciones.
En la formación de una película protectora sobre el metal no sólo hay que tomar en cuenta los datos típicos que se reúnen para deducir el pH de saturación del CaCO3, aunque algunas veces éstos pueden dar una idea bastante aproximada.
En las aguas potables existen o pueden existir muchas especies químicas que afectan de muy distinto modo la corrosión de los metales. Así, mientras una cierta dureza cálcica y una alcalinidad suficiente favorecen la formación de una capa protectora de CaCO3, la presencia de ciertas sales disueltas: Cl, SO24 y NO3-, en concentraciones que sobrepasen un cierto umbral, puede cambiar radicalmente las características de dicha capa protectora, lo cual ocasiona un mayor ataque al metal base. Los iones agresivos interfieren en el depósito de la capa protectora, y es conocido el efecto detrimental de los iones cloruro en la corrosión de los metales.
En cuanto a las especies contaminantes que pueden estar presentes en el agua y que ayudan en el proceso de corrosión, hay que citar de nuevo a los iones nitrato. El exceso de nitratos es determinante para la clasificación de agua como no potable, por la incidencia que tienen dichos aniones sobre la población, especialmente la infantil, ya que se pueden combinar con la hemoglobina de la sangre.
La contaminación por nitratos es especialmente significativa en las comunidades rurales, donde los pozos de captación de agua, la mayoría de las veces artesanales y de poca profundidad, facilitan una contaminación bacteriológica y química de nitratos. Se ha encontrado que existe una relación directa entre la concentración de nitratos y las prácticas agrícolas, ya que las concentraciones máximas se han obtenido en épocas en que se aplica una mayor cantidad de abono (abonos químicos nitrogenados o nitrato de sodio directamente). El problema se agudiza en las aguas de abastecimiento, en las cuales la poca profundidad de los niveles freáticos y la permeabilidad de los materiales próximos a la superficie hacen que su vulnerabilidad a dicha contaminación sea muy acentuada.
La concentración máxima permitida de nitratos en un agua, para que sea potable, es de 50 mg/1. Así, en las redes de distribución de agua potable en las cuales se mantenga un buen control de la potabilidad de la misma, no se presentan problemas de corrosión graves.
Desde hace mucho tiempo se conoce el papel que desempeñan las bacterias en los procesos de corrosión metálica. Los primeros trabajos en este campo se deben a Von Wolzogen-Kuhr, que en 1923 puso en evidencia el mecanismo electroquímico del ataque del hierro por los microorganismos sulforreductores.
Los microorganismos constituyen un vasto mundo de seres unicelulares extendidos por toda la biosfera, y desempeñan un importante papel en la naturaleza. Gran número de ellos, en el suelo o en el agua, descomponen activamente la materia orgánica y los minerales, participando así en los ciclos naturales del carbono, nitrógeno y azufre.
Durante los procesos biológicos se forman numerosos productos. Hay productos finales de combustión: CO2 y H2O, por ejemplo; gases, como hidrógeno, nitrógeno y oxígeno; sustancias, como el amoniaco, agua oxigenada, azufre, etc. productos ácidos o alcalinos. Todos estos productos se acumulan en el medio, modificando de forma continua su composición.
Ciertas bacterias son capaces de efectuar su síntesis a partir del agua, del anhídrido carbónico (CO2) y de algunas sales minerales; éstas son las bacterias autótrofas. Se consideran como bacterias heterótrofas las especies incapaces de efectuar por sí mismas la síntesis de todos sus factores de crecimiento.
La corrosión microbiana puede definirse como un proceso metabólico bacteriano que origina o acelera la destrucción de los metales.
Los microorganismos influyen sobre los procesos de corrosión a través de mecanismos que les permiten adquirir la energía necesaria para las actividades vitales. Esta energía puede adquirirse a través de tres medios:
a) Respiración aerobia, que consiste en la eliminación progresiva de hidrógeno de los sustratos orgánicos. El hidrógeno es oxidado por el oxígeno del aire.
b) Respiración anaerobia, en la cual el sustrato orgánico es también oxidado por eliminación de hidrógeno, y éste reduce los compuestos inorgánicos.
c) Fermentación, proceso anaerobio en el cual el sustrato orgánico no es completamente oxidado.
Al igual que la corrosión, los procesos metabólicos se basan en la transferencia de iones hidrógeno o de electrones. La actividad de los microorganismos corresponde a valores de pH del medio que son también muy favorables a la corrosión.
Los microorganismos que desempeñan un papel en la corrosión pueden clasificarse de dos maneras: desde los puntos de vista fisiológico y los taxonómicos. Se piensa, generalmente, que la corrosión de los metales se debe a las bacterias anaerobias, por ejemplo, el desulfovibrio. Sin embargo, existen diversos tipos de bacterias que hay que tener muy en cuenta desde el punto de vista de la corrosión, como las bacterias del hierro, thiobacterias, y las bacterias aerobias que producen ácido sulfhídrico.
El potencial de oxidación de las bacterias se puede medir, y la intensidad de la oxidación se caracteriza por la pérdida de electrones. No hay dificultad en medir estas ganancias o pérdidas de electrones con la ayuda de un potenciómetro, utilizando un electrodo de platino como punto cero y un electrodo de referencia, por ejemplo, uno de calomelanos (mercurio/cloruro mercurioso).
Cuando una sustancia puede ceder electrones a un electrodo inerte y la sustancia oxidada puede recibir electrones de este electrodo, se dice que es una sustancia electroactiva.
Los cultivos microbianos son casi siempre sistemas fuertemente reductores. La actividad metabólica de las bacterias, resultante de su crecimiento y de su nutrición, sólo es posible gracias a la energía suministrada por la oxidación de los elementos nutritivos que ocasionan condiciones de reducción en el medio.
Las bacterias aerobias reducen los medios hasta un cierto nivel, que en general es moderado, aunque en algunos casos se llega a niveles altos. Las anaerobias presentes se aprovechan de estas nuevas condiciones y proliferan a su vez.
Así, los fenómenos de óxido-reducción desempeñan un papel muy importante en los procesos biológicos. Existen sustancias más fácilmente oxidables que otras. Esto puede determinarse midiendo la fuerza electromotriz o la diferencia de potencial generada por la corriente de electrones, obligándolos a pasar por un hilo conductor. Es lo que se conoce como potencial redox del medio. Este potencial se relaciona con el pH, la temperatura y la relación existente entre la concentración de sustancia oxidada y reducida. Las condiciones de oxidación corresponden a un potencial elevado; las de reducción, a una disminución del potencial.
Las bacterias más comunes se desarrollan a potenciales próximos o inferiores a 0 y pH comprendidos entre 6 y 9, zonas favorables a la corrosión. Esto quiere decir que si en un medio donde hay bacterias —que existen en todas partes en la naturaleza— los aportes nutritivos de origen orgánico son suficientes, las bacterias entran rápidamente en actividad, multiplicándose y metabolizando diferentes sustancias. Estos procesos ocasionan, de forma automática, la disminución del potencial redox, originando las condiciones electroquímicas favorables a la corrosión. Si estas condiciones existían ya, por la naturaleza del medio, serán activadas, y si no existían serán el origen de la corrosión.
Los microorganismos no pueden desarrollarse más que en determinadas condiciones de pH. Para cada grupo microbiano existen pH límites y un pH óptimo. En general, los medios neutros convienen a las bacterias heterótrofas que pueblan los medios naturales. Los límites de crecimiento de estas bacterias oscilan entre los pH de 5.5 a 8.5 o 9. Ciertas especies, como el Thiobacillus, se cultivan a pH muy bajos, de entre 1.8 y 2.
La corrosión anaerobia se considera posible en valores de pH comprendidos entre 5.5 y 8.5, en cuyo caso el valor del potencial redox permite establecer la siguiente clasificación de suelos debida a Starkey y Wright.
| |
|
| Potencial redox, mV |
Riesgo de corrosión anaerobia |
| |
|
| <100 |
Severo |
| 100-200 |
Moderado |
| 200-400 |
Ligero |
| >400 |
Nulo |
| |
|
Hablando en términos generales, cualquier suelo con un contenido apreciable de sulfatos y con un potencial redox de +200 mV a menor está, probablemente, en camino de convertirse en anaerobio y debe considerarse peligroso.
La corrosión anaerobia, originada por el desulfovibrio, se observó por primera vez en el suelo de los Países Bajos, en 1923, donde se comprobó la aptitud de estas bacterias para corroer el hierro y el acero, formándose sulfuro ferroso como producto de la corrosión.
Para comprender la forma en que estos organismos intervienen en los mecanismos de corrosión, debemos recordar los procesos básicos de la corrosión electroquímica. Para que exista corrosión, para que se pueda formar la clásica "herrumbre", constituida por hidróxido férrico, deben estar presentes tres elementos: hierro metálico, humedad y oxígeno.
La corrosión del hierro o el acero en presencia de oxígeno es un proceso electroquímico. El lugar donde el metal sufre la corrosión, donde el hierro pasa del estado metálico al iónico, y después al de solución, se llama ánodo. La reacción anódica puede escribirse de la manera siguiente:
Los dos electrones liberados en el proceso anódico se desplazan, a través de la masa metálica, al cátodo o zona catódica. En ésta, los dos electrones son captados por los iones H+ presentes en la solución (electrolito), que pasan a hidrógeno atómico (H), el cual es liberado como moléculas de hidrógeno gas (H2). La reacción catódica se puede escribir de la siguiente forma:
Esta simple exposición nos sirve para ilustrar la naturaleza electroquímica de los procesos de corrosión. En el ánodo tienen lugar las reacciones de oxidación o deselectronación, mientras que en el cátodo tienen lugar las de reducción o electronación.
En el caso de una pila de corrosión sencilla existe una interacción entre los productos originados por las reacciones anódicas y catódicas. El hidróxido ferroso, Fe(OH)2, es un resultado de los iones ferrosos, Fe2+, formados en el ánodo y los iones hidróxilo, OH-, formados en el cátodo; la carga negativa de los iones hidróxilo dará lugar a que estos iones migren en la solución hacia las áreas anódicas, en las cuales hay un exceso de carga positiva, debido a la presencia de los iones ferrosos formados. El hidróxido ferroso se forma cuando ambos iones con carga opuesta se encuentran, reaccionan y se precipita el correspondiente hidróxido. La reacción es la siguiente:
Este hidróxido ferroso se oxida a hidróxido férrico, Fe (OH)3, la conocida herrumbre, por el oxígeno disuelto en el agua (electrolito):
La figura IV.2 ilustra, de forma esquemática, este proceso.
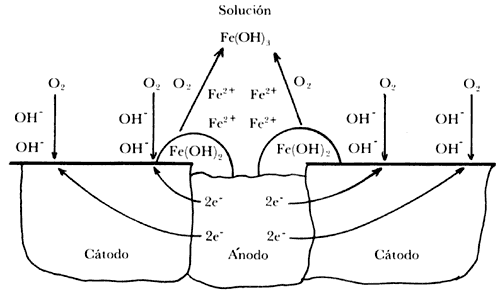
Figura IV. 2. Diagrama que muestra la formación de hidróxido ferroso e hidóxico férrico (herrumbre) por el proceso de corrosión.
Aunque el desulfovibrio causa la corrosión del hierro y del acero en ausencia de aire, queda patente, con lo indicado anteriormente, que el oxígeno es necesario en los procesos electroquímicos de corrosión, en los cuales se produce el hidróxido ferroso y el hidróxido férrico como productos resultantes. Veamos la relación existente entre los dos mecanismos de corrosión, el de oxidación y el bacteriano.
De acuerdo con la teoría electroquímica de la corrosión, para que ésta pueda tener lugar es necesaria la existencia de un ánodo, un cátodo y un electrolito (medio agresivo). En la figura IV.3 puede comprobarse que de la reacción en las áreas catódicas resulta la formación de hidrógeno molecular; H2, sobre la superficie del cátodo. En soluciones neutras, como las de cloruro de sodio, la formación de hidrógeno y su evolución como hidrógeno gaseoso son muy lentas. Éste puede ser el origen de la formación de burbujas de hidrógeno sobre la superficie catódica. Cuando esto sucede, esta película de burbujas de hidrógeno formada sobre el cátodo puede ocasionar tal disminución de la velocidad de corrosión, que puede llegar a detenerla completamente. Este fenómeno se conoce con el nombre de polarización catódica. La polarización catódica por burbujas de hidrógeno se presenta esquemáficamente en la figura IV.3.
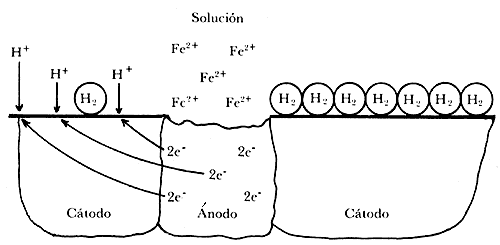
Figura IV.3. Esquema representativo de la polarización local de un cátodo por una capa de burbujas de hidrógeno.
El oxígeno disuelto en el electrolito neutro reacciona con el hidrógeno acumulado para formar agua, H2O; de esta forma el proceso de corrosión continúa. En este proceso, el oxígeno actúa como un despolarizante catódico.
El desulfavibrio, al igual que el oxígeno disuelto, actúa como despolarizante catódico; de esta forma el proceso de corrosión continúa. La figura IV.4 presenta, en forma esquemática, la corrosión bacteriana del hierro y del acero por el desulfovibrio.
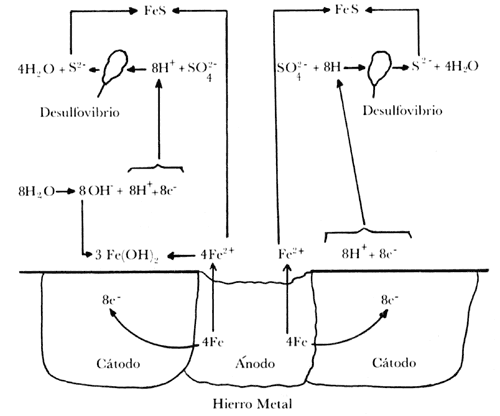
Figura IV. 4. Esquema representativo de la corrosión bacteriana del hierro por el desulfovibrio, de la cual se obtiene, como producto de corrosión, el fulfuroso ferros (Fes). reacción global: L4fe + SO42- + 4 H2O ---feS + 3Fe (OH)2 + 2OH-.
La teoría electroquímica de la corrosión bacteriana del acero por el desulfovibrio fue publicada por primera vez en 1934, por Von Wolzogen-Kuhr. Sin embargo, esta bacteria se asoció con la corrosión y deterioro de las tuberías enterradas en Holanda mucho antes, en 1923.
Aunque el mecanismo electroquímico de la corrosión bacteriana ha sido probado y aceptado, investigaciones posteriores han puesto de manifiesto que no es el único mecanismo a través del cual el desulfovibrio ataca al hierro y al acero. El mecanismo ectroquímico de corrosión dispone de varias especies de desulfovibrio, las cuales producen la enzima hidrogenasa.
Recordemos que las sustancias que aceleran las reacciones químicas, sin que se consuman en el proceso, se llaman catalizadores; los catalizadores que están formados por células vivas de animales y plantas reciben el nombre de enzimas.
La hidrogenasa es una sustancia orgánica que cataliza la oxidación del hidrógeno (es decir cataliza la transferencia de electrones), activando, por tanto, la despolarización catódica:
Durante algún tiempo se llegó a pensar que sólo estas especies de desulfovibrio, las que producían la enzima, causaban la corrosión del hierro y del acero. Sin embargo, actualmente se sabe que tanto en las especies que producen hidrogenasa como en aquellas que no la producen la velocidad de corrosión es lineal y aproximadamente igual. Esto se debe a que la película parcialmente protectora de sulfuro ferroso no se forma sobre la superficie del metal. La velocidad de corrosión depende de la naturaleza y comportamiento de la película sulfurosa formada sobre la superficie del metal.
Con una película parcialmente protectora, formada sobre la superficie del metal, la velocidad de corrosión originada por la hidrogenasa positiva fue mucho mayor que la originada por la hidrogenasa negativa.
La acción corrosiva de la hidrogenasa negativa permite suponer que la corrosión ocurre como resultado del ácido acético formado en la interfase metal/sulfuro ferroso.
Es evidente también que hay corrosión por el simple ataque del sulfuro de hidrógeno generado por estos organismos sobre el hierro y el acero, dando lugar así a la formación y precipitación de sulfuro ferroso negro. Los iones sulfuro que así se forman actúan, por otro lado, como despolarizantes anódicos, al reaccionar con los iones ferrosos para formar el sulfuro ferroso.
Al igual que las bacterias anaerobias, las aerobias pueden ser también el origen de fuertes corrosiones. Por un lado, ocasionan la formación de ácido sulfúrico y, por otro, forman sobre el metal precipitados que, al quedar adheridos en forma aislada, originan procesos de aireación diferencial y, por lo tanto, de formación de picaduras.
Estas bacterias están representadas por las bacterias ferruginosas y los thiobacillus.
Bacterias ferruginosas. Estas bacterias están muy extendidas en la naturaleza; se las encuentra, a veces, en gran abundancia en aguas que contienen sales ferrosas disueltas. Van siempre asociadas a depósitos de hidróxido férrico.
Existen dos tipos de bacterias ferruginosas: las unicelulares y las pluricelulares. Las verdaderas bacterias ferruginosas son aerobias y, en principio, autótrofas. Se caracterizan por acumular hidróxido férrico alrededor de sus células, lo que origina que en sus proximidades aparezcan zonas manchadas con el conocido color de la herrumbre. La más conocida es la Gallionella. La clásica reacción de su metabolismo es la siguiente:
Estas bacterias son el origen de la formación de incrustaciones sobre la superficie metálica y, por lo tanto, de procesos de aireación diferencial que desembocan en la formación de picaduras.
Thiobacillus. Las bacterias Thiobacillaceae son aerobias autótrofas, y se caracterizan por crear en el medio donde se multiplican una reacción fuertemente ácida. Su pH óptimo de crecimiento se sitúa entre 3 y 4, y se pueden incluso cultivar a pH 0.2-0.6.
Todos los metales susceptibles al ataque por ácido sulfúrico diluido (10%) sufrirán una fuerte corrosión en presencia de estas bacterias. Estas bacterias son el origen de formación de pH muy bajos, concretamente de formación de H2SO4. En suelos que contengan sulfuros (piritas) pueden ocasionar fuertes corrosiones en cualquier estructura que pueda estar bajo sus efectos.
Los representantes más conocidos de este grupo son: Thiobacillus thiooxidans, Thiobacillus thioparus, Thiobacillus denintrificans, Thiobacillus ferrooxydans, etcétera.
Por último, cabe señalar que el medio marino, de pH próximos a 7.5-8, es siempre favorable al crecimiento microbiano. Desde el momento en que las partículas cargadas de microbios se depositan en la superficie de los metales para constituir la película microbiana (lo cual puede suceder en pocas horas), las bacterias entran en actividad y provocan la disminución del potencial redox. Las condiciones de corrosión se realizan in situ y el deterioro del metal aparece en unos días.
A modo de conclusión de todo lo anterior, es importante señalar que si no existen las condiciones para que haya corrosión en un determinado medio, las bacterias pueden crearlas, a condición (para las heterótrofas) de que exista en el medio materia orgánica. Cuanto mayor sea la cantidad de materia orgánica contenida en un electrolito, mayores serán los gérmenes y mayor y más intensa la actividad bioquímica, y por lo tanto, la corrosión.
Las aguas de muchos puertos, lagunas y zonas costeras, fuertemente contaminadas por los desechos de las ciudades, son origen de graves problemas en las instalaciones portuarias, eléctricas, etc., que se encuentran en ellas.
Todo ello justifica plenamente los esfuerzos que realizan numerosos investigadores en todo el mundo para estudiar y conocer mejor el mecanismo de desarrollo de estos organismos, con el fin de tratar de combatirlos y reducir, en lo posible, las grandes pérdidas que ocasionan.
Existe abundante información relacionada con el tema de la corrosión atmosférica. Algunos libros que pueden ayudar al lector a profundizar en el tema son:
S. Felíu y M. Morcillo, Corrosión y protección de los metales en la atmósfera, Ediciones Bellaterra, Barcelona, 1982.
W.H. Ailor, "Atmospheric Corrosion", John Wiley and Sons, Nueva York, 1986.
"Corrosión in Natural Environments", ASTM, STP 558, Filadelfia, 1974.
"Metal Corrosión in the Atmosphere", ASTM, STP 435, Filadelfia, 1968.
Para todos aquellos lectores que después de leer el libro sientan la inquietud de montar su propia estación de corrosión atmosférica, o decidan evaluar la agresividad potencial de una determinada atmósfera, pueden recibir asesoría en las siguientes direcciones:
Doctor Luis S. Hernández, Instituto de Metalurgia, Av. Dr. Manuel Nava Núm. 5, Universidad Autónoma de San Luis Potosí, SLP.
Doctor Jorge Uruchurtu, Instituto de Investigaciones Eléctricas, Palmira, Cuernavaca, Morelos.
Doctor J. Genescá, Facultad de Química, Universidad Nacional Autónoma de México, Ciudad Universitaria, 04510 México, D.F.
La coordinación en México del proyecto "Mapa Iberoamericano de Corrosión Atmosférica"
(MICAT) se encuentra en el IIE y en la Facultad de
Química de la UNAM.
![[Inicio]](../img/begin.gif)
![[Anterior]](../img/prevsec.gif)

![[Siguiente]](../img/nextsec.gif)