APÉNDICE 1
1) PREPARACIÓN DE LOS PLATOS DE SULFATACIÓN PARA EXPOSICIÓN (ISO 9225:1992).
Equipo, material y reactivos utilizados. El equipo necesario es una estufa a una temperatura de 40 a 60 ºC y un agitador magnético.
El material utilizado es el más común que existe en el laboratorio: vasos de precipitados, vidrio de reloj, papel filtro y cajas petri de poliestireno (se pueden utilizar cajas con un diámetro de 8.5 cm).
Los reactivos son: dióxido de plomo, goma de tragacanto, acetona y agua destilada.
PROCEDIMIENTO DE PREPARACIÓN DE LOS PLATOS DE SULFATACIÓN
Se coloca un círculo de papel filtro en la base de la caja petri de modo que ésta quede cubierta por completo. Se vierte acetona en cantidad tal que moje totalmente el papel filtro de la caja Petri. Presionar firmemente el papel con el vidrio de reloj, cuidando que todas las partes del papel sean presionadas sobre la base de la caja; hacer esto hasta que la acetona se evapore.
Lavar y llenar los platos con agua destilada y dejarlos en reposo durante una hora.
En la preparación de la pasta de dióxido de plomo debe mantenerse la relación de agua con la goma de tragacanto, que es de 900 ml de agua a 3.5 g de goma. Estas cantidades se mezclan a una velocidad alta hasta lograr la homogeneización de la mezcla. Disminuir la velocidad de agitación y continuar hasta completar dos horas de agitación.
Convertir 3.5 g de papel filtro a pulpa de papel y agregarla a 350 ml de la mezcla anterior (la mezcla restante puede ser almacenada). Agitar hasta lograr una mezcla suave y uniforme. Agregar 112 g de dióxido de plomo, aumentando la velocidad de agitación.
En los platos que se prepararon inicialmente, vaciar 16 ml de la mezcla anterior, extendiéndola hasta la orilla de cada plato. Después de esta operación, colocar los platos (destapados) en una estufa a una temperatura de 40-50 ºC por un tiempo de 20 horas. Los platos que no vayan a ser expuestos deben taparse perfectamente bien.
2) EXPOSICIÓN A LA ATMÓSFERA DE LOS PLATOS DE SULFATACIÓN
Se utiliza un soporte para exponer los platos, los cuales deben estar en una posición tal que la pasta de dióxido de plomo quede hacia abajo. Estarán horizontales y no serán obstruidos por el viento normal ni por la circulación de corrientes de aire. El soporte debe ser de un material resistente a la corrosión atmosférica (por ejemplo, de aluminio). Un esquema del mismo se presenta en la figura 1.
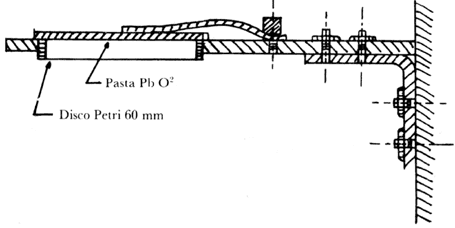
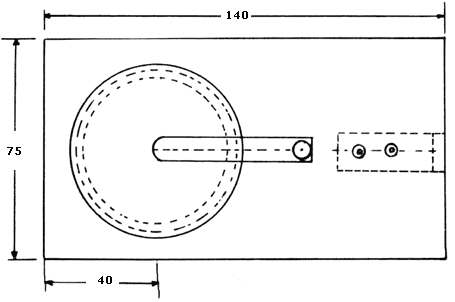
Figura 1. Apéndice 1. Soporte para plato de sulfatación.
El periodo de exposición recomendado es de 30±2 días. Los platos pueden ser expuestos durante los 120 días posteriores a su preparación. Al concluir el periodo de exposición, los platos deben ser cubiertos perfectamente y su análisis debe realizarse dentro de los siguientes 60 días.
3) ANÁLISIS QUÍMICO DE LOS PLATOS DE SULFATACIÓN
El contenido de sulfato del plato es removido y precipitado usando una solución de carbonato de sodio. Después el sulfato es precipitado con cloruro de bario, y su concentración se termina por medio de una turbidimetría.
Reactivos: solución de carbonato de sodio 5%: disolver 5O±0.5 g de Na2CO3 anhidro en un litro de agua.
Solución de ácido clorhídrico 0.7M: diluir 60 ml de ácido clorhídrico concentrado en un litro de agua.
Solución de sulfato de sodio: disolver 0.740 g de Na2SO4 anhidro y enrasar a un volumen de 1 litro.
Cloruro de bario grado reactivo (BaCl22H2O).
Análisis. Desprender con una espátula el dióxido de plomo del plato y vaciarlo a un vaso de precipitados. Adicionar 20 ml de solución de carbonato de sodio y agitar. Dejarlo reposar (reaccionar) durante tres horas, agitando ocasionalmente.
Pasadas las tres horas someterlo a un baño maría durante 30 minutos. Enfriar y ajustar volumen a 50 ml con agua destilada.
Filtrar la solución en un papel filtro Whatman núm. 42. A 10 ml de esta solución adicionar de 5 a 7 ml de ácido clorhídrico con el fin de obtener un pH de 2.5 a 4. Si no resulta así, repetir el paso.
Vaciar una alícuota de 5 ml de la solución con pH de 2.5 a 4 a un tubo de ensaye y adicionar agua hasta completar un volumen de 20 ml. Agregar aproximadamente 0.3 g de cloruro de bario, agitar vigorosamente y dejar reposar durante unos 3 min. Efectuar la medida turbidimétrica en un espectrofotómetro (por ejemplo, Perkin Elmer) a una longitud de onda de 500 nm. Con el valor de la turbidez se obtienen los gramos de sulfato a partir de la curva de calibración elaborada previamente.
Se realiza el análisis de un plato no expuesto de la misma manera que el de los platos expuestos.
Curva de calibración. En un matraz volumétrico de 100 ml diluir 10 ml de la solución estándar de sulfato.
Pipetear los siguientes volúmenes de la solución anterior a tubos de ensaye: 1, 2, 3, 4, 5, 6 y 7 ml. Diluir con agua cada tubo hasta un volumen de 20 ml. Agregar a cada tubo aproximadamente 0.3 g de cloruro de bario, mezclar vigorosamente y dejar reposar antes de hacer la medida. turbidimétrica a cada tubo.
Hacer una gráfica de la densidad óptica contra el contenido de sulfato correspondiente a: 50, 100, 150, 200, 250, 300 y 350 µg.
4) EVALUACIÓN DE LOS RESULTADOS DEL ANÁLISIS
La velocidad de depósito de dióxido de plomo se calcula de acuerdo con la fórmula:
S = Contenido de sulfato en un plato expuesto (µg). Dato directo de la curva de calibración.
SB = Contenido de sulfato en un plato no expuesto (µg). Dato directo de la curva de calibración.
a = Área del plato expuesto (m²). En este caso es de 5.67 10-3m².
t = tiempo de exposición (días).
R = Velocidad de depositación de SO2 (mg/m² día).
Es necesario hacer una comparación de los datos obtenidos a partir de este procedimiento con los resultados de otro método, con el fin de verificar la validez de las mediciones realizadas..
La curva de calibración que se presenta en la figura 2 se construyó a partir de los siguientes valores:
|
|
||
|
C (mgSO4)
|
A
|
|
|
|
||
|
50
|
0.035 | |
|
100
|
0.055 | |
|
150
|
0.065 | |
|
200
|
0.07 | |
|
250
|
0.075 | |
|
300
|
0.078 | |
|
350
|
0.08 | |
|
|
||
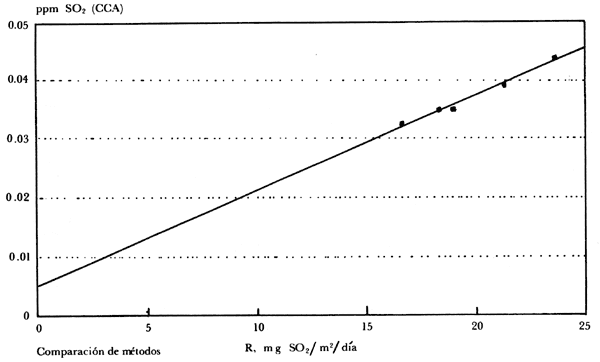
Figura 2. Apéndice 1. Curvatura de calibración.
6) DATOS OBTENIDOS DEL ANÁLISIS QUÍMICO DE LOS PLATOS DE SULFATACIÓN
Los datos obtenidos a partir del análisis de los platos se presentan en el cuadro 2:
CUADRO 2.
|
|
||||
|
Mes
|
Días
|
mgSO4
|
R(mgSO2/m2día)
|
CCA (ppm)
|
|
|
||||
| Enero |
30
|
350
|
23.32
|
0.0433
|
| Febrero |
18
|
215
|
21.25
|
0.0396
|
| Marzo |
30
|
264
|
16.46
|
0.0332
|
| Abril |
30
|
285
|
18.23
|
0.0347
|
| Mayo |
30
|
292.5
|
18.82
|
0.0351
|
|
|
||||
|
CCA= Datos del Centro de Ciencias de la Atmósfera. mgSO4 = Datos leídos en la gráfica de calibración. |
En el caso del plato no expuesto, se obtuvo un valor de 52. 56 µg SO2.
En la figura 3 se presenta una comparación de los valores obtenidos con el
método propuesto, con los obtenidos en el mismo periodo por el doctor Humberto
Bravo, del Centro de Ciencias de la Atmósfera de la UNAM, situado
a pocos metros de distancia del Edificio "D" de la Facultad de Química, que
es donde se efectuaron estas mediciones. Como puede observarse, todos los puntos
están sobre la línea recta que pasa aproximadamente por el origen de la gráfica,
lo cual es una medida de la buena correlación existente entre los valores determinados
por métodos distintos. Hay que resaltar que mientras unos valores se refieren
a la concentración del SO2 en el aire, los
otros dan idea de la cantidad de SO2 que llega
a una superficie, valor importante con relación a la determinación de la influencia
del SO2 en la velocidad de corrosión de un
metal.

Figura 3. Apéndice 1. Rapidez de depósito de SO2.
![[Inicio]](../img/begin.gif)
![[Anterior]](../img/prevsec.gif)

![[Siguiente]](../img/nextsec.gif)