III. PROPIEDADES DE LOS VIDRIOS
GENERALMENTE, cuando pensamos en el vidrio nos imaginamos un sólido
con una rigidez y elasticidad comparables a las del acero, pero con ciertas
propiedades mecánicas que limitan sus aplicaciones; como por ejemplo que no
tiene ductibilidad, ya que no se deforma a temperatura ambiente, y que si tratamos
de cambiar su forma aplicando una fuerza, lo único que logramos es que se rompa.
En realidad es un material duro pero frágil al mismo tiempo, y algo que refuerza
esa debilidad es la presencia de imperfecciones superficiales, como astilladuras
o ranuras.
El éxito en la manufactura del vidrio radica en controlar la temperatura del proceso, para regular las fuerzas internas que lo hacen quebradizo. Estas fuerzas internas también se aprovechan para producir vidrio de extrema dureza y resistencia si se emplea la técnica del templado. Templar un vidrio es someterlo a un calentamiento controlado y después enfriarlo rápidamente. La superficie queda en un estado permanente de compresión, de modo que las fuerzas que se apliquen al objeto tendrán que vencer primero las tensiones de comprensión. El efecto del templado se puede demostrar con las conocidas gotas de Prince Rupert, como se ve en la figura 26. En este experimento se dejan caer unas gotas de vidrio fundido en agua fría. Aquellas gotas que sobreviven son muy resistentes, tanto, que puedes golpearlas con un martillo y no se rompen, pero si después de golpear una de ellas la presionas ligeramente con los dedos, la gota entera explota en fragmentos diminutos. De alguna manera la presión de los dedos actúa como una imperfección que se propaga a través de la pieza entera en respuesta del impresionante esfuerzo interno.

Por diversos experimentos se ha comprobado que la tensión en un vidrio puede
ser menor cuando éste ha sido templado dentro de cierto rango de temperatura.
En la figura 27 se muestra la temperatura de templado de un vidrio pyrex
contra el tiempo. Cuando la temperatura y el tiempo son bajos, en la figura
se indica con puntos, y cuando tienen valores mayores, aparecen círculos cada
vez más grandes. Esto quiere decir que, para el vidrio pyrex, cuando
la temperatura de templado es alta y el tiempo largo, la diferencia entre el
límite superior y el inferior es grande. El límite superior está determinado
por la temperatura a la cual el vidrio es un líquido que fluye con facilidad.
El límite inferior, también llamado punto de tensión, no está completamente
definido, aunque lo han descrito como la temperatura a la que una pieza puede
ser rápidamente enfriada sin que tenga una tensión permanente. Así, mientras
más separados estén estos límites es mejor, porque el rango en el que podemos
trabajar es mayor.
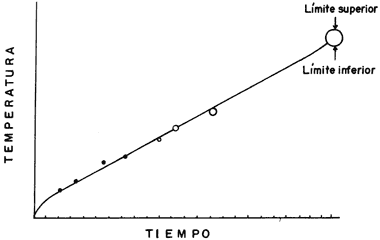
Figura 27. Curva de templado de un vidrio pyrex.
La viscosidad en un vidrio es otra propiedad de importancia práctica en todas las etapas de preparación porque de ésta depende la velocidad de fusión. Podríamos definir la viscosidad como la resistencia que presenta un líquido a fluir, pero si el vidrio parece un sólido, ¿por qué medimos su viscosidad? Lo hacemos porque los vidrios, en realidad, son líquidos sobreenfriados. Un líquido sobreenfriado es aquel que permanece como líquido a temperaturas más bajas que la de solidificación. Esto se logra llevando a cabo el enfriamiento en condiciones extremas de cuidado y pureza. La viscosidad de algunos líquidos sobreenfriados comienza a aumentar violentamente a medida que la temperatura disminuye y alcanzan una consistencia tal que su endurecimiento los hace aparecer como sólidos, pero en realidad tienen la misma estructura atómica que un líquido. Esto mismo le ocurre al vidrio.
Una forma de determinar la viscosidad es midiendo el tiempo que tarda en pasar una cantidad determinada de líquido a través de un tubo de diámetro pequeño a una presión dada. La resistencia a fluir se debe a la atracción entre las moléculas, por lo que es una medida de su fuerza. En general, a medida que aumenta la temperatura, las fuerzas de cohesión están más incapacitadas para competir con el creciente movimiento molecular, y por lo mismo la viscosidad disminuye.
Para tener un material con cierta resistencia es necesario que las moléculas estén unidas con una firmeza relativamente constante, lo que se traduce en tener una viscosidad invariable. Si medimos el tiempo requerido para que esto ocurra, observamos que la temperatura de templado es importante. En la figura 28(a) la temperatura de templado es menor que en la 28(b), y lo que vemos es que la primera tarda más en llegar a ser una línea horizontal que la segunda, y por lo tanto necesita más tiempo para que su viscosidad sea constante. Por otro lado, es evidente que también varía en función de la composición. En la figura 29 cada raya de la gráfica representa un valor diferente de x en la fórmula química que aparece en el pie de la figura. Es normal que al variar la cantidad de sodio y calcio cambien las propiedades del vidrio. Por otro lado, mientras mayor sea la proporción de óxido de aluminio, magnesio o calcio con respecto al óxido de sodio, mayor será la viscosidad, como puede verse en la figura 30, donde también se aprecia que la presencia de óxido de magnesio es la que aumenta más rápidamente esta característica.
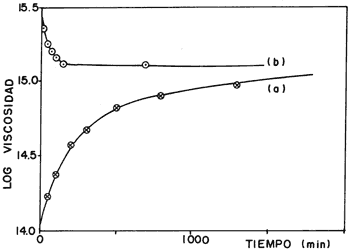
Figura 28. Curva de viscosidad de un vidrio tratado a 477° C (a) y a 486° (b).
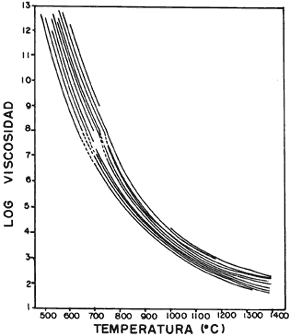
Figura 29. Cambio de la viscosidad (en poises) de algunos vidrios con fórmula (2—x)Na2O — xCaO — 6SiO2.
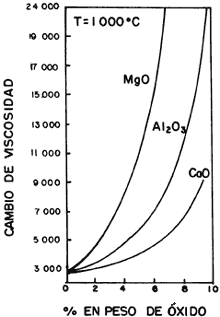
Figura 30. Variación de la viscosidad (en poises) a 1 000°C con respecto a la composición del vidrio.
Dentro de las propiedades térmicas podemos definir cuatro temperaturas de referencia en función de la viscosidad del vidrio. El punto de trabajo, donde la viscosidad del vidrio caliente es lo suficientemente baja como para poder darle forma utilizando métodos ordinarios. El punto de reblandecimiento, temperatura a la cual el vidrio empieza a deformarse de manera visible. El punto de recocido, que es cuando las tensiones internas existentes son desvanecidas, y que corresponde a la temperatura más alta de recocido. Por último el punto de deformación, donde el vidrio es un sólido rígido y puede enfriarse rápidamente sin introducir ningún tipo de tensiones externas.
La densidad, definida como el resultado de la masa entre el volumen, es otra propiedad de los vidrios que ha sido muy estudiada. Depende de factores como la temperatura, la presión a la que está sometido y la composición. En la figura 31 se observa que en un vidrio la densidad aumenta al incrementar la concentración de óxido de calcio (CaO) y de titanio (TiO2), mientras que cuando se eleva la cantidad de alumina (A12O3) o de magnesia (MgO) la densidad disminuye. Por otro lado, comparando un vidrio con fórmula Na2O-PbO-SiO2 con otro que contenga K2O-PbO-SiO2, vemos que se intensifica notablemente la densidad cuando el porcentaje de PbO es alto (figura 32), que con sodio (Na) es más alta que con potasio (K), y que cuando llegan alrededor de 40% de contenido de óxido de plomo prácticamente se igualan. En general, la densidad de un vidrio varía muy poco si cambiamos la presión.

Figura 31. Densidad de algunos vidrios de fórmula (2 — x)Na2O — x[MgO,CaO,Al2O3 o TiO2]6SiO en el punto de templado.
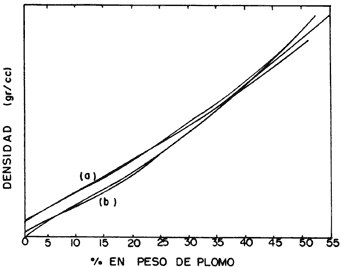
Figura 32. Densidad de diferentes vidrios de composición: a) Na2O — PbO— SiO2 y b) K2O —PbO—SiO2.
Cuando una pieza de vidrio es estirada por la acción de una fuerza, puede regresar a su tamaño y forma original en el momento que se elimina el esfuerzo que lo deforma, siempre que nos movamos dentro de ciertos límites de temperatura. A esta propiedad se le llama elasticidad y si después de eliminar la fuerza deformante el material no recupera sus dimensiones originales, se dice que excedió el límite elástico. Mientras no se alcance ese límite podemos decir que la tensión es directamente proporcional al esfuerzo. Para calcular la deformación se usa una constante elástica, determinada experimentalmente, llamada módulo de Young, que mide la relación del esfuerzo de alargamiento con la tensión que se produce. Matemáticamente se expresa como:
| Y = (F/A) / (e/L) |
| F = (AY/L)e |
| k = (AY/L) |
donde Y es el módulo de Young, F es la fuerza aplicada para producir el alargamiento, A es el área, L es la longitud del vidrio, e es el alargamiento y k es la constante elástica.
La fuerza elástica en un vidrio se debe a las atracciones moleculares dentro del material cuando éste se solidifica. Si las capas de vidrio se separan ligeramente por la aplicación de una fuerza deformadora, las fuerzas moleculares se ponen en actividad para atraerlas a sus posiciones originales. Pero en el límite elástico las fuerzas moleculares dejan de ser tan efectivas a causa de las imperfecciones y de la falta de cristalinidad del material.
En la figura 33 se presenta la variación del módulo de Young en un vidrio formado por 18% de Na2O y 82% de SiO2, al cual se le agregan pequeñísimas cantidades de diferentes óxidos metálicos para cambiar su composición. Con la incorporación de óxidos de sodio y potasio el módulo de Young disminuye, mientras que con óxidos de magnesio, hierro y calcio, aumenta. Sin embargo, al adicionar óxidos de bario, aluminio, cinc y plomo casi permanece constante. Un efecto diferente ocurre cuando el óxido es un borato (B2O3), porque en este caso el módulo de Young primero aumenta hasta llegar a un máximo, y después disminuye por el exceso de boro. Desde el punto de vista práctico, la composición ideal para que un vidrio tenga mayor elasticidad es con silicio, sodio, calcio y boro.
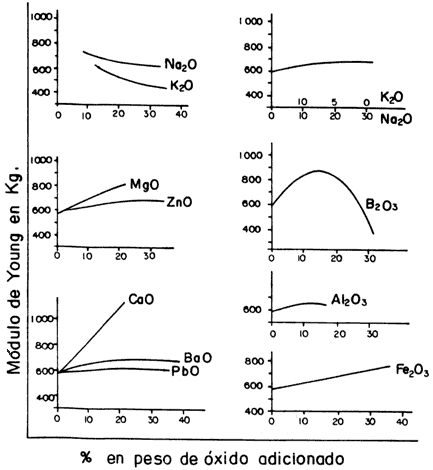
Figura 33. Variación del módulo de Young por adición de óxidos en el vidrio que contiene 18% de Na2O y 82% de SiO2.
Como se observa en la figura 34, la temperatura es un factor muy importante debido a los altos valores de compresibilidad y la rapidez con la que cambia, que concuerdan con la concepción de la naturaleza líquida del estado vítreo. La compresibilidad es la acción de reducir el volumen de un material. En los sólidos y líquidos el volumen se comprime muy poco por efecto de la presión. En el vidrio sucede lo mismo, pero esta propiedad es importante porque de ella dependen las aplicaciones que se le puedan dar. En la figura 34 se aprecia que la compresibilidad del vidrio de Na y K aumenta linealmente con la temperatura, el que contiene borosilicato de cinc siempre decrece, mientras que el de sílice y el pyrex decaen para volver a crecer aproximadamente después de los 250ºC.
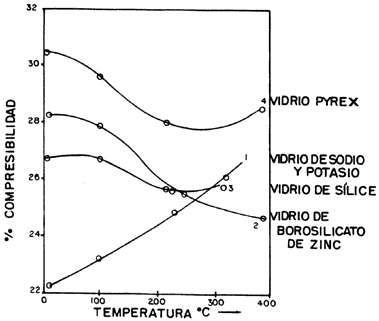
Figura 34. Porcentaje de compresibilidad por efecto de la temperatura en varios vidrios.
La resistencia que ofrece el vidrio al ponerlo en contacto con el agua o con agentes atmosféricos, así como con soluciones acuosas de ácidos, bases y sales, es una propiedad de gran importancia llamada durabilidad química, que lo hace tomar ventaja sobre otro tipo de materiales, como los plásticos, por ejemplo. Los vidrios comunes parecen ser químicamente inertes, pero en realidad reaccionan con muchas sustancias, lo que sucede es que lo hacen lentamente y por eso se pueden utilizar. Cuando se habla de altas resistencia a reactivos químicos se quiere decir que para que las reacciones ocurran tiene que pasar un tiempo muy largo, por lo que prácticamente no reaccionan. El vidrio tiene una resistencia excelente a los ácidos, excepto al fluorhídrico, y a las soluciones alcalinas frías. Por eso es muy útil como envase de reactivos químicos. También es particularmente adecuado para tuberías transparentes. Por supuesto que tiene el gran inconveniente de su fragilidad y de la poca resistencia a los cambios bruscos de temperatura, pero en ese caso se puede usar vidrio blindado con fibra de vidrio de poliéster para evitar roturas, teniendo así la ventaja de la resistencia a la corrosión del vidrio y la fuerza estructural del acero.
Los recubrimientos de vidrio son resistentes a todas las concentraciones de ácido clorhídrico a temperaturas menores de 200º C; a todas las concentraciones de ácido nítrico hasta el punto de ebullición; al ácido sulfúrico diluido hasta el punto de ebullición y concentrado hasta 300º C. Existe también un vidrio que aguanta a los ácidos con resistencia mejorada a las bases. En la figura 35 se presenta una gráfica de la resistencia que tiene un vidrio comercial a la acción de diferentes ácidos y álcalis. El material fue expuesto a los reactivos durante seis horas. De estas gráficas se deduce que el vidrio pyrex es el más inerte y el único que no es afectado por las bases. Los otros vidrios tienen como fórmula química general wNa2O-xCaO-SiO2. Nuevamente, lo que cambia son los valores de w y x, dando distintas composiciones. Mientras más grande sea el valor de w, más Na2O tendrá y será más resistente.
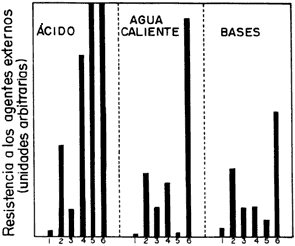
Figura 35. Comparación de la acción de diferentes soluciones ácidas, H2O y básicas en seis vidrios. Los números del 1 al 5 son sódico-cálcicos y el 6 es pyrex.
En la misma figura se puede observar que todos, menos el pyrex, reaccionan con el agua caliente. En contacto con medio acuoso lo que ocurre es un intercambio de iones sodio [Na+] por iones hidronio [H3O+]. Los iones hidronio están presentes en el agua en equilibrio con los iones [OH—]. Este intercambio va disolviendo el material. Por el contrario, cuando el vidrio se mezcla con una base, el intercambio iónico sucede entre los aniones (los que tienen carga negativa) de la estructura [A1(OH)— 4] y los grupos hidroxilo [OH—] de la base. Como resultado tendremos una mayor cantidad de [OH—] dentro de la estructura del vidrio.
Tener un material químicamente inerte ha sido una preocupación por muchos años. Desde que en 1868 Stas obtuvo por primera vez un vidrio resistente a los ácidos, a las bases y a diferentes agentes corrosivos químicos, se han sucedido muchos adelantos hasta llegar al vidrio pyrex, conocido por su alta durabilidad química a altas temperaturas, con una composición de 81% de SIO2, 13% de B2O3, 3.6% de Na2O, 0.2% de K2O y 2.2% de A12O3, que hasta la fecha no ha cambiado ni ha podido ser sustituido por otro.
Con respecto a las propiedades eléctricas, la conductividad de un vidrio depende de su composición, de su temperatura y de las condiciones atmosféricas que rodean al material. A bajas temperaturas los vidrios multicomponentes son aislantes. A todas las temperaturas son conductores electrolíticos, y de 25 a 1,200ºC la resistividad, o resistencia a conducir la electricidad, es variable. La resistividad del vidrio disminuye rápidamente a medida que aumenta la temperatura, y por consiguiente se dice que es un semiconductor. La conducción en este caso no se debe a que los electrones se muevan, sino a iones que emigran a través de la red vítrea.
En la figura 36 se observa que al aumentar la temperatura aumenta la conductividad eléctrica, y a pesar de que es semejante el comportamiento de los vidrios que aparecen en la figura, se puede ver que los que contienen bario (4) y plomo (5) necesitan una temperatura mayor, de 244 y 248ºC respectivamente, para comportarse como conductores.
Si nos referimos a la capacidad calorífica del vidrio, sabemos que es mucho más pequeña que la de los metales, pero que puede usarse con éxito en ciertas aplicaciones de transmisión de calor, como en los moldes para cocinar en hornos caseros. La conductividad de diversos vidrios a temperatura ambiente varía mucho, y los valores más altos se encuentran en aquellos que tienen un mayor contenido de sílice.
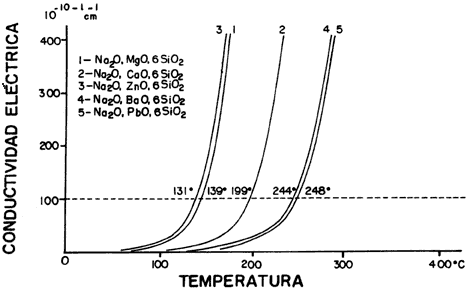
Figura 36. Cambio de la conductividad eléctrica con la temperatura en varios vidrios.
De esta forma quedan descritas las propiedades más importantes del protagonista
de nuestro libro. Conociéndolas es posible que tengas una idea más clara de
por qué los reactivos químicos se guardan en frascos de vidrio, y de por qué
los focos también están hechos con este material.
![[Inicio]](../img/begin.gif)
![[Anterior]](../img/prevsec.gif)
![[Previo]](../img/parntsec.gif)
![[Siguiente]](../img/nextsec.gif)