II. LA ENERGÍA
EN PRIMER término hay que darse cuenta de que los sistemas industriales están ligados a la energía. En la figura 19 se observa lo que sucede al crecer la población y los productos en un sistema natural como la Tierra. El crecimiento poblacional crea más demandas y, para mantener los recursos renovables, no pueden extraerse a una velocidad mayor que la de su propia generación. Por otra parte, los recursos no renovables, como el petróleo, no deberán exceder la velocidad a la cual se renuevan por fuentes que los sustituyan. Claro que esto último no puede realizarse como se desearía, de ahí que el reciclaje de los desechos, sumado al ahorro de energía y materiales, es la única manera de reducir la magnitud del problema.
El concepto de energía es uno de los más empleados en la ciencia, se asocia con cualquier tipo de actividad y a través de él se explica la inmensa mayoría de los fenómenos naturales y artificiales. Durante los siglos XVIII y XIX se hicieron descubrimientos muy importantes en todas las ramas del saber, lo que hizo surgir la necesidad de explicarlos. Una manera es definir el significado de energía. El descubrimiento de la electricidad, la invención de la pila eléctrica o el hecho de que la corriente eléctrica sea capaz de descomponer las sustancias o poner un imán en movimiento, hizo que se pensase que todos estos fenómenos pudieran deberse a una misma causa. Es así como aparece el término de energía como algo que puede producir los cambios. A través de los años, el hombre ha perfeccionado la capacidad de hacer trabajos que requieren grandes esfuerzos físicos, para dejar a las máquinas las tareas pesadas y dedicarse a labores intelectualmente más productivas. Esto ha traído como consecuencia que el consumo de energía por habitante sea cada vez mayor.
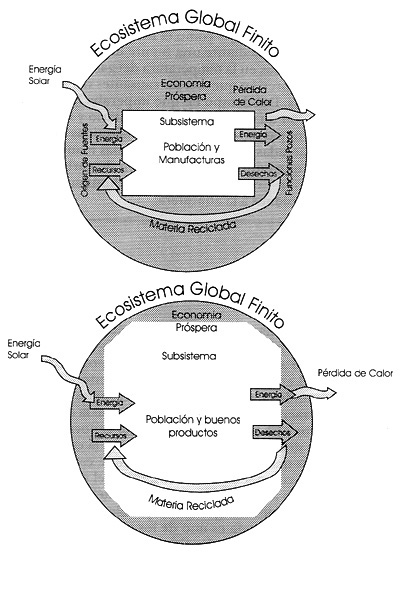
Figura 19. El ecosistema finito global comparado con el crecimiento de los subsistemas económicos y de población.
Existen muchos procesos en los que una fuerza mueve un objeto, decimos entonces que se ha producido un trabajo. La capacidad para realizar un trabajo se llama energía. La cantidad de energía que se transfiere depende de la intensidad de la fuerza y del desplazamiento de dicha fuerza, la magnitud que mide esta transferencia de energía es lo que conocemos por trabajo. Cuando se habla de las máquinas se menciona la potencia. ¿Qué significa este término? Pues que el tiempo es fundamental en el trabajo que realiza una máquina, por eso se introdujo el concepto de potencia que se define como la rapidez con que se realiza un trabajo o como la energía por unidad de tiempo, medida en vatios. El término de caballo de fuerza es una invención de J. Watt en 1782. Supuso que un caballo era capaz de jalar un peso de 180 libras y que sujeto a un malacate, daba 150 vueltas por hora recorriendo en 2.5 minutos un círculo de 24 pies de diámetro, lo cual rinde un trabajo que, haciendo las transformaciones de unidades pertinentes, resulta en 745 vatios. ¿Cuántos caballos de fuerza tiene su automóvil? Compare ese valor con un pistón de 1712 que poseía un cilindro de 0.5 m de diámetro y 2 m de largo capaz de producir 12 golpes por minuto, si le aplicamos los cálculos que conocemos actualmente, el "poderoso" aparato daba alrededor de 5.5 caballos de fuerza.
Cuando aludimos a las fuentes de energía, nos referimos a su origen. Una fuente de energía como la que se obtiene del petróleo puede producir energía calorífica, mecánica, química o eléctrica. Cuando hablamos de fuentes implícitamente decimos que se trata de energía aprovechable, es decir, energía que el ser humano puede utilizar para sus actividades. Existen los siguientes tipos de fuentes de energía según su origen y aprovechamiento:
1) Energía del petróleo, gas y carbón. La energía química se convierte en calor para posteriormente transformarse en electricidad u otras formas de energía. Cuando la energía que proporcionan el petróleo, gas o el carbón se obtiene en grandes cantidades, se transforma en energía eléctrica a través de las centrales termoeléctricas o carboeléctricas. En el caso de los transportes, la energía se transforma en cinética o mecánica o bien en energía calorífica cuando se trata de un calentador o una estufa.
2) Energía hidráulica. Para producirla se aprovechan las caídas del
agua, por lo tanto se trata de energía potencial. Los griegos fueron los primeros
en usarla, por medio de la rueda hidráulica para bombear agua que inventó Filón
de Bizancio en el siglo III a.C. La energía hidráulica es energía
mecánica, primero potencial y después cinética.
3) Energía nuclear. Es la que une el núcleo de los átomos. Se transforma primero en energía calorífica y ésta, a su vez, en mecánica y eléctrica. Los protones y los neutrones constituyen el llamado núcleo de los átomos y los electrones gravitan a su alrededor. Al bombardear un átomo pesado con neutrones, su núcleo se rompe o se fisiona liberando en el proceso una enorme cantidad de energía. Al fisionarse puede emitir también neutrones y si éstos son dos o tres, chocarán con otros átomos produciéndose una reacción en cadena que produce la energía nuclear.
4) Energía geotérmica. Desde tiempos remotos, el ser humano ha usado las aguas termales con diversos fines. En México, el temascal se utilizó desde la época precolombina. Existen pozos geotérmicos, es decir, formaciones rocosas que han atrapado agua y ésta se calienta por la temperatura de la Tierra pudiendo estar en forma de vapor, de mezcla vapor-líquido o líquido caliente.
5) Energía solar. La constituye la radiación solar y se emplea para producir calor o electricidad. Una forma de aprovechar la energía del Sol es mediante los llamados colectores, que convierten la energía solar en calor. En nuestro país existen regiones en Sonora y Baja California con altísimos promedios de radiación por año donde es posible construir centrales de energía solar para satisfacer la demanda local.
6) Energía eólica. Es la que utiliza la energía cinética de los vientos, puede aprovecharse como tal o convertirse en electricidad. Uno de sus primeros usos fue hace unos 3 500 años cuando los sumerios armaron las primeras embarcaciones de vela. Una aplicación familiar son los molinos de viento, cuya historia se remonta a la antigua Persia y que han sido usados para bombear agua y moler granos.
7) Energía de la biomasa. Resulta de la materia viva y los desechos orgánicos cuando se les usa como combustible, por lo tanto se trata de energía química que se puede transformar en cualquier forma de energía. En el uso de la biomasa como fuente energética se emplean principalmente árboles, plantas, desechos animales y vegetales. El ejemplo más conocido de utilización de la biomasa es la madera.
Pudiera uno pensar que en un principio las carreteras pavimentadas se construyeron atendiendo al uso del automóvil, pero fueron construidas para atender los vehículos tirados por caballos, En un trabajo de 1974 escrito por E. Montroll y W. Badger se llegó a la conclusión que de haberse seguido construyendo carreteras con este fin se hubiera producido un desastre ecológico, aunque desde el punto de vista tecnológico el carro era una innovación tecnológica maravillosa. Veamos los cálculos de estos autores. El que se refiere a desperdicio sólido se basa en el cálculo de una producción promedio de 16 kg por día con un recorrido de 40 km diarios, mientras que el cálculo para los contaminantes líquidos se basa en suponer unos 7.5 kg por día para una travesía de 40 km diarios. Se consideran los estándares que prevalecían en 1980.
| medio de transporte | contaminante | emisiones en gramos por kg |
| caballos | sólidos | 400 |
| líquidos | 188 | |
| automóviles | hidrocarburos | 0.16 |
| monóxido de carbono | 2.9 | |
| óxidos de nitrógeno | 0.25 |
En 1950 circulaban en el mundo 53 millones de automóviles; para 1988 la cantidad total de vehículos excedió los 500 millones y en 1990 se calculaba que circulaban 675 millones de vehículos, de los cuales los automóviles representan 65%, los camiones ligeros 15%, las motocicletas 15% y el resto camiones pesados. Desde 1950 el promedio anual de crecimiento ha sido de 9.5 millones, es decir 5.9% anual. Para acabar con las estadísticas diremos que la población de vehículos ha crecido más rápidamente que la humana. Para el año 2000 se espera que en los países desarrollados dicho crecimiento no se incremente notablemente, pero este patrón no será el mismo para el resto del mundo donde se espera mayor crecimiento de la población y mayor urbanización. Esto lleva a predecir que la flota de vehículos alcanzará 900 millones de unidades en 2010. Más grave es la cifra que nos expresa el número de kilómetros recorridos por vehículos de motor anuales: 8 000 000 000 000. ¿A qué se debe esto?
La respuesta se relaciona con el incremento de la urbanización. Las ciudades crecen más horizontal que verticalmente, lo que provoca que las tierras rurales pasen a ser urbanas. La distancia de los lugares residenciales al centro del comercio de las ciudades crece, e induce a que el número de kilómetros recorridos también crezca.
PREDICCIONES SOBRE EL CONSUMO DE CARBURANTE
El crudo y sus derivados se han convertido desde el inicio de su explotación en la fuente energética primaria de mayor importancia. En 1991 de los 57 232 millones de barriles de petróleo equivalente, es decir energía expresada como barriles de petróleo, 41% provino del crudo, 22% del gas y el resto de otras formas de energía como la nuclear, la hidráulica y la geotérmica.
En México para el mismo año, las proporciones son todavía más dependientes del crudo: de 883 millones de barriles, 61 % proviene del crudo, 29% del gas y 10% de otros (figura 20).
En el pasado, la gasolina era considerada un producto secundario de los procesos de refinación, y su obtención carecía de importancia. Ahora es el producto principal que mueve al transporte en el mundo. Para México, la figura 21 nos muestra el consumo nacional de energía destinado al transporte.
En 1994 se consumieron 502 000 barriles diarios que seguramente llegarán a 586 000 en 2005, como se muestra en la figura 22. En el mundo, en 1994, se consumieron 800 millones de toneladas.
¿Por qué hacemos tanto hincapié en el consumo de gasolina? La explicación tiene que ver con el desperdicio que se genera en un coche por la poca eficiencia de la combustión, que es uno de los grandes motivos de investigación en el mundo, ya que se trata de elevarla al máximo.
La energía obtenida del carbón, petróleo, gas, biomasa, energía hidráulica y calor generado en un reactor nuclear es la energía primaria, que no se utiliza en forma directa sino trasformada en energía secundaria. La ventaja de ésta es que tiene una amplia gama de utilización y comodidad de uso: electricidad, gasolina, gas avión, etc. La energía secundaria se suministra como energía final y otra parte es rechazada y devuelta a la naturaleza como "calor residual". Las consideraciones acerca de la eficiencia energética se centran en la que se deriva de la explotación, transporte y tratamiento de la energía primaria para su conversión, almacenaje de la secundaria, sistemas de distribución, redes de transporte y, finalmente, en la transformación útil para el consumo final, y en los medios de conversión como focos, cocinas o motores de vehículos.
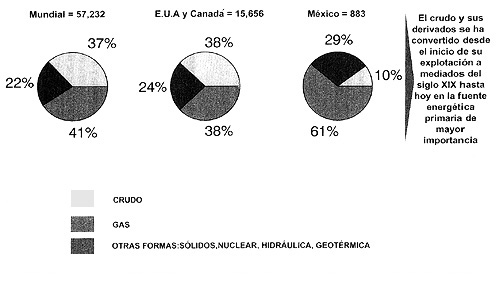
Figura 20. Comparación del consumo de energía primaria en México vs otros lugares del mundo. Millones de barriles de petróleo equivalentes.
SECTOR TRANSPORTE 367 PETACALORIAS
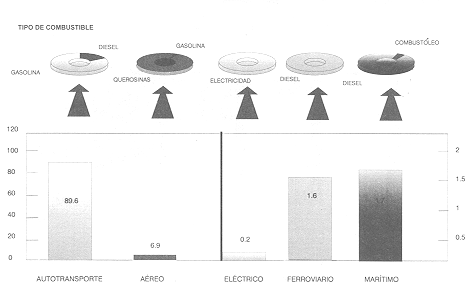
Figura 21. Consumo en México de energía en el sector transporte, 1994.
GASOLINAS
MILES DE BARRILES DIARIOS
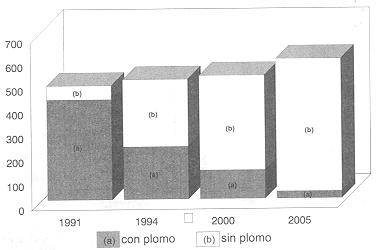
Figura 22. Evolución de la demanda de gasolina en México, a) con plomo, b) sin plomo.
EL RENDIMIENTO DE ALGUNAS MÁQUINAS
Antes de seguir con los motores, veamos una máquina popular, la bicicleta, muy popular en todo el mundo. Los científicos la estudian intrigados por lo simple de su tecnología, su gran eficiencia y su equilibrio. Su pariente más lejano es la rueda, inventada hace unos 5 000 años. Fue Harry Lawson, en 1879, quien la diseñó tal como la conocemos: transmisión por cadena, piñones y cuadro. ¿Hay algo interesante que decir acerca de la bicicleta a más de un siglo de creada? Parece que no, pero hay un punto de sumo interés: resulta que la bici es uno de los medios de transporte con más alto rendimiento energético. La energía que gasta un individuo, animal o vehículo para desplazarse depende de la velocidad con que lo hace, pero uno puede comparar los diferentes movimientos con la velocidad habitual promedio. Cuando uno realiza esos cálculos resulta que comparados entre sí, por kilómetro y gramo transportado, los menos eficientes son la serpiente, la rata, la mosca, seguidas del conejo, helicóptero, avión, el hombre, el caballo, el automóvil y el salmón. Un ciclista gasta cinco veces menos energía (0. 15 calorías por gramo y kilómetro recorrido) que un marchista (0.75 calorías/km y gramo). ¿Por qué? Para contestar esto debemos pensar en la potencia que la máquina humana puede dar y cómo se usa.
La combustión en un auto es muy diferente de las combustiones simples y continuas que se suceden en otro tipo de aparatos como las turbinas de gas. Es intermitente y se da bajo condiciones complejas y variables. La eficiencia de la combustión es muy sensible a la calidad del carburante y éste depende a su vez en forma estrecha de las condiciones de operación.
Para destacar la importancia del adelanto técnico, diremos que en el siglo X el enganchar la collera en los homóplatos de los animales de tiro los salvó de la semiasfixia que les producía llevarla al cuello. En los vehículos automotores, la energía química contenida en los combustibles se transforma en movimiento y como subproducto se genera calor y gases de combustión. Es importante hacer notar que el contenido energético teórico de la gasolina al ser quemada en presencia del aire, está relacionado directamente con el contenido de carbono e hidrógeno. La energía es liberada cuando el hidrógeno y el carbono son oxidados (quemados) para formar agua y bióxido de carbono. El octano de la gasolina no está relacionado con el contenido energético y son sólo los hidrocarburos presentes en la mezcla los que determinan la liberación de energía y que no se produzcan detonaciones indeseables. Las dos reacciones importantes son:
La masa o volumen de aire requerido para proveer suficiente oxígeno con el cual se alcance la combustión completa es un valor preciso. Pueden darse dos condiciones, la primera que la cantidad de aire sea insuficiente, los científicos hablan entonces de que la mezcla es "rica"; la segunda, que se da cuando la masa es excesiva, se dice entonces que la mezcla es "deficiente". Como regla, un auto funciona con el máximo de potencia cuando la mezcla es ligeramente "rica" pero la economía de combustible se alcanza en mezcla "deficiente". El contenido energético o poder calorífico de la gasolina se mide quemando todo el combustible dentro de una bomba calorimétrica y midiendo el incremento de temperatura. Al instrumento se añade una cantidad pesada de la muestra, la cual se quema en una atmósfera de oxígeno puro empleando una resistencia eléctrica para calentar. El recipiente está cerrado e inmerso en un baño de agua. Se mide la elevación de la temperatura que se genera, de la cual se calcula el calor de combustión. La energía disponible depende de lo que suceda al agua producida durante la oxidación del hidrógeno. Si permanece en estado gaseoso, no puede liberar el calor de vaporización, por lo tanto produce el valor calorífico neto.
Por ejemplo, para quemar heptano se da la siguiente reacción:
1 volumen de heptano requiere de 11 de oxígeno o bien de 52.5 volúmenes de aire y en el proceso se generan 11489.9 Kcal/kg. Si consideramos los datos sobre la base de masa, lo anterior equivale a una relación aire-carburante de 1.5:1. Una parte de la gasolina, dado que difiere del heptano en su relación carbonohidrógeno, requiere aproximadamente 14.5 partes en peso de aire para realizar la combustión completa, aunque la estequiometría exacta dependerá de la composición del carburante. Hablando en términos generales podemos decir que para una gasolina constituida puramente por hidrocarburos, si la relación aire-carburante es menor, de 7:1, la mezcla será demasiado rica para hacer combustión, y si es más de 20:1 no podrá hacerlo. Volviendo al calor de combustión, en el caso de los automóviles el poder calorífico neto es el que debe emplearse dado que el agua es emitida en forma de vapor. La máquina no puede utilizar la energía adicional disponible cuando el vapor se condensa nuevamente en agua líquida. El poder calorífico es entonces la máxima energía que puede obtenerse del combustible cuando se le quema, pero tomen aliento y asimilen el siguiente dato: en un automóvil moderno que emplea bujías para la ignición de la gasolina, la eficiencia mecánica fluctúa entre 20 y 40%, el resto se pierde en forma de calor.
Los motores Diesel tienen mayor eficiencia en un amplio rango de condiciones de operación. En el valle de México, la quema de combustibles en motores de combustión interna es todavía menos eficiente debido a la baja presión atmosférica y la deficiencia en la concentración de oxígeno en el aire. Recuérdese que el aire está compuesto por 78% de nitrógeno, 21 % de oxígeno y 1 % de otros gases. En sitios elevados el aire contiene menos oxígeno por unidad de volumen que a nivel del mar por su menor densidad al ser más baja la presión atmosférica.
Cuando la gasolina se mezcla con el oxígeno se producen reacciones aún antes de que la mezcla llegue a la cámara de combustión y persisten cuando se ha llevado a cabo y el frente de la llama avanza. Lógicamente esto determinará que el carburante se queme "normalmente" o dé pie a combustiones "anormales" como el cascabeleo o la preignición. La combustión normal ocurre cuando el frente de la llama se mueve suavemente pero en cierta manera lo hace de forma irregular al cruzar la cámara de combustión una vez encendida por la chispa.
El movimiento irregular se debe a la turbulencia y a la falta de mezcla perfecta. Aun cuando la combustión se lleve a cabo normalmente, todas las máquinas tienden a mostrar variaciones en la presión máxima que puede alcanzar el cilindro y la velocidad de aumento de dicha presión de un ciclo a otro, dispersión que ocurre a pesar de los controles estrictos que se tienen durante las condiciones de movimiento. Se cree que lo anterior se debe a variaciones en la turbulencia durante los ciclos que influyen sobre la velocidad de la llama en la cámara de combustión. Si estas dispersiones se minimizan será posible aumentar la eficiencia del uso del combustible.
El cascabeleo o golpeteo es una de las formas más importantes de la combustión anormal y determina en cierto grado la eficiencia térmica que se puede obtener de un motor. Entre mayor es la relación de compresión, mejor la eficiencia térmica, pero aumenta también la tendencia al cascabeleo, razón por la cual se requiere de un carburante de un octano apropiado. Al retardarse el tiempo de ignición, la tendencia del cascabeleo es a disminuir ( y viceversa) pero más allá de cierto límite la potencia del automóvil se afecta notablemente. El cascabeleo continúa siendo uno de los aspectos más importantes que se toman en cuenta para el diseño de los autos y poder escoger la gasolina apropiada, pero muchos fenómenos son aún entendidos parcialmente.
LAS CARACTERÍSTICAS GENERALES DE UNA GASOLINA
Veamos algunas de las características que se exige a una gasolina a fin de satisfacer las necesidades de millones de automóviles de cientos de marcas, modelos y años.
El índice de anticascabeleo. Antes de 1929, los carburantes se clasificaban en una máquina monocilíndrica, en la que el cociente de compresión podía variarse entre 2.7:1 hasta 8:1. Cada carburante se experimentaba empleando diferentes relaciones aire/combustible y tiempos de ignición variados, buscándose determinar el máximo de potencia y la relación de compresión más elevada. El valor obtenido se llamaba algo así como "cociente de compresión útil" que se refería al valor obtenido con el tolueno.
La gasolina se clasifica en primera instancia de acuerdo con el índice de anticascabeleo, que es una medida del octano. El cascabeleo (golpeteo) se origina por la dirección opuesta de dos frentes de llama: el debido a la explosión anticipada del combustible por encontrarse a elevada temperatura y el que produce la bujía. Como resultado de la dirección opuesta de ambos frentes se producen las vibraciones.
La medida de habilidad de un combustible para resistir la autoignición bajo un incremento de presión es el octano. La eficiencia de un automóvil encendido por una chispa se relaciona con la relación de compresión. Cualquier "detonación" causada por el carburante destruirá rápidamente los elementos mecánicos del motor. Desde 1912 los automóviles cuya ignición del combustible se inicia mediante la chispa de una bujía siempre se han visto limitados por los "cascabeleos" indeseables, es este sonido una descripción justa cuando el automóvil emplea gasolina de bajo octano. Thomas Midgley descubrió que las detonaciones se debían al aumento brusco de la presión una vez que se llevaba a cabo la ignición. En 1926 Graham Edgar sugirió que dos hidrocarburos que podían producirse en cantidad suficiente y de alta pureza fueran utilizados para desarrollar una escala, que en aquel tiempo iba de 0 a 100. Los primeros resultados se publicaron en 1929 y la industria sigue usando este método y los mismos patrones para las comparaciones. Dos parafinas de propiedades físicas similares fueron escogidas, una es el heptano normal, es decir el hidrocarburo lineal de siete átomos de carbono con sus correspondientes hidrógenos que, además, provoca muchas detonaciones. El cien de la escala es el llamado isooctano que químicamente hablando tiene el solemne nombre de 2,4,4, trimetil-pentano, es decir, un hidrocarburo de ocho carbones ramificado y cuya fórmula ilustramos a continuación y que resultaba ser una sustancia de muy baja resistencia al cascabeleo:
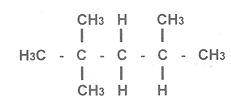
El número de octano de un carburante RON o MON, iniciales de Research Octane Number (número de octano de investigación), y Motor Octane Number (número de octano de motor), es el porcentaje en volumen de isooctano que está mezclado con el heptano lineal y que muestra las mismas propiedades antidetonantes que un carburante de prueba medidas en la máquina bajo las condiciones controladas.
En los años treinta se observó que no era posible correlacionar los resultados que se obtenían en el laboratorio con los del automóvil en la carretera o los que resultaban del manejo en la ciudad en donde las condiciones varían mucho. En general el RON, grosso modo, correlaciona la habilidad antidetonante del motor conducido a baja velocidad en un coche de poco peso debido a la carga que transporta. Si el RON es muy bajo, se darán cascabeleos y detonaciones al apagar el motor. Mientras que el MON relaciona la capacidad antidetonante del auto cuando está sujeto a las altas velocidades y en condiciones severas de manejo, como al subir por caminos empinados o adelantar a un coche en donde se requiere rápidamente de potencia. Entre los años treinta y sesenta predominó el método RON por ser el más cercano al octano necesario para el tipo de vehículos y carreteras disponibles. Una de las propiedades de una gasolina actual se especifica por el "índice de anticascabeleo" que se extrae de la siguiente fórmula:
Índice anticascabeleo=1/2 (RON+MON)
El RON es de ocho a diez números mayor que el MON,
así la gasolina de 87 octanos tiene un MON de 82 y un RON
de 92. Cada automóvil está construido para trabajar a un cierto número de octano,
número que se ve afectado por factores de diseño y condiciones propias del uso,
veamos:
| Algunos factores de diseño/operación | Factores externos |
| Relación decompresión | Presión barométrica/ altitud |
| Tiempo de ignición | Temperatura |
| Relación aire/ carburante | Humedad |
| Temperatura de combustión | Depósitos en la cámara de combustión |
| Diseño de la cámara de combustión | |
| Recirculación de gases de escape |
2) Sensibilidad. El valor resultante de restar el RON del
MON se llama sensibilidad. Para dos carburantes del mismo
RON, una gasolina con mayor sensibilidad tendrá un MON
menor. Lo que representa este valor es la capacidad que tiene la gasolina para
soportar cambios en la severidad de las condiciones de operación de la máquina
en términos de su capacidad antidetonante. Esto lo ilustramos para su mejor
comprensión en la figura 23 en donde se muestra el número de octano en función
de la severidad a la que se somete la máquina. Como se observa, describimos
el comportamiento de tres carburantes, el A que tiene un alto RON y
baja sensibilidad, el B con un RON de 96 pero alta sensibilidad
y el C con bajo RON de 84 pero muy baja sensibilidad. Se puede
observar que si la máquina funciona a la severidad marcada con X, el carburante
B funciona mejor que el A si bien tiene menores RON y MON.
De manera semejante, si el vehículo opera en la severidad marcada B, el carburante
C es mejor que el B si bien tiene, como en el otro caso, menor RON
y MON. Por supuesto que en los niveles de severidad que ocurren
en la mayoría de los vehículos, el carburante A es mejor que el B y éste mejor
que el C.
La estructura química de los hidrocarburos tiene gran influencia en la calidad
del octano. En la figura 24 podemos apreciar más claramente este efecto. La
introducción de una doble ligadura en un hidrocarburo de cadena lineal, para
generar una olefina, tiene un efecto importante ya que incrementa el RON
si bien el MON no lo hace tanto (compárese en dicha figura los
valores del pentano lineal y del 1-penteno). Como sabemos, los procesos de desintegración
catalítica producen muchos compuestos olefínicos, por lo tanto el proceso genera
productos de alta sensibilidad. De manera similar, los compuestos ramificados
tienen mayor calidad de octano respecto a los lineales, datos que se pueden
comparar entre el hexano lineal con el 2 metil pentano y el 2,2 dimetilbutano,
todos tienen el mismo número de carbones y de átomos de hidrógeno, pero tanto
el RON como el MON aumentan conforme se incrementa
el grado de ramificación, siendo la sensibilidad de todos ellos muy baja. Como
se ve en la figura, los compuestos cíclicos saturados, los naftenos como el
ciclohexano, pueden tener mayor nivel de octano que el compuesto lineal, en
este caso el hexano, pero la sensibilidad es intermedia. Los compuestos aromáticos
como el benceno tienen elevados valores de octano pero una relativa alta sensibilidad.
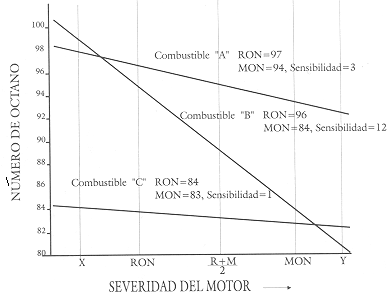
Figura 23. Calidad de octano en función de la severidad de la máquina.
Con estos valores podemos relacionar los procesos de transformación de hidrocarburos
con las sensibilidades obtenidas de ellos, comenzando por la que proviene directamente
del crudo, veamos:
| tipo de corte de gasolina | RON + MON/2 |
| gasolina atmosférica | 70 |
| gasolina catalítica | 86.2 |
| producto de reformación de naftas | 89.9 |
| producto de alquilación | 92.5 |
En la refinería se cuenta con diversas corrientes para hacer las mezclas apropiadas y dar las especificaciones de octanaje. Los números de octano de mezclado son reales, ajustados para ganancias adicionales en el mezclado y se pueden ponderar linealmente. Y he aquí un ejemplo en el que utilizamos los datos anteriores. Imagine que se desea hacer gasolina de 87 octanos y llegan 5 millones de barriles por día de gasolina atmosférica, 17 de catalítica, 3 de alquilado y nos preguntan: ¿cuánto le añadimos de gasolina de reformación? Simple:
gasolina total de 87 octanos = 5(70) + 17(86.2) + X(89.9) + 3(92.5)
Si resolvemos la ecuación veremos que necesitaremos 28.3 millones de barriles por día.
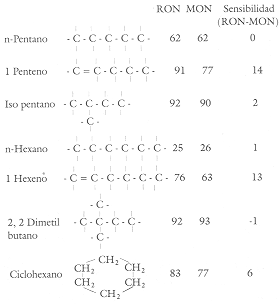
Figura 24. La estructura química influencia la calidad del octano.
Y a fin de cuentas, ¿cómo se miden los octanos?
La determinación del número de octano se realiza en una máquina que posee un solo cilindro y la relación de compresión se puede variar. El pistón se encuentra en la parte superior introduciéndose en el cilindro. Durante la carrera descendente se añade el combustible, permaneciendo abierta la válvula de admisión y cerrada la de escape. La razón de compresión representa al cociente de los volúmenes máximo y mínimo que ocupa el aire en el cilindro. Para evaluar un combustible se ajusta la razón de compresión de manera que el número de golpeteos, señal que es amplificada y medida en una escala de 0 a 100, sea de un valor aproximado de 50. Se preparan mezclas variables de n-heptano/isooctano. La válvula de admisión se cierra y al elevarse el pistón genera la compresión de la mezcla. En el extremo de esta carrera, una chispa inflama la mezcla. El pistón es empujado hacia abajo al expandirse los gases resultantes de la combustión. Ésta es la carrera de trabajo que al terminar abre la válvula de escape. La presión dentro del cilindro disminuye y al levantarse durante su carrera de escape, obliga a salir a los gases que quedan. Con los valores obtenidos se realiza la prueba con la muestra en estudio y su número de octano en función del total de golpeteos se obtiene de una gráfica de interpolación.
Las necesidades de octano de una marca y hasta de un modelo de auto en particular reaccionan en forma diferente a los octanos necesarios para estar exentos de cascabeleos y detonaciones indeseables. Tanto los refinadores como los productores de automóviles deben estar en permanente comunicación y experimentación conjunta para conocer cuáles son las necesidades de octanaje de los vehículos, tanto en condiciones normales de manejo como las malas. Nada se gana si se producen autos que requieren un alto octanaje que no está en el mercado. Un automóvil nuevo debe experimentarse por lo menos con diez muestras diferentes de gasolina de octano variable. Para estimar las necesidades de octano de un auto nuevo las pruebas se realizan entre varios países, empleándose un carburante de referencia al cual se le incrementa el número de RON a partir del valor más bajo disponible en el mercado, por ejemplo de 80 hasta 100 octanos. Muchos autos modernos están equipados con un sensor al golpeteo, generalmente colocado en la cabeza del cilindro y al detectar frecuencias de sonido que están en el rango del golpeteo, activan un mecanismo por el cual se reduce el requerimento de octano del vehículo. Se preguntará el lector, ¿cómo se puede reducir esta necesidad de octanaje? Pues retardando el tiempo de ignición y como el refinamiento de algunos autos es cada día mayor se podrá obtener mayor rendimiento del octanaje que se recibe. Una creencia popular dice que con un mayor octanaje obtengo un coche que funciona mejor: ¡falso! Es necesario añadir que una gasolina de mayor octanaje no mejora nada. Otra, es que con mayor octanaje se obtiene ganancia en la economía de combustible (más kilómetros por litro de gasolina): ¡falso!, la economía la determinan otras variables como la energía que provee el combustible. Hay que notar que dos gasolinas de idéntico octanaje pueden tener contenidos energéticos diferentes debido a que su composición es diferente.
Desde el invento del automóvil, uno de los problemas principales que enfrentaron los fabricantes fue el cascabeleo. Este problema se centró en buscar aditivos que pudieran añadirse a la gasolina o la querosina y previnierán la destrucción mecánica del auto. A principios de siglo las baterías de la investigación se centraron en resolver el problema de los autos, si bien se necesitaba también una gasolina de alto octanaje urgentemente una vez que los estadunidenses entraron en la primera Guerra Mundial. Todo fue evaluado, incluso la mantequilla derretida. Originalmente, el yodo fue el mejor antidetonante disponible, pero desde el punto de vista operativo no era práctica su adición y por lo tanto se dejó en el olvido. En 1919 la anilina mostró mayores propiedades antidetonantes y ya era componente fundamental en la industria textil. La anilina se extrae del alquitrán de hulla pero se fabrica haciendo reaccionar el benceno con ácido nítrico. Thomas Midgley Jr., quien descubrió la causa que producía las detonaciones en los motores, encabezó un grupo de científicos que en 1922 descubrieron el principal componente para aumentar el octanaje de la gasolina y evitar el cascabeleo. Midgley encontró que el platino, la plata y el plomo evitaban las reacciones que generaban el cascabeleo. Entre una serie de compuestos halló el óptimo: el tetraetilo de plomo (TEL), sustancia que tiene una parte orgánica, cuatro grupos etilo y una inorgánica, el plomo. El tetraetilo de plomo al quemarse deja una capa de plomo metálico que es necesario eliminar, pues de acumularse ocluiría el escape. Se desarrollaron compuestos orgánicos que en su molécula contenían grupos cloro, como el dicloro-etileno. Los átomos de cloro reaccionan con el plomo formando un compuesto volátil que escapa con los gases de escape. El TEL cumplía además con otros requisitos: es soluble en la gasolina, se vaporiza con ésta y se descompone a las temperaturas de operación dentro del cilindro produciendo átomos de plomo que se adhieren formando plomo y oxígeno con lo cual hacen más lentas las reacciones que generan el cascabeleo. La cantidad que se añade de estos compuestos está en función del contenido de plomo de la gasolina. El TEL se convirtió rápidamente en el método más efectivo de elevar el octanaje de la gasolina; sin embargo, desde un principio hubo voces de eminentes científicos que hicieron campaña contra su uso aduciendo su toxicidad y la peligrosidad en su manufactura que causó varios accidentes en las fábricas donde se producía. En 1925 el Servicio de Salud Pública de los Estados Unidos inició una campaña de investigación para saber si el uso del aditivo era nocivo. Durante la investigación se suspendió la adición del tetraetilo pero, al no encontrarse aparentemente nada nocivo, se reinició en 1926 bajo duras protestas de la prensa.
El TEL ha sido uno de los primeros componentes cuya concentración se ha reducido y en muchos casos se ha eliminado de la gasolina. El TEL aumentaba notablemente la eficiencia de las máquinas y disminuía el precio de la gasolina. Veamos un par de ejemplos de su influencia sobre el octanaje (expresado en RON), el primero para una corriente proveniente de la reformación de nafta y el segundo la que tiene sobre una gasolina extraída con el crudo.
Cantidad de TEL en productos de la gasolina natural

De los datos se puede llegar a la conclusión, primero de que el mayor beneficio se obtiene con las corrientes de refinería de bajo índice de octano, pero en segundo término se llega a un punto en el cual la adición de TEL ya no lo provoca. Esto es una demostración del concepto de sensibilidad de que hablamos anteriormente.
También se puede apreciar que por ejemplo la adición de 0.7g/1 de TEL da un RON de 102.5, es decir que es mayor al que provee el isooctano puro al que por definición le hemos dado un valor de 100. Una consideración importante que debemos anotar es que los automóviles anteriores a 1971, así como ciertos equipos de agricultura y marinos no tienen los asientos de las válvulas endurecidos. En estos vehículos el contacto metálico entre la válvula y el asiento se previene creando una capa protectora de óxido de plomo como ya se mencionó. Los usuarios de estos vehículos deben buscar aditivos que sustituyan al plomo si no quieren tener problemas con su máquina.
¿Qué hacer con la gasolina sin plomo? Es claro que al irse eliminando
el plomo de la gasolina debido a su toxicidad, el refinador requiere de mayor
energía para obtener el mismo volumen de gasolina con la misma calidad de octanaje.
Si bien mantener un alto índice de octanaje permite a los fabricantes de autos
emplear altas relaciones de compresión y por ende obtener mayor eficiencia,
lo anterior no tiene sentido si en la refinería existen pérdidas. El costo de
mejorar el octanaje tiene que ser absorbido por la refinadora o ser pagado por
el usuario. Muchos estudios se han realizado en los países donde todavía se
añade TEL para mejorar la economía del vehículo al incrementar
la relación de compresión con la cantidad de petróleo crudo que se consume para
producir un volumen dado de gasolina con diferentes calidades de octanaje y
niveles de plomo. La combinación de estos factores arrojan que 0.4 gramos por
litro de TEL son suficientes para una gasolina de RON
96, 0.15g/1 para un RON de 95.5 y por último para una gasolina
sin plomo, el óptimo era de 94.5 de RON.
¿Qué otros aditivos para octano existen? Cuando los científicos llegaron
a la conclusión de que el TEL era dañino para la salud, se investigaron
otros compuestos organometálicos que aumentaran el octano. El más famoso es
el MMT, siglas del metilciclopentadienil tricarbonil manganeso,
desarrollado entre 1953 y 1958; compuesto que tiene una parte orgánica y otra
inorgánica, el manganeso. Ha sido empleado en varios países del mundo e inicialmente
en mezcla con el plomo. Su uso tiene dos funciones: como antidetonante y para
aumentar el octanaje. Sólo se puede emplear en bajas concentraciones (0.016
gramos de manganeso por litro de gasolina) debido a que, supuestamente, el carburante
presenta problemas de estabilidad, se dice que crea depósitos en la máquina
y su respuesta al incremento de concentración llega a un límite. Por otra parte,
el MMT muestra el efecto de aumentar el octanaje en presencia de
plomo en muchos carburantes, particularmente cuando son parafínicos. Otros aditivos
se fabrican a base de hierro y níquel asociados con una molécula orgánica, pero
su uso ha sido limitado. El de hierro se empleó por 1930, y más recientemente
en concentraciones mucho más bajas, del orden de 30 partes por millón, pero
persisten los problemas de daños en los autos aún no resueltos.
Los aditivos orgánicos. Muchas de las características indeseables de los aditivos de octanaje las genera la tendencia a dejar depósitos en la máquina después de la combustión. Por el contrario, los aditivos orgánicos no dejan cenizas y siempre se han considerado de interés para la industria; de hecho los primeros que se emplearon fueron las aminas aromáticas. Una de las más empleadas es la n-metilanilina, cuya fórmula mostramos en la página siguiente. El 1 % en volumen de esta molécula orgánica produce una actividad similar a la de 0.1 gramos de plomo por litro de gasolina, lo que significa que su relación costo/eficiencia es menor que la del plomo. A pesar de que muchos de estos compuestos se han descartado, existen otros que no dejan cenizas y que han probado ser muy valiosos en términos de su capacidad para disminuir el cascabeleo. Son los compuestos oxigenados, los alcoholes y éteres, de los que se hablará más adelante.
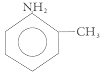
Fórmula de la n-metilanilina
Si quieres octano, ve al ropero de la abuelita. Durante la segunda Guerra Mundial se dijo que las bolas de naftalina aumentaban el octanaje, cuando el naftaleno se usó como ingrediente activo. Éste sí incrementa el octanaje cuando se añaden a la gasolina cantidades importantes de él, pero tiene efectos adversos. El primero es su punto de fusión (80°C ) que hace que cuando el carburante se evapora, el naftaleno se precipita bloqueando los filtros. Un problema adicional es que las bolitas modernas no se elaboran de naftaleno sino de una variedad del benceno que contiene cloro, cuya combustión puede generar productos muy nocivos.
Otras historias del octanaje. Durante la segunda Guerra Mundial, aumentar la potencia de los aviones era materia de permanente estudio. Se había medido que un avión DC-3 al usar una gasolina de octano 100 en lugar de una de 87, incrementaba 12% su velocidad de crucero, 40% la de elevación, podía volar 20% más alto y con 40% más de carga. Hemos dicho que entre más ramificada es la cadena de hidrocarburo, mayor es el octanaje. En 1926 los laboratorios de la General Motors demostraron que el triptano, tenía un alto índice de octanaje. En 1943 se construyó una planta química para su producción y el hidrocarburo se evaluó encontrándose que cuando se le añadía tetraetilo de plomo, la sensibilidad era muy elevada y la potencia de las máquinas se multiplicaba por cuatro mientras que había 25% de mejora en la economía de combustible al compararse al isooctano. ¿Por qué se dejó de producir? Dos razones, su síntesis era muy cara y pronto aparecieron los aviones a turbina que hubieran requerido cambios considerables de diseño para que funcionaran.
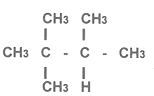
TRIPTANO
Fórmula del triptano
¿ Y los aviones? Durante la segunda Guerra se creó una enorme demanda de gasolina para los aviones de combate que necesitaban 100 índices de octano para alcanzar la potencia necesaria. Esto se resolvió empleando gasolina proveniente del proceso de alquilación y añadiendo altas concentraciones de TEL. Para esta gasolina se emplean los mismos métodos analíticos utilizados en los automóviles salvo que el número de RON obtenido no corresponde exactamente al de los autos. Los números van de 80 a 115 empleando tablas de equivalencias. Entre 80 y 100 los valores de número de aviación son generalmente uno o dos números de octano diferente al de los autos, pero de 100 en adelante si hay cambios importantes en la numeración que refleja ahora lo que se llama número de actuación que se determina en una versión especial de máquina en la que se mantiene constante la relación de compresión.
• Volatilidad de la gasolina. La capacidad de vaporización de la gasolina se llama volatilidad. Este parámetro es muy importante ya que pueden darse dos tipos de fenómenos dependiendo si la volatilidad es baja o muy alta. Si la gasolina no es lo suficientemente volátil (algo común en los años sesenta), el encendido del motor se dificulta, la temperatura de operación del motor es baja lo que trae como consecuencia que la distribución del carburante en el cilindro no sea homogénea y se incrementen los depósitos nocivos por todos lados. Si por el contrario es muy volátil (típico de los años ochenta) se vaporiza muy rápidamente y ebulle en las bombas que la transportan al carburador, y dentro de él las temperaturas son elevadas. Tanto vapor formado trae como consecuencia que se pierda poder, el coche se "ahogue" y de plano se pare, sin mencionar que el bolsillo del usuario se ve afectado por las pérdidas debidas a la evaporación. En los países donde las condiciones atmosféricas difieren mucho en el curso del año, la gasolina se formula de manera que en el invierno la velocidad de vaporización sea rápida y lenta en el verano. Existen tres parámetros para establecer los límites de volatilidad: relación vapor-líquido, presión de vapor y destilación. La relación vapor-líquido es una prueba que determina la temperatura requerida para crear una relación vapor-líquido de 20. Los carburantes más volátiles requieren de menor temperatura para llegar a este cociente, mientras que los carburantes de componentes más pesados requieren, obviamente, mayor temperatura. La prueba de presión de vapor se puede llevar a cabo con varios equipos de laboratorio, uno de los métodos más comunes es el método Reid. El equipo en el que se mide este parámetro, que dependerá de la temperatura a la cual se encuentra la gasolina, comprende un recipiente en el que se coloca la muestra, una cámara de aire de más o menos cuatro veces el volumen del recipiente, un baño a temperatura constante y un medidor de presión o manómetro. Se llena la cámara con la muestra y se conecta a la cámara de aire. El conjunto se agita periódicamente y el manómetro es colocado en la parte superior de la cámara de aire dando la lectura de una presión que se estabiliza cuando el equilibrio se alcanza, figura 25.
El valor que se obtiene es el de la tensión del vapor Reid de la gasolina que se expone en gramos por centímetro cuadrado o libras por pulgada cuadrada. Así una gasolina de 10 PVR tiene una presión de vapor Reid de 10 libras/pulgada cuadrada o sea 703 g/cm². La prueba de presión de vapor es muy importante ya que de manera indirecta indica el contenido de productos muy volátiles que condicionan la seguridad en el transporte, pérdidas en almacenamiento y volatilidad de la gasolina. Veamos un ejemplo que se lleva a cabo en una refinería. Recordemos el proceso de alquilación en el cual reaccionan las olefinas con isoparafinas, con lo cual se hace crecer y ramificar la cadena de hidrocarburos. Generalmente el tipo de producto que se obtiene está en el rango de las gasolinas y contribuye en forma importante a su volumen. En la figura 26 se analizan valores de octano obtenidos mediante el proceso y la presión de vapor Reid generada.
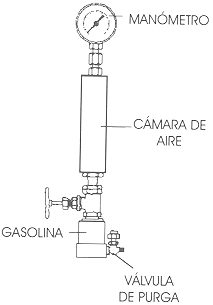
Figura 25. Aparato para medir la presión de vapor.
Aunque muchos refinadores consideran la alquilación como un proceso generador de octano, es en realidad un proceso que reduce la presión de vapor. Contrario al octano, la presión de vapor Reid no es una función lineal. Debe usarse un índice de mezclado para corregir la no linearidad: la presión de vapor de mezclado (PVM) equivale a la presión de vapor elevada a la potencia 1.25, dato que proviene de la experimentación. Hay que tomar en consideración que el control final de la presión de vapor se logra principalmente al reducir la concentración de butanos y pentanos que se deja en la gasolina. Para calcular la cantidad de n-butano que necesita para dar una presión de vapor Reid de 11.5:
EL OCTANAJE Y LA PRESIÓN DEL VAPOR
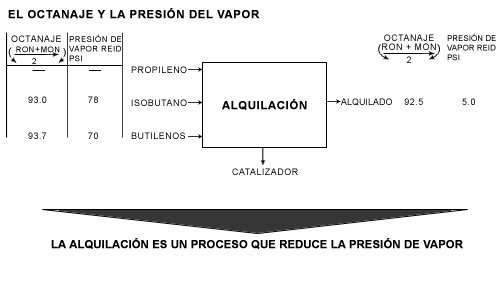
Figura 26. Objetivo del proceso de alquilación.
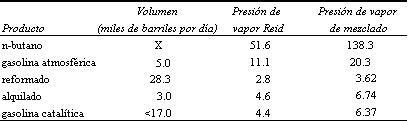
La fórmula mágica nos dice que el volumen de la mezcla multiplicado por el
PVM de la misma es igual al volumen en barriles multiplicado por
el PVM
(48.3 + X) (PVM) = 138.3X + 20.3 (5) + 3.62 (28.3) + 3 (6.74) + 17(3.67) X= 5.9 millones de barriles diarios.
• La curva de destilación. La prueba de destilación se emplea para determinar la volatilidad de la gasolina en todo su rango de ebullición. La gasolina está compuesta de diferentes ingredientes que se evaporan a diferentes temperaturas. Los más volátiles se evaporarán a temperaturas menores. Hay que recordar que la destilación es un proceso muy viejo del cual el hombre sigue sacando provecho. El uso de ciertos objetos es permanente y, conceptualmente, siguen siendo semejantes a los que usaban los alquimistas. Especial importancia tenía para ellos el huevo filosofal, recipiente de vidrio de forma ovalada en el cual se verificaban las transformaciones más interesantes, el horno que suministraba el calor necesario y los alambiques. Su forma debía ser esférica y ovoide para imitar el "cosmos esférico" cuya influencia astral contribuiría al éxito de la Obra. El horno o atanor (del árabe al-tannur) era uno especial de calcinación, con tres niveles: el horno propiamente dicho, una cámara calórica con mirilla, el huevo filosofal iba en un lecho de cenizas calientes que lo cubría, como un nido. El nivel superior remataba en cúpula reverberante que concentraba el calor. María la Judía, alquimista alejandrina, sustituyó la ceniza del atanor por una cazoleta con agua caliente, de ahí procede calentar al "baño María". El proceso alquímico de cohobación (destilar, condensar y volver a destilar, reiteradamente ) obligó a modificar los primitivos alambiques, que se hicieron voluminosos y con formas extrañas.
Conforme la gasolina se calienta, la temperatura a la cual varias fracciones se evaporan se calculan pesándolas. Existen especificaciones que definen los porcentajes de carburante que deben evaporarse. Los límites de destilación incluyen temperaturas máximas a las cuales se debe evaporar el 10% (50-70°C), 50% (110-120°C), 90% (185-190°C) y el punto máximo, que no debe exceder de 225 grados centígrados. El 10% de la gasolina evaporada debe ser suficiente para proveer un arranque rápido del motor; la que se evapora al 50% debe ser lo suficientemente baja para que no produzca problemas de calentamiento del motor en climas fríos pero no lo suficiente como para producir el calentamiento de la máquina. Esta porción de la gasolina afecta la economía en viajes cortos. Las temperaturas de 90% y final de evaporación deben ser bajas para minimizar los golpeteos y la formación de depósitos en la cámara de combustión. Nótese que dos gasolinas con los mismos puntos de evaporación a 10, 50 y 90% pueden variar en la economía de combustible debido a que existan diferencias de evaporación en otros puntos de la curva de destilación. En México, la gasolina con plomo tiene valores de 10, 50 y 90% en grados centígrados 70° 77°-121° y 190° con una temperatura final de ebullición de 225°C.
El aparato para realizar el experimento de destilación está compuesto de un balón de destilación que se calienta y destila a una velocidad determinada. Los vapores formados son condensados por medio de un tubo de cobre cubierto por una mezcla de agua y hielo, y son recolectados en una probeta graduada. El operador anota la temperatura de aparición de la primera gota de condensado a la salida del tubo y ese es el punto inicial de la destilación. Luego la temperatura se va elevando a medida que se destila el 5, 10, 20, 90, 95% del producto. Al final la temperatura llega a un máximo y luego disminuye por la alteración térmica de las últimas trazas del líquido en el balón. El máximo de la temperatura es el punto final de la destilación. En la figura 27 se esquematiza el aparato y el tipo de curva de destilación que se genera, la temperatura está expresada en grados centígrados y el porcentaje recolectado en peso.
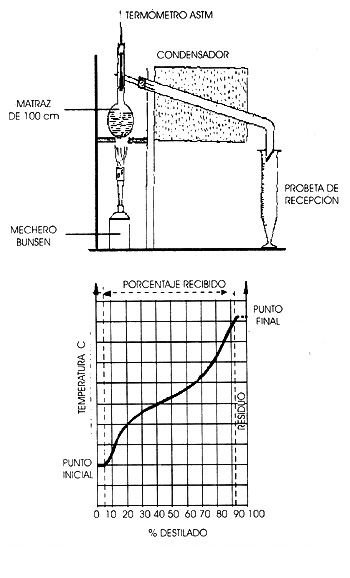
Figura 27. Aparato para realizar la destilación del petróleo y curva generada.
• Contenido máximo de plomo. Este contenido máximo permisible es variable en cada país, el promedio que generalmente se ha empleado para la gasolina con plomo es de 0.03 kg/m³. En los países donde ya no se añade plomo a la gasolina, se observan en la práctica valores mucho menores a 0.0026 kg/cm³.
• Contenido máximo de azufre. El contenido excesivo de azufre puede incrementar las emisiones nocivas así como los depósitos en la máquina; también puede generar compuestos ácidos que reducen la eficiencia del aceite lubricante y sus aditivos, con lo cual se disminuye la vida del motor. El azufre afecta gravemente los dispositivos catalíticos que se incorporan a los vehículos para disminuir las emisiones de gases parcialmente oxidados. Los compuestos de azufre se emiten como óxidos de azufre, también sumamente nocivos al medio ambiente. Cuando se deja de introducir azufre, el convertidor catalítico recupera su eficiencia. En la gasolina con plomo en México el nivel de porcentaje de azufre en peso máximo es de 0.15, mientras que en la gasolina sin plomo no debe rebasar 0.05% en peso para la zona metropolitana del país.
• Propiedades anticorrosivas. Si la gasolina se pone en contacto con una pequeña tira de cobre, no debe ennegrecerla. Así se demuestra la inexistencia de sustancias corrosivas, sobre todo las que se derivan de los compuestos de azufre. Recuérdese que el azufre al ser quemado genera gases que atacan la máquina y el medio ambiente.
• Tolerancia al agua. El valor está dado por la máxima temperatura que causa una separación de fases de la gasolina oxigenada. Los límites varían de acuerdo a la localidad y la época del año. En Alaska cambia de -41°C en diciembre y enero a 9°C en julio, mientras que en Hawai todo el año alcanza 10 grados.
• Estabilidad. Debe tenerse en cuenta que la gasolina puede ser almacenada por mucho tiempo. En consecuencia no debe formar gomas que se precipiten. Hemos dicho que los hidrocarburos no saturados tienden a producir gomas y con más rapidez en presencia de cobre metálico, que actúa como catalizador de la reacción. Por eso a la gasolina se le añaden antioxidantes y pasivadores de metales que los desactivan.
• Ingredientes adicionales en la gasolina. Aunado a que es necesario formular gasolina de diferentes tipos dependiendo del tipo de automóvil, otros ingredientes son necesarios para el funcionamiento del carburante de base y, genéricamente, se les llama aditivos. Los primeros fueron los aditivos antidetonantes, que permitieron a la industria automovilística de los años treinta producir máquinas con mayor compresión y ganar en eficiencia. Los antioxidantes fueron introducidos en los años treinta para combatir la tendencia de los productos desintegrados en las refinerías a formar gomas y oxidarse, hecho que tuvo una importancia mayor al introducirse el proceso catalítico de desintegración que genera olefinas. A la gasolina se le añade un paquete de aditivos que incluye:
— Anti-oxidantes: las sustancias que inhiben las reacciones de oxidación de los hidrocarburos antes de que se quemen con el oxígeno en la cámara de combustión. En particular hablamos de los hidrocarburos no saturados.
— Estabilizadores de la gasolina: sustancias que impiden la formación de gomas y mejoran la estabilidad de la gasolina. Hay que recordar que la gasolina cuenta entre sus componentes a las olefinas, sustancias muy reactivas que gustan de hacerlo con sus congéneres a la temperatura ambiente formando polímeros, es decir grandes cadenas que tienen un aspecto como de goma y que como se comprenderá son nocivas para el motor.
— Inhibidores de la corrosión: sustancias que impiden que la gasolina ataque los tanques de depósito de la gasolina.
— Colorantes: se añaden en concentraciones muy pequeñas, del orden de 10 partes por millón de gasolina. Se da a la gasolina coloraciones diferentes a fin de diferenciarla y evitar que se nos dé gato por liebre.
— Anticongelantes: en los países de temperaturas frías, estos compuestos impiden la formación de hielo.
— Aditivos para impedir la formación de depósitos en válvulas o bujías: los depósitos a los que nos referimos los forman gomas o productos de la degradación de la gasolina que se depositan en los sistemas de admisión de combustible y cámara de combustión de los automotores. Estos depósitos interfieren con el proceso normal de combustión y el buen funcionamiento del motor; se comprenderá que la combustión deficiente genera contaminantes. Los aditivos detergentes dispersantes permiten mantener limpios los sistemas de admisión. Los depósitos se generan por la presencia de olefinas y de alcoholes y los fabricantes de gasolina ya los incluyen en forma rutinaria.
— Aditivos que ayudan a impedir la obstrucción de las válvulas en los autos de mucho uso: el taponamiento de las válvulas es uno de los problemas mayores en los autos con mucho kilómetraje recorrido. Generalmente se debe a que el auto se somete a altas velocidades y a carga excesiva, lo que hace que la válvula no asiente generando puntos calientes muy elevados y que la máquina sufra daños severos. El mecanismo se tiene identificado: el primero es la formación de óxido de hierro procedente de la cámara de combustión que se adhiere a la cara de la válvula, partículas que actúan como un filoso cuchillo que arranca pedazos del asiento de la válvula. Pueden o no ser adicionados en la fórmula de la gasolina al ser vendida por lo que en las gasolinerías suele haber aditivos de este tipo generalmente a base de compuestos de potasio y sodio.
La pregunta es si comprar o no los productos en venta para resucitar nuestro viejo automóvil, dejar de contaminar, gastar menos gasolina y alcanzar en la autopista velocidades cercanas a la de la luz. Algunos de ellos suelen tener un principio de operación que suene coherente aunque desafortunadamente la relación costo-beneficio no es muy ventajosa sobre todo al calcular el efecto que tendrá el producto a largo plazo. Otros productos son obra de charlatanes. En el caso de los motores diesel, los aditivos tienden a mejorar la fluidez del material, sobre todo en épocas frías, ya que los hidrocarburos son más pesados y tienden a cristalizarse a bajas temperaturas. Además hay aditivos que aumentan la capacidad del diesel para inflamarse.
Los carburantes para autos de carreras
Todo aquel que maneja un automóvil ha soñado ser piloto de autos de carrera. El objetivo primario de una carrera es obtener el máximo de potencia de un vehículo, que puede ser incrementada por el diseño de la máquina, pero la potencia alcanzará su máximo usando un carburante apropiado. Repasemos los factores para escoger el carburante:
• Poder calorífico: entre mayor sea el contenido energético del carburante, mayor será la potencia que rinda el automóvil.
• Estequiometría: entre menor sea la relación estequiométrica aire/carburante (o la relación oxígeno/ carburante si es otro oxidante el que se emplea en lugar del aire), mayor será la cantidad de gasolina que se puede introducir en la cámara de combustión.
• Cociente de productos a reactivos: cuanto mayor sea esta relación, mayor será la presión de combustión en el cilindro y, por tanto, mayor será la potencia liberada por el auto.
A fin de que esto quede claro tomemos como ejemplo el nitrometano, compuesto que al quemarse con el oxígeno o el aire genera la siguiente reacción:
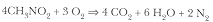
Como se puede observar, siete moles de reactivos generan 12 moles de productos.
• Resistencia al cascabeleo: éste lleva a que la máquina se destruya durante la carrera. Como las condiciones de manejo son severas, el número de octano de motor (MON) es generalmente más importante que el RON como guía general para evitar el cascabeleo y las detonaciones indeseables.
• Los límites de inflamabilidad deberán ser tales que se pueda usar una cantidad elevada de aire para llevar la potencia al máximo.
• Volatilidad: el carburante debe tener un punto de ebullición tal que permita ser transportado en forma líquida pero que se volatilice rápidamente al entrar en la máquina.
Por supuesto no existe un carburante con todas las características deseables y deberá escogerse las que se consideren importantes. Como las características de un carburante varían de una a otra marca, las máquinas deberán ser diseñadas para una gasolina en especial. Un parámetro importante que provee un método de comparación del calor liberado por diferentes gasolinas en una máquina es la Energía específica (EE), en inglés specific energy. El valor teórico de la EE se calcula dividiendo la capacidad calorífica entre la relación aire/carburante lo que da como resultado la energía del carburante enviada a la cámara de combustión por unidad de masa de aire introducida. Veamos algunas propiedades de tres carburantes para carreras empleados usualmente:

De los datos de la tabla se ve que el nitrometano tiene una EE 2.3 mayor que el isooctano y que el metanol es ligeramente mejor que el isooctano ya que, en ambos casos, la relación estequiométrica aire/carburante es mucho menor que la del isooctano a pesar del hecho de que este último tenga el poder calorífico más elevado. También notamos que el metanol es un buen carburante para los autos de carreras, tiene buenas propiedades antidetonantes por lo que se pueden emplear relaciones de compresión de 16:1, se vaporiza fácilmente, es barato y está a la mano. Su principal problema es que su consumo es muy elevado, particularmente si se requiere una máxima potencia, de ahí que sea necesario utilizar un tanque de gran volumen.
¿Y SI NO CONSEGUIMOS CARBURANTES PUROS?
Siempre queda el consuelo de emplear gasolina, al fin de cuentas hay siempre disponibilidad de ella y tiene bajo costo. Su limitación mayor es que relativamente tiene baja EE y tendencia a cascabelear el auto cuando las relaciones de compresión son elevadas y necesarias para obtener el máximo de potencia. En el periodo entre guerras se empleaba la gasolina de bajo octano mezclada con benceno y otros compuestos aromáticos pesados. La General Motors patentó una gasolina de aviación llamada "Hector" que consistía de una mezcla de 80% de ciclohexano y 20% de benceno, excelente por cierto en cuanto a su calidad de octanaje pero no aceptable debido a la toxicidad del benceno. Puede emplearse el tetraetilo de plomo y parafinas muy ramificadas como el isooctano, el triptano de buenas propiedades antidetonantes. Existen otras moléculas cíclicas como el ciclohexano que si bien tiene un bajo índice de octano se mezcla bien con otros componentes presentes y el número de octano resultante es satisfactorio. Para que haga sus mezclas apropiadas en la siguiente tabla le proporcionamos algunos valores de octano para hidrocarburos puros:

En resumen, para obtener gasolina para los autos de carrera es necesario emplear corrientes de refinería consistentes en grandes cantidades de productos generados en la alquilación, sumados a corrientes aromáticas provenientes de la reformación catalítica y tratadas con la máxima cantidad de aditivos antídetonantes posible.
Si los hidrocarburos de una gasolina por sí solos tienen dificultad en quemarse del todo y convertirse en bióxido de carbono y agua, queda emplear carburantes con alto contenido de oxígeno o añadir a la gasolina proporciones importantes de estos carburantes como aditivos. Dos alcoholes son útiles, el metanol y el etanol que pueden ser carburantes alternos para el uso en motores que inicialmente empleaban la gasolina, y presentan dos ventajas generales: que se pueden fabricar a partir de fuentes distribuidas en muchas partes del planeta, lo que no sucede con el petróleo, y son materiales renovables, lo que hace posible emitir menor cantidad de emisiones nocivas a la atmósfera. Su desventaja principal es que su contenido energético es menor al de la gasolina o el diesel. Este inconveniente se puede reducir en cierto grado si se mejora el diseño de los autos. Otro problema es que los alcoholes no son lo suficientemente volátiles para el encendido en frío de autos que utilizan bujías a menos de que se emplee un poco de gasolina.
En lo que se refiere a su empleo en máquinas encendidas por bujías podemos resumir sus cualidades de la siguiente manera: tanto el metanol como el etanol tienen excelentes cualidades de octano, se queman muy limpiamente y se emplean como carburantes en los autos de carreras ya que su octanaje permite operar las máquinas con altos niveles de compresión y su capacidad para quemarse en mezclas ricas con aire, aunado a su alto calor de vaporización, les permite producir más potencia que la que se obtiene con la gasolina.
El metanol es incoloro, inodoro y casi sin sabor. Además es el más simple de todos los alcoholes. Probablemente la primera gota la produjo la naturaleza cuando un rayo cayó sobre un árbol que contenía lignina y que había emergido de la sopa prebiótica. La pirólisis de la lignina seguramente generó los primeros grupos metilos que, al combinarse con radicales hidroxilo, generaron el metanol. Se le emplea como materia prima para muchos procesos químicos, como solvente y como aditivo y sustituto de la gasolina. Se le empleó como carburante a principios de siglo hasta que se produjo la gasolina que era más barata. Antes de que aparecieran los métodos sintéticos de obtención, desarrollados en los años veinte, se extraía de la madera como un subproducto del carbón, de ahí que se le conociera como alcohol de madera pero los rendimientos eran muy bajos, una tonelada de madera daba unos 25 litros del alcohol. En la segunda Guerra Mundial los alemanes lo producían sintéticamente para emplearlo en sus aviones, pasado el conflicto volvió a dormir el sueño de los justos hasta que con la crisis petrolera de los años setenta despertó de nuevo el interés por su disponibilidad y bajo costo. El interés volvió a decaer cuando surgieron problemas en el mezclado del metanol y la gasolina. Se informaba que no se mezclaban homogéneamente y los productos se separaban creando dos fases. En el futuro, el metanol puede ser una fuente adicional de carburantes, ahora su fuente será el gas natural. Los precios de obtención actuales son prohibitivos si se los compara con la gasolina. Otra fuente que puede emplearse es la biomasa, constituida de residuos forestales, de la industria del maíz y los componentes celulósicos de los desechos municipales.
El etanol tiene también una añeja historia. El original modelo T de la Ford había sido diseñado para trabajar con él en lugar de la gasolina. Luego se le empleó para aumentar el octano añadiéndolo en concentraciones del orden del 10% en volumen, con lo que se podía alcanzar de dos a tres números de octano suplementarios. En algunos países se emplea como sustituto de la gasolina aunque también es importante materia prima para producir éteres. Algunas de las objeciones que se hacen al etanol es que no es un producto que se genera en las refinerías, de ahí que su transporte hasta ellas a fin de mezclarlo con la gasolina aumenta los costos. Además la mezcla de etanol con los hidrocarburos requiere que los tanques de las refinerías no contengan agua para que no haya problemas en la homogeneidad de la mezcla. ¿Cuál es la ventaja adicional del etanol? Una tendencia mundial a largo plazo será sustituir los hidrocarburos del petróleo por sustancias que se generen a partir de la fotosíntesis. Esto queda claramente expresado en la figura 28.
Resumamos las ventajas de los alcoholes comparadas con la gasolina. Una cosa es evidente: para aprovechar al máximo las propiedades de los alcoholes, las máquinas deben diseñarse específicamente con ese fin. Debido a que los alcoholes tienen menor contenido energético, en el caso del metanol es menos de la mitad que el de la gasolina, la economía volumétrica del carburante será siempre menor que la conseguida con la gasolina. Sin embargo se pueden obtener mejoras en la eficiencia térmica con los alcoholes debido a que presentan las siguientes diferencias en las características de la combustión, cuando se les compara con la gasolina:
• Los alcoholes se queman con una temperatura menor de flama, así, se pierde menos calor por conducción o radiación hacia el sistema de enfriamiento del auto.
• Los alcoholes se queman más rápidamente y generan un mayor volumen de productos de combustión por lo que aumenta la presión en los cilindros.
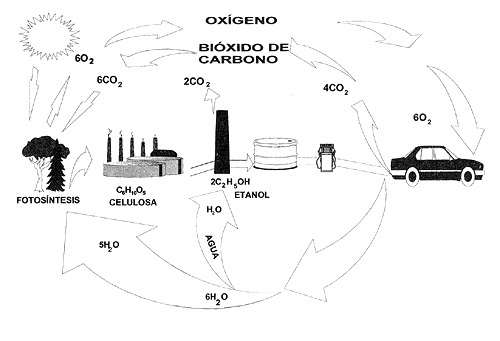
Figura 28. Ciclo del carbono y del etanol.
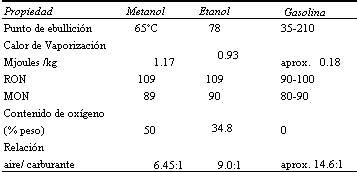
En la siguiente tabla se hace un sumario de algunas de las propiedades físicas y químicas de los alcoholes cuando se les compara con una gasolina.
EL DIESEL, LA HISTORIA DE UN CENTÉSIMO DE SEGUNDO
El motor Diesel tiene la misma apariencia que el de gasolina. La gran diferencia
estriba en que el de diesel no tiene bujías. En los años posteriores a la explotación
del petróleo mediante la perforación (1859), el queroseno, empleado en el alumbrado
con lámparas, era el producto más valioso que se obtenía. La gasolina se quemaba
por inservible, el residuo pesado iba al basurero y el "destilado intermedio"
se enviaba a la ciudad. Con el invento del motor diesel, el destilado encontró
aplicación. Las necesidades de los primeros motores que emplearon diesel no
eran tan específicas como ahora y ha habido necesidad de mejorarlo a fin de
que los diseños de las máquinas cumplan con una relación potencia/peso más elevada.
Lo primero fue eliminar los carburantes con alta viscosidad y residuos difíciles
de quemar. Lo segundo, mejorar la combustión. Los carburantes para máquinas
que operaban a baja velocidad y pocas revoluciones por minuto, perdían su utilidad
cuando se trataba de construir aparatos que se desplazaran a altas velocidades,
a más de 2 000 revoluciones por minuto. La calidad de ignición de un diesel
inicialmente se expresaba por el llamado Índice Diesel que era una función
de la densidad multiplicada por el punto de anilina y dividido entre cien. Fácil,
pero, ¿qué es el punto de anilina? Los crudos y sus destilados están constituidos
por muchas variedades de hidrocarburos: parafinas, naftenos y aromáticos. Los
aromáticos tienden a mantenerse líquidos y no formar sólidos cuando la temperatura
disminuye. La anilina es un compuesto químico aromático, y se denomina punto
de anilina de un carburante a la temperatura más baja a la cual cantidades iguales
de anilina y carburante permanecen en solución. Un carburante con alto contenido
de aromáticos tendrá un punto de anilina menor que uno de alto contenido en
parafinas. El Índice Diesel se ha dejado de usar por su falta de precisión
y hoy en día los diesel se caracterizan por el Índice de cetano. El cetano
es un hidrocarburo parafínico de fórmula 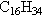 . Para juzgar el índice de cetano se usa el que no está ramificado y se le da
un valor en la escala de 100, la otra molécula de referencia es el 2,2,4,4,6,8,8,
heptametil nonano, que tiene un número de cetano de 15. ¿Asusta al lector la
descripción de este último compuesto y no se lo puede imaginar? Regalado, pinte
nueve carbones seguidos, numérelos del uno al nueve y en el segundo carbono
ponga dos grupos metilo,
. Para juzgar el índice de cetano se usa el que no está ramificado y se le da
un valor en la escala de 100, la otra molécula de referencia es el 2,2,4,4,6,8,8,
heptametil nonano, que tiene un número de cetano de 15. ¿Asusta al lector la
descripción de este último compuesto y no se lo puede imaginar? Regalado, pinte
nueve carbones seguidos, numérelos del uno al nueve y en el segundo carbono
ponga dos grupos metilo, ![]() , igual en el carbono cuatro, uno en el seis y dos metilos en el carbono ocho.
Decíamos entonces, antes de desviarnos a la nomenclatura química, que el índice
de cetano calcula el número de cetano de un diesel a partir de una relación
empírica con parámetros de densidad y volatilidad. El número de cetano en sí
es una medida de la calidad de ignición de un diesel y está basado en el tiempo
de encendido de la máquina. Cuanto mayor es el número de cetano, menor es el
tiempo que tarda en encender y por ende mejor la calidad de la ignición.
, igual en el carbono cuatro, uno en el seis y dos metilos en el carbono ocho.
Decíamos entonces, antes de desviarnos a la nomenclatura química, que el índice
de cetano calcula el número de cetano de un diesel a partir de una relación
empírica con parámetros de densidad y volatilidad. El número de cetano en sí
es una medida de la calidad de ignición de un diesel y está basado en el tiempo
de encendido de la máquina. Cuanto mayor es el número de cetano, menor es el
tiempo que tarda en encender y por ende mejor la calidad de la ignición.
Hemos dicho que el mecanismo de funcionamiento depende de que el carburante se inflame, lo que se trata precisamente de evitar en los motores de gasolina. Contrario al de gasolina, el aire no se mezcla con el carburante antes de ser inyectado en el cilindro. Sólo se inyecta aire y, conforme el pistón se mueve hacia el tope del primer tiempo de compresión, se va calentando y justamente cuando el pistón llega a su tope el diesel se inyecta al cilindro. Al contacto del aire sobrecalentado, el carburante se quema y causa el movimiento del pistón. Varias fases se suceden cuando el carburante se inyecta en el cilindro. Primero, entra en forma de líquido, se vaporiza al contacto del aire caliente y llega a la temperatura de ignición. La segunda fase se da cuando la combustión ocurre y comienza a inflamar al líquido y al vapor que la rodean. El movimiento comienza a dar fruto y finalmente, conforme el resto del líquido es bombeado al cilindro, también se inflama, manteniendo o incrementando la presión sobre el pistón. Ha pasado una centésima de segundo. En la figura 29 presentamos la demanda esperada de diesel en México como combustible para automotores en miles de barriles diarios, las cifras muestran la evolución del contenido de azufre: en 1991 existía diesel con más de 0.5% de azufre, lo que afortunadamente ha ido disminuyendo con el tiempo y cada vez este carburante contiene cantidades menores de tan nocivo elemento. Actualmente llega a 0.05% en peso.
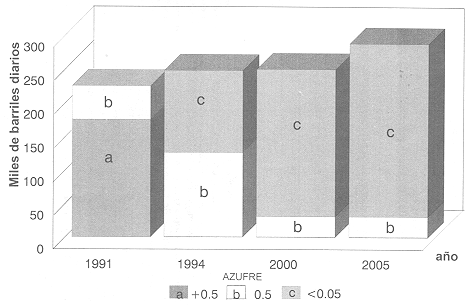
Figura 29. Evolución de la demanda de diesel a) diesel de más de 0.5% en
peso de azufre, b) 0.5%, c) 0.05 por ciento.
![[Inicio]](../img/begin.gif)
![[Anterior]](../img/prevsec.gif)

![[Siguiente]](../img/nextsec.gif)