III. LOS CARBURANTES ALTERNOS
LAS SUSTANCIAS OXIGENADAS COMO ADITIVOS
EL USO de aditivos oxigenados en la gasolina, como los alcoholes, comenzó en los años veinte cuando se descubrió su cualidad de elevar el octano de los carburantes entonces disponibles. Fue en los años setenta cuando se volvió a hablar de los alcoholes, caídos en desuso al aumentar el precio del petróleo. Los éteres también empezaron a usarse por el mismo tiempo y el empleo de los dos tipos de moléculas se ha incrementado y extendido en muchos países dado que los refinadores encontraron un producto capaz de aumentar el octano en tiempos en que el crudo era escaso por asuntos políticos: también vieron en ellos una fuente importante para aumentar el octano cuando muchos países, entre ellos México, iniciaron una campaña para desaparecer el tetraetilo de plomo de las gasolinas vendidas. Desde el punto de vista económico, los compuestos oxigenados han tenido un papel importante en estabilizar los precios del mercado del petróleo. Más recientemente los beneficios de los productos oxigenados al reducir las emisiones contaminantes de monóxido de carbono y de hidrocarburos han hecho que en muchos países se haga obligatorio añadir un mínimo de ellos a la gasolina.
La mayoría de los aditivos oxigenados son alcoholes o éteres y contienen de uno a seis átomos de carbono. En particular los alcoholes se han empleado en la gasolina desde los años treinta. De los éteres existe una variedad de la cual hablaremos adelante. Daremos primero la fórmula de los más representativos. De los alcoholes y añadidos en concentraciones superiores a 1 o 2%, los más usados son metanol, etanol, isopropanol, terbutanol y mezclas de alcoholes con uno a cinco carbones. De los éteres, los más empleados son: el éter metil-terbutílico (EMTB), el metil-teramílico (EMTA) y el etil-terbutílico (EETB) de los cuales presentamos sus fórmulas:
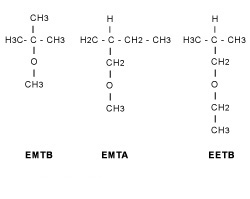
EMTB, EMTA y EETB
De los éteres más empleados el EMTB es tal vez el número uno, pues se mezcla muy bien con los hidrocarburos de la gasolina; la demanda parece crecer sobre todo en los países en los cuales se ha ido sustituyendo paulatinamente el plomo en la gasolina. Su manufactura comercial se inició en Europa, específicamente en Alemania e Italia, alcanzando gran popularidad en los años setenta a raíz del conflicto petrolero. La síntesis del éter se realiza catalíticamente en las refinerías, mezclando el isobuteno (producto gaseoso que se obtiene del proceso de la desintegración catalítica y del que ya hablamos) con el metanol:
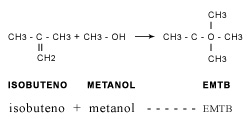
Aunque en algunos países se permite adicionar EMTB hasta un 15% en volumen, por lo general, se añade entre 6 y 10% aunque el valor puede elevarse en los lugares que requieren oxígeno para mejorar la combustión. El EMTB empleado en altas concentraciones puede aumentar el octano hasta en tres números. No es tan sensible al agua como los alcoholes, y la volatilidad de la gasolina, punto que hay que cuidar con mucho cuidado, no se ve incrementada. El EMTA, químicamente conocido como el éter etil-teramílico, se obtiene por reacción entre el metanol con el isoamileno:
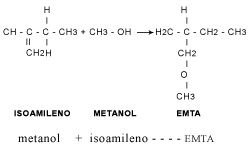
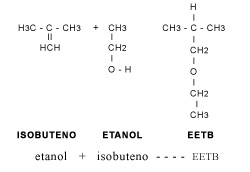
Como su predecesor, los fabricantes de gasolina lo han empezado a experimentar con el fin de aumentar el octano y proveer oxígeno. Se considera que tiene propiedades parecidas al EMTB y se añade a la gasolina hasta en 17% en volumen aunque en la realidad se le adiciona en menor cantidad. En su máxima concentración eleva el octano en tres números y una gasolina que lo contiene posee 2.7 % en peso de oxígeno. El EETB o éter etil-terbutílico, también se puede añadir hasta en 17% en volumen con incrementos de octano en esas condiciones de tres números de octano, según la gasolina en cuestión. Como el EMTA, su adición provoca que la presión de vapor de la gasolina se vea disminuida. Su obtención se hace a partir de etanol con isobuteno
De lo que hemos visto podemos concluir que los oxigenados tienen altos valores de octano. De hecho antes de que se introdujeran a la gasolina para mejorar la combustión, el etanol y el EMTB se añadían para aumentar el octano y no el contenido de oxígeno. Hay que hacer notar que la adición de oxigenados a la gasolina se hace con el propósito de reducir las emisiones tóxicas aunque no las reduce todas. Sólo son eficientes si se modifica cuidadosamente la fórmula, de lo contrario su efecto puede incrementar las emisiones nocivas. Añadir oxigenados a los automóviles sin un buen control de la relación carburante/aire, hace que se muevan hacia la región de mezcla "pobre", en la cual se produce menos monóxido de carbono, CO, un producto tóxico como veremos.
La adición de compuestos oxigenados ha creado, según nuestro criterio, gran confusión y se manipulan mitos y leyendas de todo tipo que trataremos de aclarar. Queda claro que los oxigenados mejoran el octano en la gasolina a la que no se le añade plomo y aumentan la capacidad de combustión, pero muchos técnicos tienen aún dudas sobre tantas bondades. En primer término no pueden darse valores absolutos de octano obtenido al mezclar los oxigenados ya que la calidad que se obtenga dependerá de los otros componentes presentes.
Suponga que tiene un automóvil moderno y de pronto al encenderlo observa que el marcador de gasolina está bajísimo. Como Sherlock Holmes empieza a conjeturar: 1) fui a la gasolinería y me vieron la cara, 2) el tanque tiene fugas, 3) alguien usó el automóvil.
La explicación más probable es la siguiente: una gasolina común contiene en promedio 1.5 veces más calorías por litro que el etanol. Si compara esa relación concluye que si se le añadió 10% en volumen de etanol tendrá una reducción del 3.4 % de energía por litro. En los vehículos con controles de combustión refinados, añadir gasolina que contiene compuestos oxigenados produce menos calor ya que el oxígeno no contribuye con energía. Así, para obtener la misma eficiencia se deberá consumir mayor cantidad de combustible.
Cuando se empezó a experimentar con los compuestos oxigenados se observó que la volatilidad de los carburantes se incrementaba en demasía. Esto hizo que mucha gente atribuyera a los oxigenados, especialmente al etanol, el problema del calentamiento de los autos. Diremos que la presión de vapor de la gasolina al adicionarse los compuestos oxigenados no se incrementa y hay casos, ya lo dijimos para el EMTA y EETB, en que disminuye. En resumen, la presencia o ausencia de oxigenados no es necesariamente una indicación de la capacidad del carburante para vaporizar bien o no, esto dependerá del conjunto de componentes de la gasolina.
¿SE VA A DISOLVER MI AUTOMÓVIL?
Mucha gente piensa que los automóviles se corroen a causa de los oxigenados. Debe recordarse que la corrosión de los autos se debe a la presencia de agua o de compuestos ácidos. La gasolina es corrosiva y por ello en la refinería se le adicionan sustancias que evitan la corrosión. El EMTB es ligeramente soluble en agua y puede aumentar la capacidad de la gasolina de atraparla pero el incremento es pequeño. En el caso de los alcoholes la situación es diferente pues son más solubles en agua, pero en general las concentraciones de anticorrosivos neutralizan este efecto. En lo que concierne a los elastómeros presentes en partes del auto no se puede generalizar su compatibilidad con los oxigenados. Al iniciarse la oxigenación de las gasolinas se informó que muchos materiales sufrían deformaciones, especialmente con los alcoholes, pero esto se ha ido corrigiendo. Hay que recordar que en Brasil más de 5 000 000 de autos emplean etanol puro y a la gasolina se añade hasta 22% de etanol, por lo que la incompatibilidad de los materiales puede deberse a su uso en modelos muy antiguos.
El contenido de oxígeno de la gasolina puede llegar hasta 3.5% en peso, todo depende del tipo y concentración empleados. Aquellos con espíritu de mecánicos se preguntarán si no habrá que modificar la relación aire/carburante. La respuesta es negativa para esos rangos de concentraciones; en los modelos recientes esta relación se regula mediante sensores de oxígeno computarizados instalados a la salida del múltiple del auto, que compensan los posibles cambios debidos al contenido de carburante y a la densidad del aire. Si tiene un automóvil que carece de estas maravillas puede notarlo al observar los síntomas característicos de funcionar con una mezcla pobre de aire: el auto se para y no camina ni rogándole. Pero para que se entere le damos unos datos típicos de la relación aire/carburante:
• Gasolina sin oxigenados = 14.6
En la figura 30 resumimos los diferentes tipos de oxigenantes y el contenido de oxígeno expresado en el porcentaje en peso que proveen para los alcoholes y los éteres.
OTROS CARBURANTES ALTERNOS A LA GASOLINA
¿Cuál es el mejor sustituto para el motor de pistón? La mayoría de los especialistas consideran que éste prevalecerá por muchos años, tanto por consideraciones técnicas como económicas. El principio de siglo estuvo marcado por una revolución en el transporte, cuando la máquina térmica reemplazó a la bestia. El inmenso éxito del automóvil, debido a su bajo costo y múltiples usos, creó una inmensa industria que satisface dicha demanda: vehículos, carreteras, equipamiento y carburantes. En tal situación es necesario empezar a adelantar las futuras estrategias de evolución. Queda mucho por lograr en el campo de la tecnología de los autos. No debe olvidarse la necesidad de revolucionar el campo de los carburantes. En el futuro cercano será necesario pensar en transportes que no generen emisiones de ningún tipo a la atmósfera, pero esos cambios no se pueden dar de la noche a la mañana. Revisemos qué alternativas de carburantes tenemos a mano o en el horizonte. La búsqueda de nuevos combustibles ha sido materia de estudio y se tienen identificados, con sus pros y contras. Se considera que es tiempo de impulsar el uso de otras fuentes de energía debido al deterioro del ambiente y por el uso de combustibles fósiles. En Estados Unidos se gasta mucho dinero por asuntos de salud relacionados con la contaminación del aire. En muchos países se hacen cuentas del costo de importar el petróleo y se buscan alternativas, veamos cuáles son éstas.
CONTENIDO DE OXÍGENO (% EN PESO)
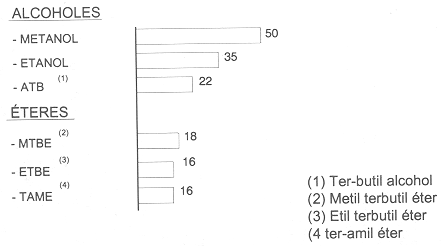
Figura 30. Contenido de oxígeno para varios alcoholes y éteres que se mezclan con gasolina.
• Gas natural. El gas natural, después de la hulla, es el carburante fósil más abundante; lo constituye una mezcla de hidrocarburos y pequeñas cantidades de no hidrocarburos. Existe en estado gaseoso o mezclado con petróleo crudo en los depósitos subterráneos y es recuperable como gas en condiciones atmosféricas de presión y temperatura. El gas natural comprimido contiene entre 70 y 90% de metano, 10 a 20% de etano, 2 a 8% de propano y cantidades menores de hidrocarburos más pesados que llegan hasta el butano. En el mundo hay reservas importantes, y se le clasifica según se encuentre en el yacimiento como gas no asociado si no está en contacto con el petróleo crudo y como gas asociado si está en contacto con aquél, ya sea como gas natural libre o como disuelto en petróleo.
Como carburante tiene un alto índice de octano además de que al ser quemado sus emisiones nocivas son menores. Comparado con la gasolina, el índice de octano es de unos 130; es decir que no existen desventajas técnicas siempre y cuando la instalación del tanque que lo contiene sea correcta. ¿Cuál es el "pero", entonces? Pues la capacidad de un auto de cargar grandes cantidades: los vehículos necesitarían de 1 a 3 cilindros de 90 a 120 litros de capacidad y aun así esto representaría 50% del trabajo que provee la gasolina. En resumen podríamos decir que transformar un automóvil diseñado para usar gasolina, para emplear gas es muy costoso. En México no se cuenta con una red de gaseras lo suficientemente amplia para recargar los tanques. Este carburante se ha empleado extensamente en Italia y Nueva Zelanda, en este último país existían en 1987 130 000 autos que podían usar gas o gasolina y 380 estaciones de servicio; se estima que hoy en día a nivel mundial operan aproximadamente un millón de vehículos a gas y para 2010 sólo en Estados Unidos se considera que circularán 11 millones. La economía tiene un papel importante en su uso si se le compara con la gasolina. Al convertir un auto que usa gas, se generará una pérdida de alrededor de 15% en la potencia, lo que repercutirá en el bolsillo del consumidor, sobre todo si el precio de la gasolina se mantiene bajo. Su ventaja principal respecto a la gasolina es la emisión menor de contaminantes y tóxicos si el vehículo cuenta con convertidor catalítico, aparato del que hablaremos más adelante.
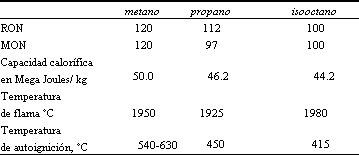
• Gas de petróleo licuado. El gas licuado es esencialmente propano en mayor proporción que butano e isobutano. En muchos países el gas grado para autos está constituido por entre 90 y 95% de propano y el resto de butano. A principios de siglo existían ya máquinas movidas a propano y el interés de emplearlo como carburante se ha incrementado en los últimos años sobre todo para el transporte masivo. Circulan actualmente unos 3.5 millones de vehículos con este carburante y podemos decir que ocupa el tercer lugar después de la gasolina y el diesel. Una ventaja sobre el gas natural comprimido es que los tanques no tienen que resistir presiones tan altas y el carburante se guarda en forma líquida. Desde el punto de vista del medio ambiente es uno de los carburantes más limpios y se usa extensamente en las flotillas de taxis de varios países asiáticos. Lo anterior lo da el hecho de que al ser un gas en lugar de un líquido, no tiene que pasar la etapa de vaporización lo que permite que el automóvil no emita muchos contaminantes al estar frío. También es un producto de alto octanaje. Comparado con los automóviles convencionales se requiere aproximadamente entre 20 a 25% más carburante de no ser que la máquina sea especialmente modificada para emplearlo, con lo cual no disminuye la potencia o se incrementa el consumo. Veamos algunos datos comparativos entre los dos carburantes que hemos mencionado hasta el momento comparados con el isooctano.
Para usarlo directamente, el automóvil debe sufrir modificaciones. El propano comparado volumen a volumen con la gasolina, genera 20% menos energía así que para tener un radio de manejo equivalente al de los autos a gasolina se requiere que la cantidad guardada en el tanque sea mayor.
• El hidrógeno. Se ha hablado mucho de este gas que sigue siendo un tema a futuro y altamente explosivo. En los próximos diez años su peor aplicación sería en las máquinas de combustión, ya que es mejor emplearlo como reactivo en varios procesos de refinación que generan carburantes más limpios. Sin embargo los estudios para desarrollar una tecnología que funcione con máquinas de combustión interna no ha cesado desde principios de siglo. El hidrógeno tiene alta velocidad de flama (3.24 a 4.4 m/s), inflamabilidad en amplios rangos (desde 4 a 75% en volumen), alta temperatura de autoignición (520°C) y temperaturas de flama de 2 050°C. Todo apunta a que es un gran carburante para el transporte, pero el problema fundamental reside en generar un sistema de almacenaje que satisfaga todos los requisitos de seguridad. Para oxidar el hidrógeno, el oxígeno es obviamente el candidato adecuado, sin embargo la mayoría se inclina por el aire. Desafortunadamente esa temperatura de flama es lo suficientemente elevada para disociar el nitrógeno atmosférico y generar óxidos de nitrógeno indeseables. Además, al ser la velocidad de la flama tan rápida hay que considerar la posibilidad de que la flama pase rápidamente por los inyectores sin ser detenida causando una ignición previa, no deseada. Se podría pensar que lo anterior se mitigaría si se inyecta un chorro de agua, que tiene el beneficio adicional de aumentar la eficiencia térmica, aunque sin duda hará disminuir la temperatura de combustión. En resumen, el asunto tiene sus ventajas y desventajas que sin duda serán resueltas en el futuro.
• La electricidad. La mayoría de la energía que empleamos se obtiene de procesos de conversión como el siguiente :
energía química ® calor ® energía eléctrica ® trabajo mecánico
energía química ® calor ® trabajo mecánico
Estas rutas proveen las bases para la operación de turbinas de vapor, plantas eléctricas y máquinas de combustión interna. Sin embargo, hay otros métodos de obtener energía útil que no incluyen como intermediario al calor. Hasta finales del siglo XVIII se conocía un solo tipo de electricidad, la estática que se obtenía por frotamiento. Se había demostrado que había cuerpos que conducían electricidad y otros no, pero existía un particular interés en estudiar los pescados que daban "toques" porque los investigadores habían llegado a la conclusión de que la naturaleza de esos toques era eléctrica. En 1780, Luigi Galvani (1737-1798) en Boloña, Italia realizó una observación fortuita que publicó en sus memorias once años después: "teníamos una rana disecada en una mesa en la que había cerca una máquina eléctrica. Uno de mis asistentes, por casualidad, tocó uno de los nervios de la pata con un bisturí. El músculo se agitó en convulsiones violentas, otro de mis asistentes creyó haber visto salir al mismo tiempo una chispa de la máquina." Galvani realizó muchos experimentos más para descubrir cuál era el principio escondido en todo esto, también demostró lo contrario, la contracción del músculo producía el fenómeno eléctrico. Galvani siempre creyó que esta "electricidad animal" era de carácter único, inclusive se le llamó a este efecto "galvanismo", pero estaba equivocado. Alessandro Volta (1745-1827) profesor de la Universidad de Pavia, atraído por los resultados de Galvani siguió profundizando en los experimentos. Encontró que la descarga eléctrica no sólo produce la contracción muscular sino también que hay sensación. ¿Cómo demostró esto? La forma es simple: si uno coloca la lengua entre dos placas metálicas de naturaleza diferente que están conectadas por un alambre, hay sensación o no de cosquilleo según el tipo de metal y por tanto hay metales conductores y aislantes. El siguiente paso fue más simple, a principios de 1800 inventó un aparato que producía un flujo de corriente eléctrica para lo cual utilizó recipientes con una solución conteniendo una sal y conectados por arcos metálicos, una junta se metía en un recipiente y la otra en el siguiente. El aparato, conocido ahora como pila de Volta, fue la primera batería de la historia. El 20 de noviembre de 1801, Volta presentó su aparato a Napoleón Bonaparte quien le otorgó una medalla de oro. La historia de Volta tiene antecesores, ya que en 1745 se inventó un aparato en el cual la carga eléctrica podía almacenarse. Hoy en día un aparato de ese tipo se llama capacitor, pero el vaso de Leyden, inventado por Petrus van Musschenbroek, fue objeto de curiosidad en toda Europa y la gente viajaba de lugares muy alejados para observar cómo producía electricidad. Consistía en un vaso de cristal forrado de metal en su interior, donde se encontraba una varilla clavada a un corcho. Esto podía almacenar grandes cantidades de carga eléctrica estática que se le suministraba de una máquina en que la carga se producía por frotamiento. Si el vaso se acercaba a algún metal, cruzaba el aire una chispa minúscula.
A principios de siglo existían tres sistemas de tracción: a vapor, a electricidad mediante acumuladores y a petróleo. No obstante, en Francia, en 1881, un autobús eléctrico equipado con 9 toneladas de acumuladores circulaba por las calles parisinas. En 1899 el belga Jenatzy levantó 105 km/h y batió el récord de velocidad. En 1901, en Francia, Krieger recorrió la distancia París-Chatellerault (307 km) a 19 km/h sin recargar la batería. Del modelo Krieger de 1905 fueron vendidas 2 400 unidades. Los automóviles de baterías hasta el momento, no superan a los de motor de combustión interna en su capacidad de carga, radio de acción y otras ventajas. Este modelo de auto que hemos presentado podrá en un futuro vencer dichas desventajas aunque ahora no es económicamente competitivo. En Estados Unidos el primer vehículo eléctrico de cuatro neumáticos fue construido en 1892. Podía funcionar 13 horas antes de ser recargado y viajaba a la fabulosa velocidad de 23 kilómetros por hora. A finales del siglo los vehículos eléctricos dominaban el mercado automovilístico con autonomía promedio de 80 km. En 1900, 38% de los nuevos autos estadunidenses usaban baterías y por 1912 unos 6 000 autos eléctricos y camiones eran producidos por 20 compañías diferentes. En muchos países hay la convicción de que para finales de siglo los vehículos deberán emitir cero contaminantes. La solución sin duda son los automóviles eléctricos: en el plano técnico el principal obstáculo para comercializar vehículos confiables es la insuficiencia de la fuente de energía que porta el auto. Las baterías disponibles de níquel/cadmio y de plomo son las primeras muy costosas y las segundas tienen poca capacidad para almacenar energía. Otro reto a vencer es que las baterías no adicionen peso muerto al coche y mantengan la potencia de aceleración suficiente. Para dar una idea, el equivalente de 48 litros de gasolina sería una batería de plomo de 2 800 kilos. La General Electric considera que una batería puede alcanzar una vida de unos 35 000 km. Las compañías de electricidad han sido, claro, las promotoras del auto eléctrico, las razones son evidentes y la estrategia empleada ha sido construir vehículos con las técnicas disponibles y ponerlos a funcionar a fin de crear una disposición favorable de la sociedad, pero no todo es color de rosa y hay problemas aún no resueltos, en particular en lo que concierne a la generación de la energía eléctrica. Si en el futuro se produce a partir de hulla, se emitirán contaminantes a la atmósfera. Lo importante es que la tecnología de los automóviles eléctricos mejora cada día. Se encuentran autos de dos asientos que pueden desplazarse de 0 a 90 km/h en 8.5 segundos y mantener una velocidad crucero de 120 km/h. La industria deberá incrementar la vida de la batería a dos o tres años y su periodo de trabajo sin recarga a 160 kilómetros.
• Las celdas de combustible. El principal inconveniente de los acumuladores es su poca capacidad de almacenamiento pero también cuenta mucho el tiempo de recarga que suele ser de varias horas para las baterías de plomo y las de níquel-hierro. El problema se encuentra en el nivel de poder eléctrico instalado en el punto de recarga. Expliquemos esto con un ejemplo: un contador de 30 amperes bajo 220 voltios envía 6.6 kilovatios por hora. Se necesitan de 12 a 15 kilovatios por hora para asegurar a un coche de una tonelada de peso una autonomía de 100 km. Tal vez la solución práctica sean las celdas de combustible recargables manualmente. Las pilas de combustible transforman directamente la energía química en electricidad. Sin embargo, a diferencia del acumulador que necesita ser recargado, la pila es alimentada continuamente con combustible guardado fuera de la celda, hidrógeno o compuestos ricos en hidrógeno. El principio de la pila descansa en la reacción inversa de la electrólisis: una corriente eléctrica descompone el agua en hidrógeno y oxígeno, una nueva combinación del hidrógeno y del oxígeno bajo ciertas condiciones produce electricidad y agua. El principio es conocido desde 1839 y en 1951 un investigador inglés (Bacon) produjo la primera pila de un kilovatio que fue seguida por otras de mayor potencia, la investigación la llevaba Estados Unidos que buscaba generadores de corriente para sus naves espaciales. Para que la reacción suceda, un material reacciona en el electrodo positivo mientras que el otro lo hace en el negativo. Más aún, hay que impedir que lo hagan directamente ya que esto provoca un tipo de cortocircuito químico del cual no resulta la generación de energía eléctrica y sólo aparece energía térmica. Existen muchos tipos de reacciones químicas útiles para este tipo de celdas, sin embargo las que han tenido mayor atención son las reacciones de combustión. El oxidante generalmente es el oxígeno del aire y el carburante preferido el hidrógeno pero ha habido poco éxito cuando se emplean celdas con otros carburantes a baja temperatura que permitan la oxidación directa de los hidrocarburos. Tienen la ventaja de no producir emisiones contaminantes y son tal vez los candidatos más serios para remplazar a las máquinas de combustión interna convencionales, debido a que tienen gran eficiencia de transformación de carburante en electricidad, del orden de 40 a 60%. Su costo es alto, pues requieren de carburantes muy limpios exentos de cloro, azufre o amoniaco que las inhabilita y tienen también corta vida de operación, pero el tiempo lo dirá todo.
• Vehículos con un poquito de todo. No es descabellado por tanto pensar en un sistema de vehículo tipo Frankenstein en el que se unan:
1) Una fuente primaria de poder, que puede ser el generador proveniente de una máquina de combustión interna la cual opera solamente en la mejor sección de su eficiencia, es decir el cociente de energía útil producida dividido por la energía aplicada; una alternativa puede ser las celdas de potencia que acabamos de ver o una turbina.
2) Una unidad capaz de acumular energía, como una batería que funciona de la siguiente manera desde el punto de vista químico
al cargarse la batería se produce plomo (Pb) y óxido de plomo (PbO2) los cuales reaccionan en presencia del ácido sulfúrico (H2SO4) para generar electricidad en la etapa de "descarga" de la batería. Las baterías químicas fabricadas cuando Volta las inventó sólo servían una vez. El físico francés Gastón Planté construyó la primera batería recargable en 1859 y, esencialmente, sigue empleándose hoy en día.
3) Una unidad de manejo casi siempre se piensa en un motor eléctrico que pueda usarse como generador.
Los autos de batería hasta el momento no superan al motor de combustión interna en su capacidad de carga, radio de acción y otras ventajas. El modelo de automóvil que hemos presentado podrá en un futuro vencer dichas desventajas aunque ahora no es competitivo.
• El amoniaco. El amoniaco (NH3) se obtiene de la reacción entre el nitrógeno y el hidrógeno. La mezcla de ambos gases se hace pasar a través de un material catalítico especialmente preparado a base de hierro a temperaturas de entre 450 y 520°C. Hay que hacer notar que la reacción requiere teóricamente de tres moléculas de hidrógeno por cada molécula de nitrógeno, Además, ya que este material no tiene átomos de carbono no producirá bióxido de carbono como producto de la combustión. El amoniaco, al ser oxidado, produce la siguiente reacción:
generándose energía en el proceso, sin embargo su uso como carburante no convence mucho aún debido al alto calor de vaporización que requiere entonces de una etapa de vaporización previa, además de que son necesarias temperaturas relativamente elevadas para provocar su descomposición.
• El agua. Hay quien afirma que una parte de gasolina con dos de agua produce en una máquina de combustión interna el mismo poder que si emplease sólo gasolina. La energía proviene de la disociación del agua mediante un catalizador introducido en la cámara de combustión con lo que, si lo meditamos, volvemos al principio de tener disponible hidrógeno.
• El óxido de propileno. Veamos antes su fórmula:
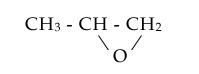
Aparentemente ha sido empleado como carburante en las carreras de automóviles y algunos osados pilotos hablan de él. Es un carburante de buenas propiedades en lo que concierne a volatilidad, inflamabilidad y autoignición. Cuando se usa en las máquinas modificadas para obtener gran potencia siempre que se hallen en una zona ligeramente rica en lo que compete a la relación aire:combustible. Así, la mezcla alcanza alta volatilidad, alta temperatura de autoignición y alto octanaje, además de que la velocidad de la flama se incrementa, con lo que aumenta la eficiencia de la quema de hidrocarburos. El incremento en poder —sin grandes modificaciones en la máquina—, hay que apuntar, se debe a que aumenta la eficiencia volumétrica y se requiere menos oxígeno. El óxido de propileno debe manejarse con extremo cuidado pues se sospecha que es cancerígeno.
• El óxido nitroso. El óxido nitroso se obtiene calentando el nitrato de amonio:
Es un gas incoloro e inodoro. Cuando se le respira por corto tiempo provoca una especie de risa histérica; de él se dice que condujo a que se le llamase gas hilarante. Estuvo de moda en las fiestas de sociedad hacer uso de este gas cuando no había nada mejor que hacer. Una inhalación más prolongada motiva un estado de inconsciencia, por eso este gas, mezclado con aire u oxígeno, se emplea como anestésico general. El óxido contiene 33% en volumen de oxígeno, en consecuencia se puede pensar que la cámara de combustión estará ocupada con menos cantidad de nitrógeno inútil y más carburante se puede inyectar a la cámara de combustión. Su ventaja es que su velocidad de flama puede ser manejada por los motores de combustión interna cuando se emplean hidrocarburos o alcoholes.
Durante muchos años se han dedicado grandes recursos a la investigación y desarrollo de métodos para enriquecer el contenido de oxígeno del aire, con el propósito fundamental de hacer más eficiente la combustión ya que la temperatura de la flama sería más elevada y habría menos nitrógeno presente. La concentración óptima de oxígeno para los automóviles oscila entre 30-40%. Una manera de alcanzar el enriquecimiento necesario es utilizar una membrana. Para dar una idea acerca de las membranas y sus funciones hay que pensar en las membranas semipermeables de los sistemas biológicos; de hecho, son barreras capaces de redistribuir los componentes de un sistema. La fuerza que impulsa este proceso puede ser la diferencia de presión, de concentración o una diferencia de potencial eléctrico. El problema de instalar un equipo con membrana en un automóvil no está resuelto, se requiere una superficie muy grande para producir la cantidad necesaria de aire enriquecido en oxígeno de la máquina de combustión interna. Entonces, la membrana deberá enrollarse dentro de la máquina con lo cual se requiere cierta cantidad de poder para forzar al aire a cruzar toda la membrana.
• Póngale un coco a su automóvil. En Manila, Filipinas; Toronto,
Canadá y Dakota, EUA, es común que los agricultores extraigan del
girasol un aceite para consumo de sus tractores. Pruebas semejantes se han hecho
con aceite de soya, coco, algodón, etc. Ya en 1912 Diesel propuso emplear aceite
de girasol. En la segunda Guerra Mundial los alemanes, aislados en África, empezaron
a sustituirlo por aceites filtrados de palma. Terminada la guerra, el interés
por buscar sustitutos decayó. Pero los aceites tienen futuro. El biodiesel,
por ejemplo, tiene entre sus características ser renovable, no ser tóxico, y
no causar daños al medio ambiente. En un principio se emplearon aceites vegetales,
sin modificación, desafortunadamente presentaban problemas porque suelen descomponerse,
además de ser sumamente viscosos lo que dificulta la atomización del carburante
que trae como consecuencia una combustión incompleta y la formación de depósitos
carbonosos en varias partes de la máquina. Una primera solución en lo que concierne
a la viscosidad fue disminuirla diluyendo el aceite en gasóleo, pero esto era
sacarle el bulto al problema. La solución reside en desarrollar un derivado
de un aceite vegetal, o de la grasa animal, con las propiedades del diesel.
Recientemente la ruta del biodiesel se ha reactivado por las siguientes razones:
1) una modificación química del material de partida genera un mejor producto,
y 2) existe amplia variedad de aceites vegetales utilizables. Presentamos
cálculos de 1990 acerca de la producción mundial de varios aceites vegetales.

Esencialmente la reacción que se lleva a cabo consiste en hacer reaccionar el aceite vegetal con metanol lo que genera un éster y glicerina. Si se emplea el metanol como alcohol, el derivado será el éster metílico y, si es el etanol, será el éster etílico. La reacción se lleva a cabo en presencia de un catalizador. En la reacción se parte de un aceite que tiene un peso molecular de unos 700 a 900 y se fabrican tres moléculas más ligeras de pesos moleculares entre 230 a 300
| aceite vegetal | + | metanol | ® | ésteres | + | glicerina |
| 1 tonelada | 0.1 t. | 1 t. | 0.1 t. |
donde los ésteres producidos presentan cadenas de hidrocarburos que oscilan entre 13 y 19 átomos de carbono si se emplea metanol y de 14 a 20 átomos en los ésteres de etanol. El producto tiene propiedades muy parecidas al diesel. Otras fuentes pueden ser la grasa animal y el aceite vegetal gastado. Las ventajas del biodiesel son que no tiene azufre, o aromáticos, y que su molécula contiene oxígeno. Además es un producto renovable. Las pruebas aún no son concluyentes y es necesaria más investigación. Una estrategia inicial ha sido añadir al diesel entre 10 y 40% de biodiesel y seguir su comportamiento.
• Si no hay diesel, use anestésicos. Si bien aún está en etapa de
experimentación, se podrá optar en el futuro por el dimetil-éter (DME)
el mismo que empleó el dentista William Morton para extraer muelas. La idea fue de Charles Jackson quien se autoanestesió e instruyó a Morton en el mejor método de administrarlo. El éter ha sido propuesto como sustituto del diesel. Comparemos algunas de sus propiedades con las del diesel, en la siguiente tabla.

El carburante tiene sus pros y contras. A favor está que no genera humo. También disminuye el ruido. Las emisiones de sustancias tóxicas quedarán dentro de los límites de los criterios internacionales. Los problemas aún no resueltos surgen de la necesidad de diseñar nuevos sistemas de inyectores pues con los actuales se dan fugas, aunque el DME puede ser transportado y guardado como líquido igual que el gas licuado. Además, el DME como otros carburantes alternos tiene un contenido energético en volumen menor al diesel o la gasolina. De lo anterior se desprende que se necesitan mayores volúmenes para dar al consumidor el mismo rango de operación. Comparado con la gasolina el volumen de DME requerido para viajar una cierta distancia es muy similar.
• La combustión perpetua. Hemos llegado al punto en el cual la obsesión
consiste en realizar la combustión perfecta, que de todas maneras genera bióxido
de carbono y provoca daños a nuestro planeta que serán motivo de las reflexiones
del próximo capítulo. Antes de seguir el inflamable tema de la gasolina, contaremos
el cuento de las lámparas de combustión perpetuas como lo narra A. Ord-Hume
en su libro acerca del movimiento perpetuo:
Como sabemos el proceso de combustión es una forma de consumir energía
y una lámpara perpetua tendría la capacidad de crear más combustible que el
que consume, a menos que tuviera una fuente prodigiosa. Las lámparas y la combustión
que generan han creado tanta mística, magia y mito que no es sorprendente encontrarlas
en los ritos sepulcrales de los antiguos, donde vemos en muchos monumentos lámparas
que permanentemente están encendidas. Una primera referencia a las lámparas
se encuentra en Éxodo, 27, donde se dan detalles de lo que los israelitas debían
hacer para construir el tabernáculo: "Y comandarás a los hijos de Israel que
traigan el aceite puro de oliva para alumbrar, para provocar que la lámpara
se queme permanentemente". Son numerosos los relatos de lámparas encontradas
en tumbas que ardían al penetrar en ellas. En la Tumba de Pallas asesinado por
Turnus en la guerra de Troya (1184 a.C.) se encontró una lámpara ardiente en
el año de Nuestro Señor 1401. Si hacemos números, se trata de una lámpara que
ardió 2 600 años. Una explicación es que resulta bien conocido que las sustancias
fosforescentes son producto de la descomposición de los animales y vegetales
y su existencia pudo dar la impresión, al abrir la tumba, de que la lámpara
ardía. Nadie explica, aceptando la existencia de un carburante inextinguible,
de dónde salía el aire necesario para la combustión. Aunque pudiéramos pensar
el fósforo y sus sales como una explicación (elemento descubierto en 1669 por
Brandt en Hamburgo) de la luminosidad de algunos materiales, no se puede uno
tragar la píldora de que hayan estado encendidas por cientos o miles de años,
sobre todo si su explicación es tan absurda como las dadas para las máquinas
de movimiento perpetuo inexistentes, que violan los principios fundamentales
de las leyes de la termodinámica. A falta de una tecnología disponible que incluyera
la refracción de la luz por lentes o fibras ópticas o la degradación radiactiva,
debemos concluir a nuestro pesar de que están basadas en observaciones erróneas.
Otra explicación proviene del informe acerca de una lámpara eterna encontrada
en la isla de Nesis, en la bahía de Nápoles, que según Luciano, el aire de la
isla olía horrible y era peligroso. ¿Era este gas de origen volcánico y por
ende sulfuroso o bien podría ser también metano y la fisura del gas natural
mantenía encendida la lámpara? Si uno considera las enormes reservas de gas
natural del Mar del Norte, una pequeña fisura que alimentara el reservorio de
la lámpara podría mantenerla viva durante más de un millón de años.
Recapitulemos lo hasta aquí dicho. En los próximos 40 años la energía será uno de los problemas calientes de la sociedad a medida que los carburantes fósiles disminuyan. Nuevas oportunidades de investigación y desarrollo tecnológico se vislumbran para aplicar la química a la recuperación mejorada del crudo, a su más eficiente explotación, a desarrollar otros carburantes fósiles y crear tecnologías que promuevan la conservación o el incremento de la eficiencia de los combustibles. Pero a largo plazo, la única tecnología capaz de sustituir a los carburantes fósiles es la energía nuclear. Si ésta vuelve a ser aceptada como fuente de poder, el reemplazo de hidrocarburos líquidos por la electricidad como fuente energética creará miles de oportunidades para desarrollar mejores baterías y materiales eléctricamente funcionales. La fabricación de pequeños reactores nucleares seguros puede hacer a la electroquímica y la química de altas temperaturas atractiva para nuevos procesos.
LA REFORMULACIÓN DE LAS GASOLINAS
Para ser sinceros, en las últimas tres décadas los esfuerzos por controlar el daño ambiental que causan los automóviles y la gasolina se han convertido en algo sumamente complejo y no todo lo exitoso que se desea. Entre 1982 y 1991 sólo disminuyeron 8% las concentraciones de ozono —un contaminante peligroso que no es emitido directamente por los autos— a pesar de los programas de control. La reformulación a gran escala para disminuir las emisiones tóxicas de los automóviles fue propuesta por la General Motors en 1972, sin embargo la crisis del petróleo de 1973 detuvo todo intento de modificar la composición de la gasolina. Curiosamente la combinación de la falta de gasolina por el embargo, aunada a la disminución paulatina del contenido de plomo, hizo que se olvidara el problema del medio ambiente que creaba la gasolina y creó más problemas ambientales de los que se pretendía superar.
Así, con el fin de aumentar la cantidad de gasolina se construyeron más plantas de desintegración catalítica que generaron mayor cantidad de olefinas ligeras, extremadamente dañinas a la atmósfera. Esto trajo como consecuencia mayor producción de butanos lo que permitió a los productores incrementar su rendimiento en gasolina pero la presión de vapor se elevó, lo que también es nocivo.
La producción de aromáticos a partir del proceso de reformación de nafta generó mayor contenido de productos aromáticos que compensaban el octanaje perdido por la eliminación de plomo. Sabemos hoy que los aromáticos son más difíciles de quemar.
Esfuerzos adicionales se hicieron en los automóviles para controlar sus emisiones mediante dispositivos simples, como la ventilación de las válvulas, los convertidores catalíticos, la recirculación de los gases del escape y aparatos que impiden la evaporación de la gasolina. Siguió el empleo de sistemas de control computarizado para mantener relaciones aire/gasolina constantes, reducir el tamaño de los autos, disminuir su cilindraje. Se han logrado reducciones importantes de emisiones nocivas, pero el lector se dará cuenta que las enumeradas se centran en mejorar la tecnología de los vehículos más que en producir gasolinas que contaminen menos. Diremos que las baterías se han encaminado a la adición de aditivos, disminución de la volatilidad, disminución del contenido de azufre, de aromáticos y de olefinas en la fórmula, que se iniciaron con la eliminación de plomo en la gasolina.
Este programa es producto de la presión de los gobiernos y grupos ambientalistas, aunado a que las grandes empresas petroleras se han visto "amenazadas" por la competencia de carburantes alternativos como los que vimos en este capítulo, Esto ha impulsado el desarrollo de una nueva generación de gasolina, mejor conocido como programa de "reformulación de gasolina".
Las metas fundamentales son disminuir los contaminantes nocivos, la evaporación de la gasolina y no generar compuestos que reaccionan en la atmósfera creando productos nocivos. Los componentes hidrocarburos de la gasolina reformulada son muy diferentes de la fracción de hidrocarburos presente en las gasolinas oxigenadas.
En primer término, se ha librado una batalla en favor de los carburantes "renovables" aquellos cuyo carbón proviene de biomasa reciente y por tanto no aumenta las emisiones de bióxido de carbono. La batalla se ha dado entre los que apoyan el etanol y el EETB de origen vegetal contra los que producen el metanol y el EMTB, petroquímicos provenientes de la transformación de componentes del petróleo.
El programa de reformulación de gasolina en EUA fue delineado en 1990 con el "Acta del Aire Limpio" cuyas metas eran disminuir el ozono mediante el empleo de gasolina menos contaminante. El programa que entraría en vigor en 1995, insistía en que en las áreas más contaminadas se debía usar por fuerza gasolina que abatiera los contaminantes sobre todo el ozono y el monóxido de carbono. También a partir de 1990 se prohibió en EUA la fabricación y venta de gasolina con plomo, se estableció un mínimo de oxígeno de 2% en peso, un contenido de benceno no mayor de 1 % en volumen y un máximo de 25% en volumen de compuestos aromáticos.
Un punto importante es que la presión de vapor, es decir, lo que mide la volatilidad de la gasolina, resulta también menor, lo que significa que se adicionan menos componentes volátiles ligeros introduciéndose un programa de dos fases: en verano y en invierno.
En 1990 el valor mínimo era de 8.7 libras/pulgada² y el máximo de 11.5. En 1995 entra en vigor un mínimo de 7.2 y un máximo de 8.1, pero en California son más estrictos y para 1996 el valor aceptado es de 7, valor del cual los fabricantes de automóviles se quejan pues dicen que puede causar problemas de arranque y de manejo del auto en donde el invierno es frío.
En 1992 se delimitaron 39 zonas que excedían los límites del monóxido de carbono y que debían utilizar gasolina con 2.7% en peso de oxígeno. En 1993 se vuelve a bajar el contenido de oxígeno en algunas ciudades a 2% en peso de oxígeno a partir de 1995. Este año entró en vigor un modelo de mezcla de gasolina en refinería y se determinaron límites al contenido de oxígeno, benceno y aromáticos en la gasolina. Tomando como año de referencia 1990, se exigió que en 1995 debería reducirse en 15% la emisión de compuestos volátiles y en 17% las emisiones tóxicas. En 1998 las refinerías utilizarán un modelo provisto por la Agencia de Protección Ambiental para formular la gasolina. El modelo matemático incluye datos como contenido de azufre, tipo de oxigenante y contenido de olefinas y con él se puede predecir las emisiones a partir de la formulación mediante una serie de ecuaciones que definen la relación entre varias características físicas y químicas de la gasolina y el efecto en la emisión que tendrá el vehículo. Para el año 2000 la fase segunda del programa exige reducciones de hasta 29% para los compuestos volátiles, 22% en las emisiones tóxicas y 5 a 7% en los compuestos de nitrógeno tóxicos.
En México la norma Nom-086 fue publicada por el Instituto Nacional de Ecología en diciembre de 1994 y establece la calidad de los combustibles fósiles líquidos y gaseosos. Hay en el mercado dos tipos de gasolina oxigenada que contienen un mínimo de 1 % en peso de oxígeno y un máximo de 2%. Se obliga asimismo al consumo de gasolinas oxigenadas en la zona metropolitana de la ciudad de México, lo que se extenderá en 1998 a las zonas metropolitanas de Guadalajara y Monterrey. El gobierno ha puesto en marcha un programa para mejorar la calidad del aire en el valle de México que se extiende hasta el año 2000, y dos de las estrategias ahí marcadas atañen a los energéticos. En primer término se dice que se revisará progresivamente la legislación de gasolina y diesel en forma permanente hasta finales del siglo pero de inmediato —segundo semestre de 1996— se deberán reducir los componentes tóxicos y reactivos de la gasolina para lo cual:
• los aromáticos pasan de 30 % en volumen del total de la gasolina a 25 %
• las olefinas bajan de 15 a 10 %
• el benceno de 2 % disminuye a 1 %
• la presión de vapor baja de 8.5 a 7.8
Hay que hacer notar que como en los países que tienen programas de reformulación, los aromáticos disminuyen y también el benceno aromático que se obtiene de las mismas fracciones del petróleo. Se preguntará cómo eliminar el benceno del resto de los aromáticos en una corriente de refinería que contiene miles de ellos. Todo es asunto de ciencia y dinero para realizarlo. Hemos dicho que la principal fuente de aromáticos es el proceso de reformación, que toma una parafina lineal y la cierra como anillo. Quedan dos opciones, eliminar la corriente de parafinas lineales de seis carbonos (por destilación) para impedir que se forme benceno, o transformar el benceno formado después de la reformación, por ejemplo realizando reacciones de alquilación, con lo cual sucede lo siguiente, en el caso del etileno:
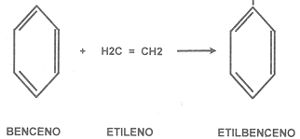
benceno + etileno --->etilbenceno.
Existen por tanto dos fuentes principales de emisiones de un vehículo de motor, las que salen por el escape y las evaporativas. Veamos primero las segundas.
¿CÓMO DISMINUIR LA EVAPORACIÓN DE LA GASOLINA?
Se da un creciente interés en disminuir las emisiones y entre ellas cuentan mucho las generadas por la evaporación durante la distribución, llenado de vehículos en las gasolinerías, las que se evaporan y las que se fugan del automóvil. La manera de impedirlo es reduciendo la presión de vapor Reid de la gasolina. Estudiosos europeos han calculado recientemente que 40% de los compuestos volátiles orgánicos que produce el hombre provienen de los autos: las emisiones evaporativas ocupan el tercer lugar después de la evaporación de los diferentes solventes y de las emisiones del escape de los automóviles. Son motivo de preocupación la gran cantidad de vapores de gasolina a que continuamente quedan expuestos los trabajadores de las estaciones de servicio, y en muchas partes del mundo, incluyendo México, se legisla para que cuenten con sistemas de recuperación de vapores. Ésta debe contemplar las terminales de almacenamiento y distribución de combustibles durante la transferencia del combustible del autotanque al tanque de almacenamiento de la estación de servicio y durante el despacho cuando los vapores que emite el dispensario son aspirados por bombas y reinyectados nuevamente a los tanques de almacenamiento o, en su defecto, son incinerados lo más eficientemente posible. En lo que concierne al automóvil se le han instalado recipientes con carbón que absorbe los puestos orgánicos, subsecuentemente los arroja para ser inyectados al resto del carburante. Allí se quemarán durante la operación normal cuando el auto alcanza cierta temperatura. Deben tomarse en consideración dos tipos de evaporación en los automóviles: la estática cuando se halla estacionado y que depende de la temperatura ambiente y las pérdidas del tanque cuando el auto está en marcha. En este caso se ha determinado que la temperatura del tanque puede aumentar hasta 14°C sobre la temperatura ambiente. En el caso del diesel, constituido por moléculas menos volátiles, el problema de evaporación es muy limitado. En la figura 31 se esquematiza el sistema de control de la evaporación de carburante mediante carbón activado.
¿Y A TODO ESTO, CÓMO SE MIDE EL DESEMPEÑO DE LA GASOLINA ?
Con el fin de evaluar en forma cuantitativa las emisiones producidas por los vehículos automotores, se han desarrollado procedimientos que tratan de reproducir las condiciones reales de operación en el laboratorio. Las emisiones gaseosas reglamentadas en los automotores son: hidrocarburos no quemados, monóxido de carbono y óxidos de nitrógeno. La prueba DGN-AA-II-1980 es un procedimiento federal de prueba empleado para certificar los automóviles nuevos a partir de los modelos de 1975. Así, los fabricantes de automóviles deben entregar al Gobierno Federal una prueba certificada de la cantidad de contaminantes que emiten sus autos. Esto no quiere decir que todos los automóviles nuevos pasan la prueba, sino que cada año deben hacerlo sobre todo si se trata de modelos nuevos o modificaciones a los existentes. La prueba proporciona la caracterización más representativa disponible de emisiones de escape y economía urbana de combustible. Se realiza en una celda de ambiente controlado donde la temperatura y otras condiciones pueden mantenerse dentro de límites específicos. Durante este proceso el vehículo se conduce en un dinamómetro de chasís con un programa de manejo de paro y marcha a una velocidad de aproximadamente 35 km/h. Mediante el uso de volantes de inercia y un freno de agua, se reproducen las cargas que el vehículo experimentaría en el camino. Los gases de escape del vehículo se recolectan, diluyen y se mezclan completamente con el aire filtrado circundante a un flujo de volumen constante conocido. Las emisiones recolectadas incluyen un arranque en frío del motor y uno en caliente una vez que el auto ha recorrido 12 km y descansado 10 minutos. El dinamómetro de chasís reproduce la inercia del vehículo con volantes, y la carga del camino con un freno de agua. Para cada clase de peso de inercia se especifica una carga de camino que toma en consideración la resistencia aerodinámica promedio del vehículo. Un día antes del arranque en frío programado, el vehículo debe permanecer en reposo cuando menos 12 horas a temperatura entre 20 y 30°C. En el momento de la prueba el auto se empuja sobre el dinamómetro sin arrancar el motor y se conecta el sistema de correlación de emisiones al tubo de escape, un ventilador de enfriamiento funciona de acuerdo con el motor abierto. El sistema de muestreo de emisiones y el vehículo de prueba arrancan simultáneamente, de modo que las emisiones se recolecten durante el arranque del motor, el conductor sigue un programa de manejo controlado, el Programa Urbano de Manejo en Dinamómetro, creado para representar el manejo urbano en promedio. El ciclo de manejo dura 1 374 segundos y cubre una distancia de 12 km. Las emisiones de escape que se miden cubren tres regímenes de operación del motor. Las de escape, en los primeros 505 segundos de la prueba, son las emisiones transitorias frías, cuando el vehículo se calienta gradualmente a medida que se maneja en el ciclo. Las emisiones mostrarán entonces los efectos de operación de arranque en frío y las características del calentamiento del vehículo. Cuando pasan los 869 segundos restantes del ciclo, se considera que ya se ha "calentado" el auto y las emisiones son las llamadas "estabilizadas". El regimen final de la prueba tras la saturación en caliente es la sección "no transitoria" y muestra los efectos del arranque en caliente. Las emisiones de cada una de las pruebas se recogen en bolsas separadas, para analizar cuantitativamente su composición. Finalmente se cuenta la masa emitida de cada contaminante en gramos por kilómetro recorrido. La economía del combustible se mide en un dinamómetro de chasís que reproduce las velocidades y cargas típicas del manejo urbano y en carretera. La economía de combustible se calcula a partir de los datos de las emisiones de descarga, en el caso de carretera la velocidad promedio es de 78 km/h.
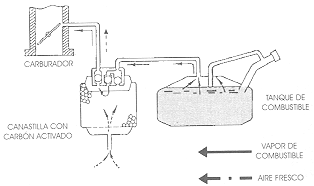
Figura 31. Esquema de un sistema a base de carbón para evitar la emisión de los hidrocarburos que se evaporan de la gasolina.
En la figura 32 mostramos un esquema general del equipo de prueba de emisiones en automóviles.
¿CUÁL ES EL FUTURO DEL CRUDO Y LOS CARBURANTES ALTERNOS?
Hacer diagnósticos de lo que va a acontecer, es arriesgado, pero debemos actuar antes que el futuro nos alcance. Lo que acontezca con los crudos repercutirá en las gasolinas y los carburantes alternos. Existe un límite a la cantidad de crudo que podemos extraer de la tierra, las reservas disminuyen y los descubrimientos de yacimientos gigantescos se hacen cada vez menos frecuentes. Podría ocurrir que el metanol aumentara su cobertura mundial como carburante alterno por las ventajas que ofrece de no afectar la calidad del aire. Se avizora que nos veremos forzados, México en particular, a emplear crudos más pesados, más baratos que los ligeros pero que requieren de procesos de desintegración catalítica más profunda para obtener gasolina y diesel que desde luego no tendrán la misma composición química que los actuales. Habrá que adaptar estos productos a que cumplan las especificaciones precisas, por ejemplo al desintegrar más las moléculas la estabilidad hacia la oxidación se ve reducida por la presencia de más olefinas y será necesario añadir nuevos aditivos antioxidantes. Si los precios del crudo suben, la economía del combustible pasará a primer plano y es probable el uso de vehículos a diesel, aunque en los autos de gasolina que emplean bujías todavía queda mucho por hacer: incrementar el cociente de compresión, esto requerirá mayor octanaje y dispositivos que protejan la máquina para que no se dañe por la ignición.
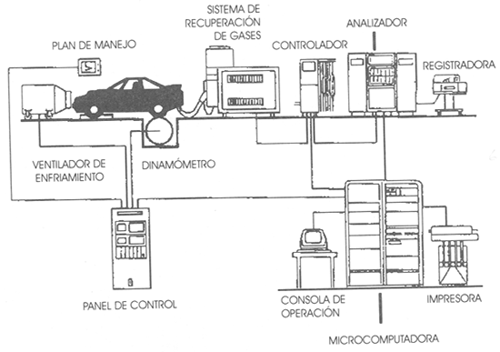
Figura 32. Esquema de un sistema de evaluación de las emisiones de automóviles.
El uso de carburantes alternos sin embargo se irá incrementando. En términos generales podemos afirmar que se desea que la transición a los nuevos carburantes se realice sin contratiempos. Además, la calidad del aire cuenta mucho ya que varios carburantes alternos no generan tantos productos nocivos.
Una alternativa, conocida desde 1925, es fabricar hidrocarburos que sirvan sintéticamente corno carburantes. ¿Cómo? Empleando el proceso de síntesis de Fischer-Tropsch que parte del monóxido de carbono, CO, y el hidrógeno. La mezcla de monóxido de carbono e hidrógeno se suele llamar "gas de síntesis" y se puede obtener de diversas fuentes que incluyen el carbono y el gas natural. La reacción se realiza en presencia de un catalizador y los productos de reacción son hidrocarburos que varían en función de las condiciones de reacción, destilados intermedios, querosinas, gasóleos, que pueden ser posteriormente procesados por los métodos disponibles en una refinería.
![[Inicio]](../img/begin.gif)
![[Anterior]](../img/prevsec.gif)

![[Siguiente]](../img/nextsec.gif)