Corresponde a la sesi�n de GA 8.4 A VECES ES CURVIL�NEA
La materia est� constituida por �tomos, que a su vez forman mol�culas. Las mol�culas constituyen la m�nima parte en la que se puede fragmentar una sustancia para que conserve sus propiedades. Por ejemplo, el agua es una sustancia formada por mol�culas que est�n constituidas por dos �tomos de hidr�geno y uno de ox�geno.
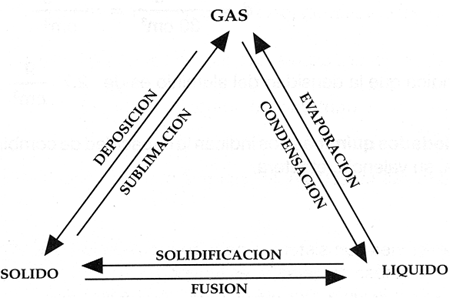
Todas las mol�culas presentan una fuerza de atracci�n llamada cohesi�n, adem�s entre ellas existe movilidad y vibraci�n, gracias a la energ�a cin�tica que poseen. Todo lo anterior permite que la materia se pueda presentar en estado s�lido, l�quido y gaseoso.
En un s�lido las mol�culas tienen mucha cohesi�n y su �nico movimiento es el de vibraci�n. Los s�lidos tienen formas y volumen definidos.
Las mol�culas de los l�quidos presentan menor cohesi�n y mayor movilidad y vibraci�n que las de los s�lidos. Los l�quidos tienen volumen definido pero adquieren la forma del recipiente que los contiene.
Los gases presentan mol�culas con mayor movilidad y por lo tanto la cohesi�n es casi nula. Por esta raz�n los gases no tienen volumen ni forma propia y adquieren la forma y volumen del recipiente que los contiene.
Cada uno de los tres estados de la materia puede pasar a otro, gracias a cambios en la temperatura y presi�n, como se indica en el siguiente esquema.
La materia tambi�n puede encontrarse como mezcla, compuesto o elemento. Una mezcla se forma cuando se combinan dos o m�s sustancias que no est�n unidas por alguna reacci�n qu�mica, sino que, la uni�n de dichas sustancias se da en forma f�sica y la separaci�n de sus componentes se hace tambi�n por procedimientos f�sicos como la filtraci�n. Algunos ejemplos de mezcla son la leche y el agua con az�car.
Para su estudio las mezclas se dividen en homog�neas y heterog�neas.
Las mezclas homog�neas tienen caracter�sticas y propiedades iguales en cualquiera de sus partes, es decir, son uniformes. Por ejemplo, agua con az�car.
Por el contrario las mezclas heterog�neas no presentan una dispersi�n uniforme de sus componentes y por lo tanto cada punto tiene caracter�sticas diferentes.
Muchas de las mezclas homog�neas son llamadas soluciones. �stas se componen de dos partes, una conocida como solvente, que se encuentra en mayor cantidad y en donde se dispersa el otro componente denominado soluto.
Dependiendo de la cantidad de soluto las soluciones pueden ser diluidas, concentradas, saturadas y sobresaturadas. Por otra parte, la forma de expresar las concentraciones puede ser en tanto por ciento, molar, normal y en fracci�n mol.
Uno de los m�todos m�s simples es el de tanto por ciento, el cual est� basado en el peso (p) o volumen (v) y permite la obtenci�n de porcentajes en peso-peso (p/p), peso-volumen (p/v) y volumen-volumen (v/v).
Este m�todo en general expresa la concentraci�n de las soluciones como sigue:
Concentraci�n = cantidad de soluto/cantidad de soluci�n (solvente + soluto) x 100.
Por su parte, las mezclas heterog�neas pueden constituir suspensiones y coloides.
Las suspensiones son sistemas heterog�neos en los que el tama�o de las Part�culas de la fase dispersada es mayor de 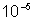 cm , por lo que se pueden observar a simple vista. Por ejemplo, el jugo de jitomate.
cm , por lo que se pueden observar a simple vista. Por ejemplo, el jugo de jitomate.
Los coloides son sistemas polif�sicos -en un sistema cada parte homog�nea es una fase- dispersados, en donde las part�culas de la fase dispersada tienen tama�os entre 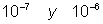 cm, son m�s peque�as que las de suspensiones, pero mayores que las de soluciones. Los coloides pueden ser soles (�xido f�rrico), geles (malvavisco y jalea), emulsiones (mayonesa y vinagre) y aerosoles (roc�o y polvo).
cm, son m�s peque�as que las de suspensiones, pero mayores que las de soluciones. Los coloides pueden ser soles (�xido f�rrico), geles (malvavisco y jalea), emulsiones (mayonesa y vinagre) y aerosoles (roc�o y polvo).
Cabe se�alar que las soluciones, suspensiones y coloides son dispersiones. En una dispersi�n la fase que se encuentra en mayor cantidad se denomina dispersante, mientras la que se encuentra en menor cantidad se conoce como dispersada.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)