8. Periodos y familias de la Tabla Peri�dica
Corresponde a la sesi�n de GA 8.8 �BRINCA LA TABLITA...!
Los elementos qu�micos se han agrupado de acuerdo con sus caracter�sticas. En 1869, el qu�mico ruso Dimitri Mendeleiev fue el primero que clasific� a los elementos clara y concisamente seg�n sus semejanzas; su agrupaci�n estuvo basada gran parte en propiedades f�sicas peri�dicas y ,en semejanzas qu�micas, como la tendencia a combinarse con otros elementos y el tipo de compuestos formados.
El cient�fico ruso list� los 63 elementos conocidos en su tiempo, comenzando con el de menor peso a masa at�mica - n�mero total de protones y de neutrones en el n�cleo - y finalizando con el de mayor masa at�mica.
Anot� los elementos de izquierda a derecha dentro de una "Tabla peri�dica" que tiene columnas verticales llamadas grupos o familias (del 0 al VII) y renglones horizontales llamados periodos (del 1 al 7).
Actualmente se conocen 108 elementos de los cuales 91 son naturales y 17 son artificiales. En la tabla peri�dica est�n ordenados de acuerdo con el n�mero at�mico, dicho n�mero corresponde al n�mero de protones en el n�cleo de cada �tomo. Por ejemplo, el hidr�geno tiene un n�mero at�mico de 1 debido a que este elemento tiene un prot�n en su n�cleo.
El n�mero de electrones en un �tomo no cambia a menos que se combine y entonces el �tomo ya no es neutro, el n�mero de neutrones de un �tomo puede variar seguir� constituyendo el mismo elemento. Pero si el n�mero de protones cambia se convertir� en otro elemento. Los �tomos se llaman is�topos.
Los elementos en los periodos est�n acomodados en forma horizontal y en orden creciente de acuerdo con el n�mero at�mico, por ejemplo: el primer periodo est� formado por dos elementos: el hidr�geno (H), que tiene n�mero at�mico 1 y el helio (He), que posee n�mero at�mico 2. El segundo contiene ocho elementos; inicia con sodio (Na) y finaliza con arg�n (Ar); los n�meros at�micos van del 11 al l8.
Los elementos de un mismo periodo tienen igual nivel de energ�a (n) cada nivel se caracteriza por tener un n�mero m�ximo de electrones que se determina con la f�rmula 2(n)�, esta f�rmula s�lo se aplica a los primeros cuatro per�odos.
En la Tabla Peri�dica el t�rmino "familia o grupo" es aplicado a los elementos de una columna. Existen diecis�is familias; de �stas, las primeras ocho se presentan como sigue: IA, IIA, IIIA, IVA, VA, VIA, VIIA y la octava se representa con el cero (o) u VIIIA. Ver tabla peri�dica.
Las otras ocho familias se representan como sigue IV, IIB, IIIB, IVB, VB, VIA, VIIB y VIIIB. Ver tabla peri�dica.
Los elementos de una familia son similares en propiedades f�sicas y qu�micas. De acuerdo con estas propiedades, las familias reciben un nombre particular, o bien, el nombre de uno de los elementos que la constituyen.
De esta manera la familia IA recibe el nombre de "metales alcalinos", la IIA de Metales alcalinot�rreos, IIIA del Aluminio, la IVA del carbono, la VA del f�sforo, la IVA del azufre, la VIIA de los hal�genos (formadores de sales) y la 0 u VIIIA de los gases raros, inertes o nobles.
La IB del cobre o de los metales preciosos, la IIB del zinc, la IIIB, IVB, VB, VIB, VIIB y VIIIB son metales de transici�n.
Los electrones que cada �tomo posee en su �ltimo nivel de energ�a son los que generalmente forman los enlaces qu�micos, dichos electrones reciben el nombre de electrones de valencia, y �sta depende del n�mero de electrones que pueda perder o ganar, en su �ltimo nivel de energ�a, si se trata de elementos pertenecientes a los grupos A, durante una reacci�n qu�mica.
Cuando un elemento en su mismo estado f�sico se presenta en dos o m�s formas f�sica-estables, �stas se denominan formas alotr�picas del elemento, por ejemplo, el ozono ( ) es un gas que espont�neamente se convierte en ox�geno molecular (
) es un gas que espont�neamente se convierte en ox�geno molecular (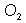 ), pero ambos existen en forma natural, al igual sucede con el f�sforo blanco (PI y PII) y el f�sforo rojo (PIII), m�s estable y menos venenoso que el f�sforo blanco. O bien las formas alotr�picas del carbono: grafito y diamante.
), pero ambos existen en forma natural, al igual sucede con el f�sforo blanco (PI y PII) y el f�sforo rojo (PIII), m�s estable y menos venenoso que el f�sforo blanco. O bien las formas alotr�picas del carbono: grafito y diamante.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)
Conceptos Básicos
 ) es un gas que espont�neamente se convierte en ox�geno molecular (
) es un gas que espont�neamente se convierte en ox�geno molecular (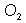 ), pero ambos existen en forma natural, al igual sucede con el f�sforo blanco (PI y PII) y el f�sforo rojo (PIII), m�s estable y menos venenoso que el f�sforo blanco. O bien las formas alotr�picas del carbono: grafito y diamante.
), pero ambos existen en forma natural, al igual sucede con el f�sforo blanco (PI y PII) y el f�sforo rojo (PIII), m�s estable y menos venenoso que el f�sforo blanco. O bien las formas alotr�picas del carbono: grafito y diamante.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)