 , esto indica que el di�xido de azufre tiene en su mol�cula un �tomo de azufre y dos �tomos de oxigeno.
, esto indica que el di�xido de azufre tiene en su mol�cula un �tomo de azufre y dos �tomos de oxigeno.
Corresponde a la sesi�n de GA 8.7 �FORMULANDO UN MODELITO!
Las f�rmulas qu�micas est�n constituidas por s�mbolos qu�micos que nos indican los elementos que forman un compuesto; indican tambi�n el n�mero de �tomos que aporta cada elemento contiene, la f�rmula y por lo tanto el compuesto al adicionar un sub�ndice, o sea, un n�mero peque�o que se coloca abajo y a la derecha de cada elemento que as� lo requiera.
Ejemplo,  , esto indica que el di�xido de azufre tiene en su mol�cula un �tomo de azufre y dos �tomos de oxigeno.
, esto indica que el di�xido de azufre tiene en su mol�cula un �tomo de azufre y dos �tomos de oxigeno.
Si a la f�rmula se le antepone un n�mero, por ejemplo 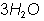 , significa que en la reacci�n hay 3 mol�culas de agua y este n�mero se llama coeficiente, si s�lo tiene un �tomo o una mol�cula no se le pone n�mero.
, significa que en la reacci�n hay 3 mol�culas de agua y este n�mero se llama coeficiente, si s�lo tiene un �tomo o una mol�cula no se le pone n�mero.
Existen diferentes tipos de f�rmulas: f�rmulas moleculares, desarrolladas, semidesarrolladas y condensadas.
Son las que indican los n�meros y tipos de �tomos en una mol�cula, por ejemplo, el agua es 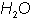 y en el alcohol et�lico, alcohol de ca�a o etanol
y en el alcohol et�lico, alcohol de ca�a o etanol 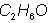 .
.
F�rmulas desarrolladas o estructurales
Indican la cantidad y la forma de c�mo los �tomos est�n unidos en una mol�cula, por ejemplo, en el agua, en el per�xido de hidr�geno y en el alcohol de ca�a o alcohol et�lico.
F�rmulas semidesarrolladas o f�rmulas estructurales condensadas
Indican solamente las uniones entre los �tomos principales de la mol�cula, por ejemplo en el caso del etanol o alcohol et�lico se tiene la siguiente f�rmula:
Al conocerse y difundirse la existencia de los �tomos varios cient�ficos investigaron sobre su estructura y funcionamiento.
Uno de ellos fue el dan�s Niels Bohr, que en 1913 propuso que los �tomos presentaban siete �rbitas circulares a las que denomin� �rbitas u orbitales cu�nticos o de energ�a, los enumer� del uno al siete, siendo la �rbita uno la m�s cercana al n�cleo; la dos, la siguiente y as� sucesivamente.
Las �rbitas se denominaron n = 1 o K, n = 2 o L, n = 3 o M, n = 4 o N
n = 5 u O, n = 6 o P y n = 7 o Q.
El modelo de Bohr explica el comportamiento del �tomo de hidr�geno, pero presenta dificultades para explicar los �tomos de mayor tama�o.
A cada nivel energ�tico u orbital le corresponde cierta cantidad de energ�a y un n�mero m�ximo de electrones; �ste puede calcularse mediante una sencilla expresi�n matem�tica que dice que el n�mero m�ximo de electrones es igual a 2n� donde: n= n�mero de la �rbita (n�mero cu�ntico principal). Ejemplo: el �tomo de aluminio tiene 13 electrones, por lo tanto, le corresponden al primer nivel dos electrones, al segundo, ocho y los que restan al tercer nivel.
Porque si n = 1, 2(1)� = 2 electrones y 2(2)� = 8 electrones y as� sucesivamente. No obstante, esta f�rmula s�lo se aplica a los cuatro primeros periodos, ya que no existe en la naturaleza un �tomo que tenga en un nivel de energ�a m�s de 32 electrones.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)