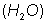 ) .
) .
Corresponde a la sesi�n de GA 8.12 SE JUNTAN Y SE SEPARAN
En los fen�menos qu�micos, las sustancias sufren cambios y transformaciones, reaccionando entre s� y originando otras con caracter�sticas distintas, casi siempre con manifestaciones de energ�a, es decir, se forman compuestos.
Para normar el proceso de formaci�n de compuestos es necesario aplicar las siguientes leyes:
La Ley de la conservaci�n de la masa o de Lavoisier, que dice: "La masa de las sustancias reaccionantes es igual a la masa de los productos", por ejemplo: si las reaccionantes tienen una masa de 10g, el producto deber� ser 10g.
La Ley de Proust o de las proporciones definidas, dice: "Cuando dos o m�s elementos se combinan para formar un determinado compuesto, lo hacen siempre en proporci�n fija y definida", por ejemplo: el ox�geno siempre requiere 2 �tomos de hidr�geno para formar agua (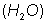 ) .
) .
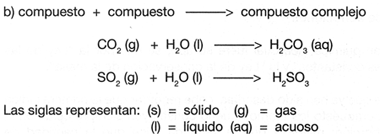
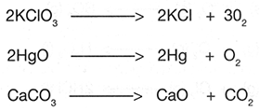
Tipos de reacciones para la formaci�n de compuestos:
Dos elementos o compuestos se unen entre si para formar uno solo.
Se lleva a cabo cuando un elemento reemplaza en una mol�cula de un compuesto a otro que tiene la misma afinidad electr�nica y valencia que �l.
Este tipo de reacci�n ocurre cuando reaccionan dos compuestos y se genera un intercambio de iones entre ellos.
En estas reacciones, los compuestos se disocian por la acci�n de la energ�a (calor, electricidad, etc�tera.) en las sustancias que los constituyen.
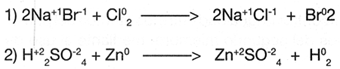
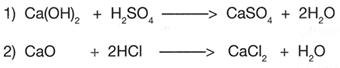
Una reacci�n qu�mica, sea cual fuere su tipo, se rige por la "Ley de las proporciones constantes" y la "Ley de la conservaci�n de la masa'.
No obstante que ya han sido descritas, cabe recordar que la primera indica que en un compuesto los �tomos que lo constituyen siempre est�n en la misma proporci�n; mientras que la segunda, dice que la cantidad de sustancias reaccionantes debe ser igual a la cantidad de productos.
Por lo tanto, para aplicar esta �ltima Ley, es necesario balancear la ecuaci�n que representa la siguiente reacci�n:
Masa total de reactivos = Masa total de productos.
Balancear una ecuaci�n es encontrar la igualdad entre los �tomos del primer miembro y los mismos �tomos del segundo miembro, mediante el uso de coeficientes.
Coeficientes son n�meros enteros que indican la cantidad de mol�culas de cada sustancia que intervienen en una reacci�n del coeficiente (uno no se escribe).
Al escribir las f�rmulas de compuestos, deber� recordarse tambi�n el equilibrio entre uni�n y cati�n.
Se puede balancear por tanteo o por �xido-reducci�n, com�nmente conocido como redox.
El balanceo por tanteo se basa en comparar el n�mero de �tomos del primer miembro con los mismos del segundo miembro e igualarlos por medio de la adici�n de coeficientes a las mol�culas que los contienen, hasta lograr que cuantitativamente los dos miembros de la ecuaci�n sean iguales y que se cumpla la Ley de la conservaci�n de la masa
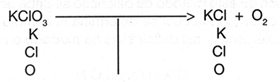
Por ejemplo, si se tiene la ecuaci�n:
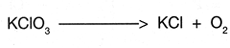
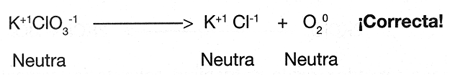
Como el n�mero de ox�genos es de 3 en los reactivos y de 2 en los productos se procede a igualarlos multiplicando al Con esto, la reacci�n se observar�a de la siguiente manera:
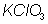 por 2 y al
por 2 y al 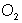 por 3 y queda as�:
por 3 y queda as�:

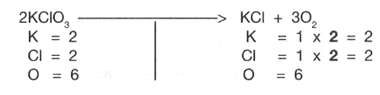

El balanceo por redox (�xido-reducci�n), consiste b�sicamente en igualar o balancear el n�mero de electrones ganados o reducci�n con el n�mero de electrones perdidos u oxidaci�n.
Para la aplicaci�n de este m�todo de balanceo se debe observar la tabla de oxidaci�n-reducci�n con la cual se determina el cambio en el n�mero de valencia de un elemento y as� definir si se ha oxidado o reducido.
El redox, es otro tipo de balanceo muy utilizado en qu�mica, sin embargo, es m�s largo y requiere de mayores conocimientos para su aplicaci�n.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)