Corresponde a la sesi�n de GA 8.11 �SE PONE BUENO EL LIGUE!
Cuando los �tomos se aproximan entre s� para formar mol�culas, se ejercen varias fuerzas entre ellos. Estas fuerzas provocan atracci�n y repulsi�n entre dichos �tomos.
En la mayor�a de los �tomos, a excepci�n de los gases nobles, la atracci�n de los electrones es mucho mayor que su repulsi�n, por lo tanto los �tomos se atraen entre s� formando enlaces qu�micos; este proceso, la electronegatividad ,es importante y se define como la capacidad relativa de un �tomo en la mol�cula para atraer electrones.
En la tabla Peri�dica la electronegatividad aumenta de izquierda a derecha a lo largo de cualquier periodo y de abajo hacia arriba en cualquier grupo.
Un enlace qu�mico es el resultado de la combinaci�n de �tomos, los cuales comparten electrones entre s�. Un �tomo cede los electrones y otro los recibe.
Los enlaces m�s comunes son los que indican a continuaci�n: i�nico, covalente, met�lico, puente de hidr�geno, no polar, polar y coordinado.
Enlace i�nico o electrovalente
Los iones se originan cuando los �tomos ganan o pierden electrones. La p�rdida de electrones da como resultado la formaci�n de iones positivos e iones negativos que son el resultado de la ganancia de electrones.
El enlace i�nico o electrovalente se origina por la transferencia de uno o m�s electrones de un �tomo o grupo de �tomos a otro. Un enlace i�nico se debe a la fuerza de atracci�n entre cationes y aniones.
Mediante los enlaces i�nicos se forman compuestos qu�micos, conocidos como i�nicos; por ejemplo, el fluoruro de litio se forma cuando un �tomo de litio le cede al fl�or el �nico electr�n que tiene en su �ltimo nivel, logr�ndose as� que los �tomos de litio y fl�or se estabilicen y se transformen en �ones; el litio, por haber perdido un electr�n, se convierte en un ani�n.
Transferencia de electrones entre �tomos met�licos y no met�licos
Casi todos los metales tienen pocos electrones (1, 2 o 3) en su �ltimo nivel de energ�a y por lo tanto tienden a perderlos. Por el contrario, la mayor�a de los no metales tienen muchos electrones en su �ltimo nivel (5, 6 o 7) por lo que tienden a ganar electrones.
Por ejemplo, cuando se combina el sodio (Na) con el cloro (Cl), los �tomos de Na pierden sus electrones, cedi�ndoselos a los �tomos de Cl form�ndose as� iones de sodio Na+ y de cloruro Cl-.
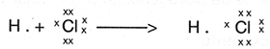
En este enlace los electrones se comparten pero no se transfieren.
�ste enlace se forma cuando se comparten pares de electrones entre los �tomos que reaccionan y forman compuestos; por ejemplo, el �cido clorh�drico (HCl), donde el hidr�geno (H) comparte su �nico electr�n con el cloro y �ste a su vez comparte uno de sus 7 electrones con el hidr�geno
Los puntos y las cruces representan electrones.
Este se forma cuando dos �tomos del mismo elemento se unen, o bien, cuando se forman mol�culas sim�tricas o cuando la electronegatividad de los dos elementos son exactamente iguales.
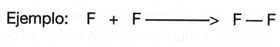
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)