
Corresponde a la sesi�n de GA 5.9 LAS R�PIDAS Y LAS LENTAS
Se sabe que la velocidad de reacci�n es la rapidez con que un reactivo se transforma o con que se forma un producto.
La velocidad de una reacci�n depende de diferentes factores, como la concentraci�n y naturaleza del reactivo, el volumen, la presi�n, la temperatura y la acci�n de los catalizadores.
En la mayor�a de las reacciones su velocidad depende directamente de la concentraci�n del reactivo, por tanto, mientras mayor sea la concentraci�n, la velocidad de reacci�n ser� m�s r�pida; lo anterior se explica mediante el modelo de colisiones, ya que al haber m�s reactivos mayor n�mero de choques moleculares se presentar�.
La velocidad es directamente proporcional a la concentraci�n de 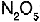 ; esto quiere decir que si se duplica la concentraci�n de los reactivos la velocidad de la reacci�n aumentar� al doble, y que si la concentraci�n se triplica, la velocidad tambi�n se triplicar�.
; esto quiere decir que si se duplica la concentraci�n de los reactivos la velocidad de la reacci�n aumentar� al doble, y que si la concentraci�n se triplica, la velocidad tambi�n se triplicar�.
La naturaleza de los reactivos es otro factor que influye en la velocidad; por ejemplo, cuando uno de los reactivos es s�lido, la velocidad de reacci�n suele incrementarse al partirlo en varios pedazos, esto se explica porque aumenta la superficie de contacto entre el s�lido y los otros reactivos y, por lo tanto, tambi�n el n�mero de colisiones.
Por otra parte, cuando los reactivos est�n en disoluci�n se encuentran en estado molecular o i�nico, y hay mayor probabilidad de que establezcan contacto directo, mientras que en estado gaseoso las mol�culas se encuentran m�s separadas y por ello la posibilidad de contacto es menor, y decrece aun m�s si el gas se encuentra libre.
Otro factor que influye en la velocidad de las reacciones es la temperatura, pues en la mayor�a de las reacciones, al aumentar 10 �C la temperatura del sistema, la velocidad se duplica, aproximadamente.
Al incrementarse la concentraci�n de reactivos la presi�n tambi�n aumenta y, por lo tanto, el n�mero de choques es mayor y la velocidad de reacci�n se acelera.
Cuando se trata de una reacci�n en donde interviene un gas, su volumen o cambio de presi�n puede ser equivalente al cambio de concentraci�n.
Al elevarse la temperatura del carbonato de calcio por encima de 825 �C se descompone en �xido de calcio y di�xido de carbono. Si se agrega 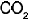 o se disminuye el volumen, la presi�n aumenta y se acelera la reacci�n de izquierda a derecha.
o se disminuye el volumen, la presi�n aumenta y se acelera la reacci�n de izquierda a derecha.
En algunas ocasiones se utilizan sustancias denominadas catalizadores, para modificar la velocidad de una reacci�n, a este fen�meno se le llama cat�lisis,
Algunos catalizadores se usan para aumentar la velocidad, estos son los catalizadores positivos. Otros son utilizados para evitar que una reacci�n se efect�e, son los catalizadores negativos, tambi�n llamados inhibidores.
Algunas caracter�sticas de los catalizadores son las siguientes:
 Se recupera al final de la reacci�n
Se recupera al final de la reacci�n
 Facilita la ejecuci�n de la reacci�n con menor energ�a de activaci�n.
Facilita la ejecuci�n de la reacci�n con menor energ�a de activaci�n.
 Es espec�fico para cada reacci�n.
Es espec�fico para cada reacci�n.
Algunos catalizadores positivos usados en el laboratorio son los siguientes: �xido de manganeso 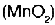 , platino (Pt), di�xido de nitr�geno
, platino (Pt), di�xido de nitr�geno 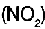 , hierro (Fe) y vanadio (V).
, hierro (Fe) y vanadio (V).
Algunos inhibidores son los siguientes: L - �cido asc�rbico, que es usado para conservar bebidas y frutas; �cido benzoico, usado en la preservaci�n de mermeladas, bebidas de fruta y papas fritas, entre otros; y los nitritos de sodio, que se utilizan para conservar embutidos, quesos y cecina.
Todos estos factores son muy importantes, ya que muchas reacciones s�lo se llevan a cabo a cierta temperatura, presi�n y volumen; adem�s, tambi�n influyen enormemente la superficie de contacto, la concentraci�n de los reactivos y los catalizadores presentes.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)