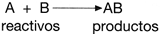
Corresponde a la sesi�n de GA 5.8 LAS FR�AS Y LAS CALIENTES
La transformaci�n de una sustancia en otra, con caracter�sticas qu�micas diferentes, ocurre mediante una o m�s reacciones qu�micas; en este fen�meno se produce un reordenamiento de los �tomos de los reactivos, que da lugar a los productos.
Una reacci�n qu�mica se representa mediante una ecuaci�n qu�mica en donde los reactivos se encuentran a la izquierda de una flecha y los productos a la derecha de la misma. La flecha indica la direcci�n del cambio y se lee como "produce" o "da lugar a", como se muestra a continuaci�n:
Muchas reacciones qu�micas son reversibles; en este caso, los productos que se forman reaccionan entre s� y generan nuevamente reactivos, es decir, la reacci�n va de izquierda a derecha y de derecha a izquierda. Este tipo de reacci�n se representa mediante dos flechas con sentidos opuestos, por ejemplo:
Las reacciones qu�micas se producen a diferentes velocidades, dependiendo de las condiciones en que se lleven a cabo; la rama de la qu�mica que estudia la velocidad de las reacciones es la cin�tica qu�mica.
El modelo de colisiones puede ser utilizado para explicar c�mo se desarrollan las reacciones qu�micas. En �l se explica que las mol�culas de los reactivos chocan entre s� y que, en algunos casos, estas colisiones son tan fuertes y con un �ngulo adecuado que los enlaces moleculares se rompen y los �tomos se reordenan, originando una sustancia nueva llamada producto.
Para que se realice una reacci�n qu�mica es necesario suministrar una energ�a m�nima de choque, la suficiente para romper enlaces y permitir la formaci�n de otros, a �sta se le conoce como energ�a de activaci�n.
La energ�a de activaci�n se puede suministrar, principalmente, mediante una chispa el�ctrica, una flama, calentamiento, frotaci�n, impacto y radiaci�n.
La velocidad de una reacci�n se define como la cantidad de productos generada por dos o m�s reactivos en un tiempo dado, y tambi�n puede describirse como la rapidez con que un reactivo se transforma en un producto.
Para calcular la velocidad de una reacci�n o la generaci�n de un producto (AB), se usa la siguiente f�rmula:
 [AB] = cambio de la concentraci�n del producto
[AB] = cambio de la concentraci�n del producto
Todas las sustancias presentan un contenido energ�tico, almacenado en sus �tomos o mol�culas, en forma de energ�a qu�mica. El contenido energ�tico de cada sustancia es distinto y depende de los �tomos y tipo de enlaces at�micos que las forman.
En una reacci�n qu�mica, el contenido energ�tico de los reactivos se distribuye entre los productos y, si existe un exceso de �ste, se libera energ�a, generalmente calor�fica.
La energ�a liberada o suministrada en una reacci�n se mide en calor�as o kilocalor�as por mol o por gramo. Una calor�a equivale a la cantidad de calor que se requiere para que un gramo de agua aumente su temperatura 1 �C, de 14 a 15 �C.
Cuando en una reacci�n qu�mica se libera calor se trata de una reacci�n exot�rmica y cuando se absorbe calor, la reacci�n recibe el nombre de endot�rmica.
El calor liberado o absorbido durante una reacci�n, que servir� para formar un compuesto a partir de los reactivos, en condiciones determinadas de presi�n y temperatura, se define como entalp�a, contenido cal�rico o calor de formaci�n, y se representa con una H.
En una reacci�n, los reactivos y productos tienen una entalp�a total definida.
El calor suministrado o liberado durante una reacci�n constituye el calor de reacci�n o diferencia de entalp�as y se representa como  H. Para calcular la diferencia de entalp�as se utiliza la siguiente f�rmula:
H. Para calcular la diferencia de entalp�as se utiliza la siguiente f�rmula:
Cuando la entalp�a de los productos es menor que la de los reactivos,  H es negativa y se trata de una reacci�n exot�rmica. En este caso se libera calor.
H es negativa y se trata de una reacci�n exot�rmica. En este caso se libera calor.
Por el contrario, si la entalp�a de los productos es mayor que la de los reactivos,  H es positiva y se trata de una reacci�n endot�rmica. En este caso se absorbe calor.
H es positiva y se trata de una reacci�n endot�rmica. En este caso se absorbe calor.
Los elementos que se encuentran en estado libre como 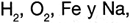 , en condiciones de 1 atm�sfera de presi�n y 25�C de temperatura tienen una entalp�a igual a cero.
, en condiciones de 1 atm�sfera de presi�n y 25�C de temperatura tienen una entalp�a igual a cero.
Un ejemplo para calcular la entalp�a de una sustancia es el siguiente:
�Cu�l ser� el  Hen la siguiente reacci�n?
Hen la siguiente reacci�n?
Por lo tanto:  H = -184.6 kcal/mol
H = -184.6 kcal/mol
Como  H es negativa la reacci�n es exot�rmica.
H es negativa la reacci�n es exot�rmica.
Por otra parte, para formar �xido de nitr�geno (gas producido en motores de combusti�n interna) se combinan una mol�cula de ox�geno con una de nitr�geno, de acuerdo con la reacci�n siguiente:
Como  H es positiva la reacci�n es endot�rmica.
H es positiva la reacci�n es endot�rmica.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)