Corresponde a la sesi�n de GA 5.11 LAS CORRIENTES
La corriente el�ctrica es un flujo de electrones; por lo tanto, existe una estrecha relaci�n entre la qu�mica y la electricidad.
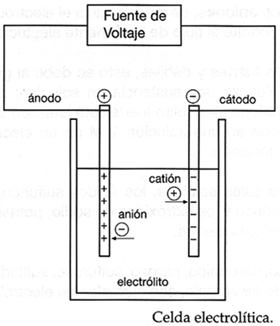
La electr�lisis es un proceso mediante el cual, al hacer pasar una corriente el�ctrica a trav�s de una sustancia (en soluci�n o fundida) se separa en los iones que la forman, este proceso se utiliza para descomponer una sustancia en sus elementos, para purificar metales y para aplicar una capa met�lica externa a un objeto. Esta �ltima aplicaci�n es muy utilizada en procesos como la galvanoplastia, la galvanostegia y el niquelado, los cuales tienen gran importancia en la industria, ya que mediante ellos se fabrican latas para envasar alimentos y se hacen el cromado y el chapeado, entre otros.
La celda electroqu�mica, conocida tambi�n como pila voltaica o galv�nica, sirve para generar una corriente el�ctrica mediante una reacci�n qu�mica. �sta consta de dos vasos conectados por un puente salino, cada vaso contiene un electr�lito y tiene sumergida una barra conductora o electrodo, uno de ellos debe ser de un metal cuyos �tomos se desprendan al ponerse en contacto con el electr�lito. Adem�s, los electrodos est�n conectados por medio de un conductor, de manera que los electrones fluyan de un lado para otro.
El vaso de la izquierda contiene una soluci�n de sulfato de zinc  , en �l se introduce una barra de zinc; los �tomos de este elemento se oxidan y pasan a la soluci�n en forma de iones positivos, en tanto que la barra o electrodo queda cargado negativamente, es decir, con un exceso de electrones; �stos pasan a trav�s del conductor hasta la otra barra, que es de cobre, y est� sumergida en el vaso de la derecha en una soluci�n de sulfato de cobre
, en �l se introduce una barra de zinc; los �tomos de este elemento se oxidan y pasan a la soluci�n en forma de iones positivos, en tanto que la barra o electrodo queda cargado negativamente, es decir, con un exceso de electrones; �stos pasan a trav�s del conductor hasta la otra barra, que es de cobre, y est� sumergida en el vaso de la derecha en una soluci�n de sulfato de cobre  , all� los iones de cobre de la sal se reducen al tomar los electrones de la barra y se depositan en el fondo en forma de metal.
, all� los iones de cobre de la sal se reducen al tomar los electrones de la barra y se depositan en el fondo en forma de metal.
El electrodo donde se lleva a cabo la oxidaci�n recibe el nombre de �nodo, y el electrodo donde se lleva a cabo la reducci�n recibe el nombre de c�todo.
El paso de los electrones a trav�s del conductor (flujo el�ctrico) se puede detectar mediante un dispositivo el�ctrico como un foco o un volt�metro.
La pila voltaica est� constituida por dos electrodos, uno de cobre y otro de zinc, sumergidos en una soluci�n de �cido sulf�rico 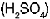 . El �cido reacciona con el electrodo de zinc formando sulfato de zinc
. El �cido reacciona con el electrodo de zinc formando sulfato de zinc  .
.
Se provoca una acumulaci�n de electrones en la placa de zinc, al colocar un puente met�lico entre los electrodos por fuera de la soluci�n, fluye la corriente el�ctrica del zinc al cobre. hasta que se consume todo el zinc, en este momento se dice que la pila esta "muerta". Es necesario a�adir una sustancia dispolarizante para evitar la acumulaci�n de burbujas de hidr�geno.
La pila seca consta de un envase de zinc y una varilla de carb�n suspendida dentro de una pasta de cloruro de amonio 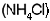 y se utiliza �xido de manganeso
y se utiliza �xido de manganeso 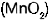 como dispolarizante. El cloruro de amonio reacciona con el zinc y forma cloruro de zinc, esto provoca una acumulaci�n de electrones en el zinc y la liberaci�n de iones hidr�geno, que se mueven hacia el carbono y toman de �ste los electrones que necesitan para convertirse en hidr�geno molecular, dejando al carbono cargado positivamente. Al colocar un puente met�lico entre el zinc y el carbono fluyen los electrones del primero al segundo.
como dispolarizante. El cloruro de amonio reacciona con el zinc y forma cloruro de zinc, esto provoca una acumulaci�n de electrones en el zinc y la liberaci�n de iones hidr�geno, que se mueven hacia el carbono y toman de �ste los electrones que necesitan para convertirse en hidr�geno molecular, dejando al carbono cargado positivamente. Al colocar un puente met�lico entre el zinc y el carbono fluyen los electrones del primero al segundo.
Cuando el envase de zinc se ha agotado o la pasta est� seca, la pila est� "muerta". Este tipo de pila ofrece la ventaja de que ocupa poco espacio y evita derrames.
Se han elaborado otros tipos de pilas como las de cadmio, mercurio y manganeso, que se utilizan en aparatos port�tiles.
Como se ha descrito, en todos los enlaces qu�micos est�n involucrados los electrones, por lo que se puede decir que las reacciones qu�micas son de naturaleza el�ctrica, por eso es que mediante reacciones qu�micas se puede obtener energ�a el�ctrica (pila voltaica) y con energ�a el�ctrica se pueden inducir reacciones qu�micas (celda electrol�tica)
La electroqu�mica estudia las reacciones que existen entre la electricidad y las reacciones qu�micas.
Existen pilas que pueden ser recargadas una vez que se han agotado, esto es posible haciendo pasar por ellas una corriente el�ctrica en sentido contrario al flujo de electrones de la pila; por ejemplo: en los acumuladores.
Se utiliza para proveer de energ�a el�ctrica a los autom�viles, consta de dos placas o rejas de plomo (Pb) sumergidas en �cido sulf�rico diluido 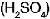 La placa que act�a como c�todo est� recubierta de �xido de plomo y la que funciona como �nodo es de plomo.
La placa que act�a como c�todo est� recubierta de �xido de plomo y la que funciona como �nodo es de plomo.
Las reacciones que se llevan a cabo durante la descarga (reacciones de media pila) son las siguientes:
En el �nodo se lleva a cabo la oxidaci�n:
En el c�todo se lleva a cabo la reducci�n:
La reacci�n completa del proceso es:
Durante el proceso de descarga se forman sulfato de plomo 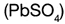 y agua, y se consume el �cido sulf�rico
y agua, y se consume el �cido sulf�rico 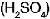 . Cuando se conecta un generador de corriente continua (como una d�namo en el caso de los autom�viles) entre los polos del acumulador descargado y se pasa corriente el�ctrica, la reacci�n se invierte, por lo que se dice que el acumulador se ha recargado.
. Cuando se conecta un generador de corriente continua (como una d�namo en el caso de los autom�viles) entre los polos del acumulador descargado y se pasa corriente el�ctrica, la reacci�n se invierte, por lo que se dice que el acumulador se ha recargado.
El voltaje obtenido en un acumulador (una celda) es de 2.1 v, por lo que deben conectarse de 3 a 6 celdas de acumulador en serie (formando una bater�a), ya que un autom�vil requiere de 6 a 12 v.
Un acumulador de plomo almacena energ�a el�ctrica con un rendimiento del 80%.
Los cambios de volumen del �cido sulf�rico diluido pueden provocar la desintegraci�n de las placas, por lo tanto es necesario tener cuidado con este aspecto.
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)