II. EL PRINCIPIO DE LA CONSERVACIÓN DE LA ENERGÍA
LOS estudios decisivos que condujeron a establecer la equivalencia
entre el trabajo mecánico y el calor fueron realizados en 1840 por James Joule
en la Gran Bretaña. Tales estudios estuvieron inspirados en los trabajos que
Rumford había llevado a cabo casi cincuenta años antes y que describimos en
el capítulo anterior. En un trabajo intitulado EI equivalente mecánico de
calor, que data de 1843 y que fue publicado en 1850, Joule presentó evidencia
inequívoca justificando las conclusiones de Rumford. Al respecto escribió:
Hizo ver también que si en el experimento de Rumford (ver capítulo I) se supone que la rapidez con que se suministra el trabajo (potencia) es, como indica Rumford, de un caballo de fuerza se puede estimar que el trabajo requerido para elevar una libra (454 g) de agua, 1º F (18º C) es aproximadamente igual a 1 000 ft. lb (1 356 julios) lo cual no es muy diferente del valor obtenido en sus propios experimentos, 772 ft-lb (1 046 julios).
El experimento de Joule fue una verdadera proeza de precisión y de ingenio
considerando los medios de que se disponían en esa época. El aparato (ver Fig.
4) consistía esencialmente en un eje rotatorio dotado de una serie de paletas,
de hecho ocho brazos revolventes, girando entre cuatro conjuntos de paletas
estacionarias. El propósito de estas paletas era agitar el líquido que se colocaba
en el espacio libre entre ellas. El eje se conectaba mediante un sistema de
poleas y cuerdas muy finas a un par de masas de peso conocido. El experimento
consistía en enrollar la cuerda sujetando las masas sobre las poleas hasta colocarlas
a una altura determinada del suelo. Al dejar caer las masas, el eje giraba lo
cual a su vez generaba una rotación de los brazos revolventes agitando el líquido
contenido en el recipiente.
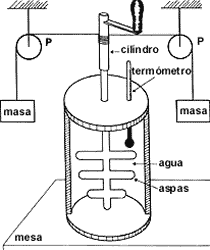
Figura 4. Aparato empleado por Joule en la medición del equivalente mecánico
del calor. Las masas conocidas m se enrollan por medio de la manivela sobre
el cilindro. La cuerda pasa por dos poleas P perfectamente bien engrasadas.
La altura de las masas sobre el suelo es conocida, y la temperatura del agua
se controla mediante el termómetro.
Este proceso se repetía veinte veces y se medía la temperatura final del líquido agitado. Las paredes del recipiente que contenía el líquido eran herméticas y estaban fabricadas de una madera muy gruesa adecuadamente tratada para minimizar cualquier pérdida de calor por convección y por radiación. Después de una repetición muy cuidadosa de estos experimentos Joule concluyó lo siguiente:
1) La cantidad de calor producida por la fricción entre cuerpos, sean líquidos o sólidos siempre es proporcional a la cantidad de trabajo mecánico suministrado.
2) La cantidad de calor capaz de aumentar la temperatura de 1 libra de agua (pesada en el vacío y tomada a una temperatura entre 55º y 60º F) por 1.8º C (1º F) requiere para su evolución la acción de una fuerza mecánica representada por la caída de 772 lb (350.18 kg) por la distancia de l pie (30.48 cm).
Entre 1845 y 1847 repitió estos experimentos usando agua, aceite de ballena
y mercurio, obteniendo que por cada libra de estos compuestos, los equivalentes
mecánicos eran respectivamente iguales a 781.5, 782.1 y 787.6 lb, respectivamente.
De ahí concluyó lo siguiente:
Los resultados obtenidos por Joule son de hecho la base de lo que se conoce
en la actualidad como la primera termostática. En efecto, lo que hacen ver es
que aislados de su exterior, y a los que se suministra la misma cantidad de
energía mecánica de maneras diferentes, el cambio observado en el sistema es
el mismo. En el caso del experimento de Joule este cambio se registra por la
variación de la temperatura del sistema. Sistemas aislados de su exterior, son
aquellos que se encuentran encerrados en recipientes cuyas paredes impiden totalmente
la interacción térmica con los alrededores; a estas paredes ideales se les llama
paredes adiabáticas. Obsérvese que en estos experimentos el sistema no se mueve,
su energía cinética es cero, ni se desplaza respecto al nivel del suelo, su
energía potencial permanece constante y sin embargo ¡el sistema ha absorbido
una cierta cantidad de energía! La clave de la respuesta a esta interrogante
es que si creemos en el principio de la conservación de la energía,
la energía suministrada debe convertirse en otro tipo de energía. A esta energía
la llamamos la energía interna del sistema. Las experiencias de Joule
sirvieron para extender esta observación a todo sistema termodinámico y postular
que si a cualquier sistema aislado, esto es, que no intercambie ni calor
ni masa con sus alrededores, le suministramos una cierta cantidad de energía
mecánica W, ésta sólo provoca un incremento en la energía interna del
sistema U, por una cantidad DU de manera tal que:
|
DU = Wad
|
Esta igualdad, en donde el índice "ad" en W sólo sirve para puntualizar que la energía mecánica suministrada al sistema debe hacerse sólo cuando este se encuentre aislado de sus alrededores, constituye la definición de la energía interna U. La existencia de esta cantidad para cualquier sistema, es el postulado conocido como la primera ley de la termostática.
Es importante insistir en que la ecuación (1) que ahora proponemos sea válida para cualquier sistema, agua, aceite, un metal, un gas, un trozo de imán, etc. constituye una extrapolación de los experimentos de Joule, quien la verificó, como hemos visto, sólo para unas cuantas substancias.
Más aún, la hemos podido escribir invocando el principio de la conservación de la energía, que en esencia nos permite definir lo que entenderemos por DU. Vale la pena aclarar que DU es un símbolo que representa al cambio en la energía interna entre el estado inicial (e.g. el agua a 55º F en el experimento de Joule) que podemos llamar Ui y la energía interna en el estado final (e.g. el agua a la temp. final) que designaremos por Uf . Entonces, DU º Uf — Ui.
Por otra parte, hemos visto ya en el capítulo I que si el sistema sobre el
cual estamos realizando nuestros experimentos está a una temperatura diferente
que la del medio ambiente habrá una tendencia natural a establecerse un flujo
de calor entre ambos. En pocas palabras si los experimentos de Joule u otros
similares sobre otros sistemas se llevaran a cabo sin tomar la precaución de
aislar el sistema de sus alrededores, observaríamos que:
|
DU —W¹
0
|
El ejemplo más simple al que el lector puede recurrir es el de calentar la misma masa de agua usada por Joule, pero poniéndola directamente al fuego hasta obtener la misma variación en la temperatura. Tomando las precauciones necesarias para que ni el volumen, ni la presión ni otra propiedad del agua cambien, debemos concluir que la misma energía W que produjo el cambio en U en los experimentos de Joule, fue ahora suministrada por el fuego, i.e, es una cantidad de calor Q. Y en el caso de que la energía mecánica sea suministrada en las condiciones que exhibe la ecuación (2), es claro que la energía faltante, según Carnot, debe tomarse en cuenta por las "pérdidas" de calor provocadas por el flujo de calor del cuerpo o sistemas al exterior. Combinando estos resultados podemos escribir que :
|
DU - W = Q
|
esto es, la energía se conserva en todo proceso si se toma en
cuenta el calor. Esta simple ecuación que no es otra cosa más que la expresión
del principio de conservación de la energía para procesos termostáticos requiere
de varios comentarios importantes que ponen de manifiesto, tanto su relevancia
como su naturaleza misma. El primer comentario se refiere a la concepción de
Q en la ecuación (3). Según las experiencias de Rumford y de Joule corresponde
a una forma no mecánica de energía, precisamente aquella que se libera por fricción.
De hecho, las propias experiencias de Joule muestran que la cantidad de calor
Q definida en (3) sólo difiere por un factor numérico de la definición tradicional.
Una caloría se define como la cantidad de calor requerido para elevar 1 g. de
agua de 15.5º C a 16.5º C. Pero según Joule, esa cantidad de calor es equivalente
a un trabajo mecánico de 4.187 julios en unidades MKS.2
Entonces, una caloría es igual a 4.187 julios y al factor de conversión de unas
unidades a otras se conoce como el equivalente mecánico del calor, a menudo
representado por J. Así,
J = 4.187 julios / caloría
El segundo comentario concierne al origen de la ecuación (3). Para llegar a ella hemos invocado la validez universal del principio de conservación de la energía. Así pues esta ecuación sólo resume las experiencias de Rumford, Joule y Carnot. No es la primera ley de la termostática como suele afirmarse a menudo. Pero insistimos, para hablar de conservación de energía se requiere de una definición operativa de energía para cualquier sistema. Esta definición, dada por la ecuación (1) y que extiende las experiencias de Joule a cualquier sistema, es la primera ley de la termostática.
El tercer comentario concierne a la naturaleza de los términos que aparecen en la ecuación (3). Por una parte, DU corresponde, por definición, a una cantidad que no depende de la naturaleza del proceso usado para medirla. En este sentido tiene una jerarquía similar a otras variables como la presión p, el volumen V, la temperatura T, etc. Decimos entonces que es una variable capaz de describir el estado de un sistema o, simplemente, una variable de estado. Es pues una cantidad intrínseca a la naturaleza del sistema que se escoge para estudiarlo. Nótese que la definición (1) sólo nos permite medir diferencias de energía interna lo cual indica que análogamente al caso de la energía potencial en mecánica o el potencial electrostático, podemos escoger arbitrariamente un punto de referencia, i.e, un estado arbitrario al cual podemos asignar un valor determinado a U y que puede ser cero. Los otros dos términos Q y W son de naturaleza totalmente diferente a U. Sólo intervienen en un sistema cuando lo llevamos por un proceso determinado en el cual puede realizar o recibir trabajo y absorber o ceder calor. Claramente los valores de Q y W dependerán del proceso en cuestión y por consiguiente ni uno ni otro es una variable de estado.
Una analogía pedestre puede ayudar a comprender esta situación. En términos de una cuenta bancaria, la solvencia económica de una persona sólo puede determinarse por los fondos que tiene en ella, esto es, el dinero depositado en el banco. Esa cantidad describe o indica el estado financiero por lo que a sus fondos disponibles concierne, de esa persona. Cuando ocurre un proceso éste puede concebirse como al girar o depositar cheques bancarios y sacar o depositar dinero en efectivo. Al final del proceso el cambio en sus fondos será igual a la suma neta de las cantidades involucradas en el manejo de cheques y en efectivo.
Estas dos juegan el papel de W y Q en tanto que el dinero en la cuenta es U. (Aquí el estado de referencia es obvio pues U = O corresponde a tener la cuenta en cero.)
Así que, en pocas palabras, U es una variable de estado, Q y W sólo tienen sentido y aparecen en escena si ocurre un proceso. A menudo, aun después de todas estas consideraciones, es frecuente escuchar la pregunta: ¿ Y qué es el calor? La respuesta es ahora obvia: es una forma de energía que aparece en un proceso y cuyo origen no es mecánico. El frotamiento continuo entre dos cuerpos, como observó Rumford, genera "calor".
Cierto es que para producir ese frotamiento requerimos de un agente externo, sea el esfuerzo muscular de quien los frota, el caballo que daba vueltas al taladro en el experimento de Rumford, etc. Pero la acción misma de frotamiento produce una energía que como mostró Carnot no puede convertirse íntegramente en trabajo útil. Sin embargo su inclusión en la descripción global de un proceso, en cuanto a un balance de energía concierne, es imprescindible para estar en concordancia con el principio de conservación de la energía.
Calor es, pues, una forma de energía en tránsito. A pesar de esto es frecuente usar el término calor en modos que aparentan estar en contradicción con lo arriba expuesto. Decimos que el calor "fluye" de un cuerpo caliente a uno frío como si se tratara de un fluido. Esto es incorrecto y justamente lo que debemos descartar para entender correctamente la ecuación (3). Como en el caso del mechero discutido en conexión con los experimentos de Joule, DU = Q representa el cambio en la energía interna del sistema formado por los dos (o más) cuerpos cuando por diferencias en las temperaturas entre ellos ocurre un intercambio de energía de naturaleza no mecánica.
Antes de llevar a su final esta discusión sobre la conservación de la energía
y la primera ley de la termostática conviene señalar que a pesar de sus brillantes
experiencias y el hecho casi obvio de que la ecuación (3) estaba por detrás
de todos sus resultados no fue Joule el primero en llegar a esta conclusión.
La ecuación (3) fue en realidad producto del análisis más profundo que sobre
las experiencias de Joule, Carnot y otros realizaron sir William Thomson, más
tarde lord Kelvin, y Rudolf Clausius a principio de la segunda mitad del siglo
XIX. Pero todavía es más curioso que un año antes que Joule diera a conocer
sus resultados en Inglaterra, un joven médico nativo de Heilbronn, Alemania.
Julius Robert Mayer en 1842 sugirió una equivalencia general entre la conservación
de todas las formas de energía. En su ensayo intitulado Comentarios sobre
las energías de la naturaleza inorgánica usando lo que ahora llamamos "experimentos
pensados" hizo ver que partiendo del principio que establece que una causa es
igual a su efecto y considerando que las energías son causas capaces de asumir
varias formas, las energías son entidades indestructibles e interconvertibles.
A pesar de que el método de Mayer es enteramente diferente al de Joule, pues
no tuvo la oportunidad de realizar experimentos, sus conclusiones son muy parecidas.
Mayer hace notar que existen formas de energía en la naturaleza que no están
asociadas necesariamente con el movimiento (energía cinética) ni con la elevación
o descenso de un cuerpo (energía potencial) y plantea, con base en su primera
proposición, el problema sobre otras formas que la energía puede asumir. Hace
ver que, como el calor se puede generar por fricción, debe ser una forma de
movimiento y por lo tanto equivalente a una energía cinética o potencial.
Finalmente, se plantea la pregunta acerca de cómo calcular la cantidad de calor correspondiente a una cantidad dada de energía cinética o potencial (¡El equivalente mecánico del calor!). En este punto crucial, Mayer plantea un "experimento pensado" y esboza un cálculo mediante el cual muestra que J = 4 200 julios/Kcal, el cual considerando la imprecisión de un método, es muy razonable si lo comparamos con la ecuación (4). Sin embargo, su trabajo pasó desapercibido y no recibió crédito alguno en los 20 años subsecuentes.
Para completar la lista de los distinguidos y notables investigadores que reclaman la paternidad del contenido físico de la ecuación (3) no podemos dejar de citar a H. von Helmholtz quien el 23 de julio de 1847 leyó ante la Sociedad de Física de Berlín un trabajo intitulado "La conservación de la fuerza". En este trabajo, de naturaleza estrictamente matemática, hace ver que la energía (fuerza en su trabajo) se conserva y que el calor es una forma de energía, una vez más, las proposiciones básicas detrás de la ya familiar ecuación (3).
Es así como para 1847-1850, cuando las locomotoras recorrían grandes distancias, los ríos y lagos eran surcados por buques de vapor y la máquina de vapor era de uso común, apenas se establecían las bases teóricas de la equivalencia entre calor y trabajo mecánico, en tanto se desterraban los últimos resquicios de la teoría del calórico y se asentaba el concepto de "energía interna" como un postulado ahora llamado la primera ley de la termostática. Sin embargo subsistía sin responderse una segunda pregunta planteada por Sadi Carnot en 1824: ¿Qué fracción del calor cedido a una máquina térmica es aprovechable? Su respuesta condujo a los físicos de la época por el sendero de la segunda ley de la termostática y el todavía controvertido y escurridizo concepto de la entropía.
NOTAS
2 El resultado de Joule para el agua es
de aproximadamente 780 ft-1b para 1 lb (= 453.6 g de H2O) por 1º F = 1.8º C.
Como un julio = 0.7376 ft-lb en el sistema MKS la energía mecánica es ![]() .
.