IV. ¿SE PUEDE MEDIR LA CORROSIÓN?
DESDE un punto de vista práctico, es interesante conocer a priori la resistencia a la corrosión de un determinado metal o aleación en un medio ambiente específico. Sobre la base de ensayos en el laboratorio, se pueden llegar a establecer las condiciones ambientales más fielmente parecidas a la realidad y, por tanto, estudiar el comportamiento de un metal o varios metales en este medio.
La realización de estos ensayos en el laboratorio puede ser fácil o extraordinariamente difícil, según la naturaleza del medio estudiado.
Dos casos extremos nos podrán servir de ejemplo para ilustrar lo anterior. Si se necesita evaluar el comportamiento o la resistencia a la corrosión de un acero respecto a un ácido mineral, por ejemplo, clorhídrico, bastará con preparar soluciones de diferente concentración de este ácido y sumergir en cada una de ellas, una muestra del acero que se piensa ensayar. La resistencia a la corrosión de tal acero se puede evaluar, por ejemplo, por la pérdida de peso experimentada antes y después del ensayo. Obtendremos para cada solución ensayada un valor de la velocidad de corrosión que nos permitirá prever el comportamiento de este acero en unas condiciones muy cercanas a las de su utilización. La realización de estos ensayos, en este caso, no representa excesivas dificultades.
Pensemos ahora que estamos interesados en prever la corrosión de un acero que se va a emplear para la construcción del casco de un barco. Aquí, dada la naturaleza del medio es muy difícil, por no decir imposible, poder fijar en el laboratorio las condiciones ambientales en las que se va a encontrar el barco. Pensemos en la misma naturaleza del agua de mar, mezclas de sales, su diferente composición en cuanto a los mares que pueda surcar el barco, diferencia de temperaturas y un muy largo tiempo de navegación, etcétera.
En este caso, los ensayos de laboratorio son tremendamente complicados y difíciles, no siendo casi nunca posible fijar las condiciones experimentales en el laboratorio, siquiera de una manera aproximada a la realidad. Son tan numerosos y complejos los factores de la corrosión que intervienen en los medios naturales que es prácticamente imposible reproducirlos en el laboratorio.
De una manera muy general y en función del objetivo perseguido (selección de materiales, estudios de la resistencia a la corrosión o bien del mecanismo de la corrosión, etc.) los ensayos de corrosión se pueden englobar en dos grandes categorías:
a) ensayos acelerados realizados en el laboratorio;
b) ensayos de larga duración efectuados en los medios naturales.
MÉTODOS DE EVALUACIÓN DE LA VELOCIDAD DE CORROSIÓN
El método utilizado tradicionalmente y que se viene creando hasta la fecha, es el de medida de la pérdida de peso. Como su nombre indica, este método consiste en determinar la pérdida de peso que ha experimentado un determinado metal o aleación en contacto con un medio corrosivo.
Las unidades más frecuentemente utilizadas para expresar esa pérdida de peso son: miligramos decímetro cuadrado día (mdd), milímetros por año (mm/año), pulgadas por año o milipulgadas por año (mpy, abreviatura en inglés). Así por ejemplo, si para una determinada aplicación podemos evaluar, mediante una serie de ensayos previos, la pérdida de peso de dos aceros en el mismo medio agresivo, podemos tener una idea de qué material se podrá emplear con mayores garantías, desde un punto de vista de resistencia a la corrosión, sin tener en cuenta otros muchos requerimientos y propiedades que para nuestro ejemplo, vamos a suponer iguales.
Supongamos que el resultado de los ensayos efectuados sea el siguiente:
|
Pérdida de peso
|
|
|
Acero 1............................................................................
|
4.1 mm/año
|
|
Acero 2...........................................................................
|
2.3 mm/año
|
Evidente, la selección en este caso favorecerá al acero con una menor velocidad de corrosión, el acero 2.
Las unidades anteriormente citadas constituyen las de mayor utilización en Ingeniería de la Corrosión.
MEDIDA DE LA VARIACIÓN DE LAS PROPIEDADES MECÁNICAS
Hemos visto en el primer capítulo que existen diferentes formas de corrosión. La medida de la velocidad de corrosión por el método de la medida de la pérdida de peso supone el caso de la corrosión generalizada o uniforme, que es la que sufre el acero con más frecuencia.
La corrosión localizada supone muy a menudo una pérdida mínima de material, pero en cambio puede alterar drásticamente sus propiedades mecánicas. Por tanto, un control de esas propiedades mecánicas puede poner de manifiesto este tipo de ataque. Por ejemplo, un ensayo de tracción permitirá determinar la resistencia del metal atacado en comparación con una probeta del mismo material que no haya sido sometida a las condiciones del medio agresivo.
Diferentes formas de corrosión, entre ellas la corrosión fisurante que se vio como responsable de la rotura del tambor de las lavadoras automáticas, son posibles de detectar y en su caso de controlar, mediante los ensayos y sus variaciones correspondientes en las propiedades mecánicas.
La aplicación masiva de los aceros inoxidables ha traído consigo la aparición de nuevas formas de corrosión, a las que son especialmente susceptibles éstos. Por ejemplo, los aceros inoxidables austeníticos pueden sufrir la llamada corrosión intergranular, debida a una precipitación de carburos de cromo en los bordes de grano, como consecuencia de un tratamiento térmico inadecuado. La localización de este tipo de corrosión puede realizarse mediante un examen metalográfico con un microscopio clásico de luz reflejada que permite visualizar la estructura superficial del metal, haciendo presente cualquier tipo de ataque, sea intergranular, como en el caso citado, o bien transgranular.
El desarrollo de los microscopios electrónicos de barrido permite actualmente lograr una excelente identificación de las formas de corrosión localizada que ocurren en los diferentes metales y aleaciones. La presencia, en muchos microscopios electrónicos de barrido, de un analizador de rayos X, permite además, un análisis puntual y con ello determinar la naturaleza de los constituyentes afectados por el proceso de corrosión, así como estudiar la influencia de ciertas adiciones y el efecto de diversos tratamientos térmicos, capaces de modificar la estructura del metal o aleación empleado.
La demostrada naturaleza electroquímica de los procesos de corrosión, especialmente de los que tienen lugar a la temperatura ambiente (corrosión atmosférica) o a temperaturas inferiores a los 100ºC (frecuente en la mayoría de procesos industriales) ha permitido la aplicación de los métodos electroquímicos modernos, al estudio de la corrosión de los metales y en consecuencia, a la medición de la velocidad de corrosión.
Todas las técnicas electroquímicas modernas están basadas prácticamente en el desarrollo de un aparato que se conoce con el nombre de potenciostato. El potenciostato es un instrumento electrónico que permite imponer a una muestra metálica colocada en un medio líquido y conductor, un potencial constante o variable, positivo o negativo, con respecto a un electrodo de referencia. Este electrodo de referencia no forma parte del circuito de electrólisis y, por el mismo, no circula corriente alguna. Su presencia se debe exclusivamente a que sirve de referencia para poner a prueba en todo momento el potencial de la probeta metálica que se está ensayando.
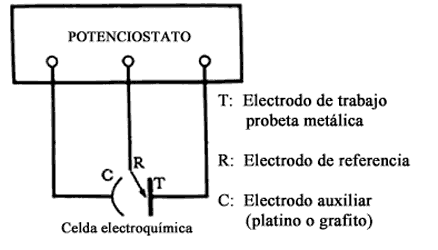
Para cerrar el circuito de electrólisis se utiliza un tercer electrodo, por
lo general de un material inatacable por el medio en que se realiza la experiencia
(platino o grafito, por ejemplo).
De una manera sencilla podemos entender el funcionamiento del potenciostato. Tomemos al hierro como metal de prueba. Si una solución (por ejemplo, un ácido mineral) es muy agresiva con el hierro, el ataque del metal producirá un paso importante de electrones, en forma de iones de hierro cargados positivamente, a la solución. Esta producción de electrones es la responsable del alto potencial negativo de disolución del hierro en un medio agresivo. Se puede entender fácilmente que con la ayuda de una fuente externa de corriente, será posible tanto acelerar como frenar esta emisión de electrones y, por consiguiente, aumentar o detener la corrosión del hierro por modificación de su potencial.
Si a partir del valor del potencial de corrosión, y mediante la fuente externa de potencial, aumentamos éste en la dirección positiva (anódica), se puede llegar a obtener el llamado diagrama o curva de polarización potenciostática, la cual es de mucha utilidad para prever y predecir el comportamiento de materiales metálicos en unas condiciones dadas.
En la figura se presenta el diagrama que se obtiene para el caso de un acero en una solución de ácido sulfúrico, H2SO4.

Figura 22.