IV. LA QUÍMICA HACIA LA CONQUISTA DEL SOL (ELECTROQUÍMICA Y FOTOELECTROQUÍMICA)
CELDAS ELECTROQUÍMICAS FUNDAMENTOS
EN EL CAPÍTULO ANTERIOR se han descrito algunas de las principales características de los semiconductores. Se verá ahora el funcionamiento de estos materiales en celdas electroquímicas, por lo que resulta necesaria una breve revisión de los conceptos básicos de la electroquímica.
Recientes descubrimientos arqueológicos han llevado a los científicos a postular
que ciertos procedimientos electroquímicos ya eran conocidos hace más de 2 mil
años. Sin embargo, los inicios de la electroquímica como ciencia formal se sitúan
en los últimos años del siglo XVIII. En 1786, Luigi Galvani descubrió
una interesante relación entre las contracciones musculares de un anca de rana
y ciertos impulsos que se obtenían al hacer contacto dos metales diferentes.
Posteriormente, en 1796, Alessandro Volta estableció que, al formar uniones
con diferentes metales, se generaba un potencial eléctrico que originaba las
contracciones observadas por Galvani. De los nombres de estos científicos han
surgido dos de los términos más conocidos en electroquímica: "voltaje", para
designar el potencial de un sistema eléctrico, y "celda galvánica" para nombrar
los dispositivos que transforman energía química en energía eléctrica, como
son, por ejemplo las pilas que se utilizan a diario en radios, linternas, etcétera.
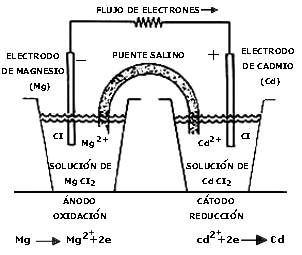
Una celda galvánica común está constituida básicamente por dos piezas metálicas, llamadas electrodos, y una solución que contiene iones, denominada electrólito. Los electrolitos son generalmente líquidos, pero algunas celdas de gran importancia tecnológica utilizan electrólitos sólidos o en forma de pasta.
El aspecto fundamental de una celda galvánica, como el de cualquier sistema electroquímico, es la transferencia de carga eléctrica entre materiales con diferentes características: por un lado, los electrones metálicos, donde los portadores de carga son únicamente los electrones (conducción electrónica) y, por otro lado, el electrólito, donde la conducción se establece con base en iones negativos (aniones) y de iones positivos (cationes) (conducción iónica). Las reacciones químicas que ocurren en las interfases1 electrodo/electrólito generan el flujo de corriente eléctrica que proporciona la celda. Por ejemplo, una celda galvánica constituida por dos compartimientos -semiceldas-, como se muestra en la figura 35, actúa de la siguiente forma:
Átomos neutros Mg0 del electrodo de magnesio liberan electrones y pasan a la solución como iones Mg2+
Los electrones generados pasan a través de la conexión exterior al electrodo de cadmio, fluyen hacia la interfase y ahí reaccionan con los iones Cd2+ presentes en la solución:
El movimiento interno de iones -a través del puente salino- ayuda a mantener la electroneutralidad completando el circuito. El puente salino es un medio iónico de baja resistividad que permite el paso de los iones pero evita que las soluciones se mezclen directamente. Esta celda permite el aprovechamiento de la energía química en forma de trabajo eléctrico, ya que mantiene unidos a los electrodos mediante una resistencia externa por la que fluyen los electrones. Es este flujo electrónico el que proporciona la energía para que un aparato funcione.
Cuando los electrodos se hallan en contacto directo (corto circuito), no se obtiene trabajo útil; por el contrario, sólo se malgastan los materiales. Este fenómeno constituye lo que conocemos como corrosión, que tantas pérdidas económicas y materiales ocasiona en todo el mundo. Un caso muy conocido es la degradación del hierro para formar un polvo pardo rojizo, que es el óxido de hierro (Fe2 O3). La reacción global es
La humedad del aire es suficiente para actuar como electrólito. Si se tiene la presencia de sales, como ocurre en las zonas cercanas al mar; la corrosión se acelera notablemente.
El solo hecho de poner en contacto un metal con una solución de sus propios iones genera un potencial eléctrico bien establecido. Esto se debe, como se vio en el capítulo anterior; a la formación de una interfase o frontera donde se encuentran dos medios de diferente estructura química. Cada pareja ión metálico/metal constituye un par redox. Este término se aplica en general a cualquier par de sustancias relacionadas por un proceso de óxido-reducción, como
Por convención, se asigna un valor de 0 de potencial al proceso que ocurre en un electrodo de hidrógeno:
| 2 H+ + 2e— |
Todas las demás reacciones tienen un cierto valor de potencial referido a este
cero convencional. Así se puede formar una tabla de potenciales:
| Mg2+ + 2e- ® Mg0 | -2.375 |
| Al3+ + 3e- ® A10 | -1.67 |
| Zn2+ +2e- ® Zn0 | |
| Cd2+ + 2e- ® Cd0 | -0.40 |
| 2 H+ + 2e- ® H2 | 0.0 |
| Cu2+ + 2e- ® Cu0 | +0.346 |
| C12 + 2e- ® 2C1- | +1.358 |
Estos valores de potencial son los obtenidos experimentalmente cuando los elementos son puros, la concentración de las soluciones es 1 mol por litro y la presión de los gases es 1 atmósfera a 25°C. En estas condiciones se utiliza el símbolo E° y se denomina potencial de electrodo estándar.
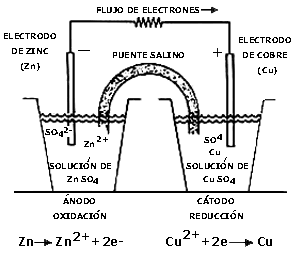
Una de las celdas galvánicas más conocidas es la llamada celda Daniell (figura 37). Consta de dos semiceldas separadas por un vidrio poroso o puente salino. En una de ellas se coloca un electrodo de cobre y una solución 1 molar de sulfato de cobre, mientras que en la otra se coloca un electrodo de zinc en una solución 1 molar de sulfato de zinc. Al unir los electrodos mediante un medidor potencial, se determina que la celda genera un potencial máximo de 1.1 volts, denominado fuerza electromotriz (fem).
Este valor puede ser calculado con base en las reacciones químicas que tienen lugar en la celda y el potencial estándar asociado a estas reacciones. En este caso, los pares son Cu2+/Cu0 y Zn2+/Zn0.
Un potencial más positivo indica una mayor tendencia de las especies a ganar electrones, esto es, a reducirse. En cambio, a medida que un potencial es más negativo (o menos positivo) se tiene una mayor tendencia a la oxidación, o sea a la pérdida de electrones. De acuerdo a lo anterior, se puede afirmar que las reacciones en la celda Daniell seran:
La fem de una celda se calcula mediante la relación: fem = Potencial más positivo — Potencial más negativo, sin cambiar nunca los valores reportados en la tabla a menos que las condiciones de concentración, presión o temperatura sean diferentes a las estándar.
Por definición, se llama cátodo al electrodo donde ocurre la reducción, y ánodo a aquel donde se lleva a cabo la oxidación. Por lo tanto, la relación también puede escribirse como
fem = Potencial del cátodo - Potencial del ánodo que, para la celda Daniell, resulta ser
Es muy importante notar que, si bien los valores de potencial estándar descritos en la tabla corresponden a las reacciones de reducción, estos valores no cambian de signo si el proceso que ocurre en la semicelda es una oxidación. Por esto, el valor de -0.763 V se mantiene en el caso del zinc y se hace la resta algebraica para obtener la fuerza electromotriz.
La celda Daniell no se puede recargar; esto es, no es posible recuperar las sustancias químicas que han reaccionado mediante la aplicación de un potencial externo en sentido contrario. Si se utiliza una fuente de poder para inyectar electrones al electrodo de zinc con la idea de obtener la reducción de los iones Zn2+ a zinc metálico, la reacción que se obtiene es la formación de hidrógeno a partir de los protones del agua. Esto se debe a que el potencial estándar del par Zn2+ / Zn0 es más negativo que el del par H+ / H2 y, por lo tanto, este último es el que tiene mayor tendencia a reducirse. Por otra parte, la relación de potenciales debe servir únicamente como primer punto a considerar y no como una predicción definitiva de las reacciones por ocurrir. En ocasiones, no son únicamente los valores de potencial, sino la rapidez de la reacción lo que realmente determina la factibilidad de un proceso.
A los sistemas en que se aplica externamente un potencial eléctrico con el objeto de generar reacciones químicas de óxido-reducción, se les conoce como celdas electrolíticas. Uno de los procesos más conocidos es la electrodepositación de metales como cobre, níquel o zinc sobre diferentes sustratos metálicos.
En el cátodo los iones se reducen y, en condiciones adecuadas, empiezan a formar un recubrimiento bastante herencia, como en el caso del cromado de las defenzas en los automóviles. Una técnica de purificación del cobre es el electrorrefinado. Se utilizan ánodos de un cobre impuro (cobre blister) y cátodos de cobre de gran pureza (99.96%) en una solución ácida de sulfato de cobre. Al aplicarse el potencial externo, el ánodo de blister se disuelve mediante la reacción de oxidación:
al mismo tiempo que las impurezas pasan a la solución para posteriormente sedimentarse en el fondo de la celda. En los cátodos ocurre la reacción de reducción.
obteniéndose un depósito de cobre de alta pureza. Las impurezas forman los que se llaman lodos anódicos.
En general, los procesos electroquímicos pueden separarse en dos grupos:
a) Procesos en que los electrodos no sufren ningún cambio.
Los materiales que se introducen al electrólito sirven únicamente como intermediarios para que en su superficie se realice la transferencia de carga y se oxiden o se reduzcan las especies presentes en el electrólito. Por ejemplo, la descomposición del agua se puede lograr aplicando un potencial superior a 1.3 volts entre dos electrodos de platino. En este proceso, denominado electrólisis, se observa la formación de hidrógeno en el cátodo, mientras que en el ánodo se desprende oxígeno. Sin embargo, las piezas de platino no sufren ninguna alteración.
b) Procesos en que los electrodos participan activamente.
Pertenecen a este grupo los casos en que el ánodo se disuelve en forma intencional, como en el electrorrefinado del cobre, o se oxida deliberadamente, como en el caso del aluminio para la obtención de aluminio anodizado que tanta aplicación tiene en la construcción. Desafortunadamente, en muchos casos los electrodos reaccionan cuando no están supuestos a hacerlo, esto es, se oxidan, se contaminan o se disuelven, disminuyendo drásticamente la vida útil de los materiales y ocasionando grandes pérdidas económicas.
En general, los diferentes materiales que se utilizan como electrodos pueden ser utilizados sin problema dentro de ciertos intervalos de potencial eléctrico aplicado. Por ejemplo, un electrodo de mercurio es muy utilizado para reacciones de reducción en medios acuosos, porque inhibe la electrólisis del agua y permite así el estudio de muchas sustancias; pero es prácticamente inútil como ánodo, esto es para procesos de oxidación, ya que, a potenciales positivos, es el propio mercurio el que se oxida. Por otra parte, los electrodos de platino son muy utilizados en el laboratorio, pues permiten trabajar en zonas más o menos amplias de potencial sin verse ellos afectados. Esto es importante, porque en cualquier experimento electroquímico de que se trate es indispensable saber si la corriente que se observa se debe a procesos de óxido-reducción de las especies en solución, o bien a procesos de los propios electrodos.
Sería una sorpresa desagradable encontrar que después de algunas horas de experimentación, nuestros electrodos se hubieran disuelto.
LA TRANSFERENCIA DE CARGA EN AMBOS SENTIDOS
Si no se rebasa su potencial característico de oxidación, en general un metal puede ser utilizado ya sea como cátodo o como ánodo. Esto es, la estructura electrónica del metal permite tanto el flujo de carga del electrodo al electrólito (reducción) como del electrólito hacia el electrodo (oxidación de las especies en solución). La transferencia de carga se obtiene igualmente en ambos sentidos. Esto no ocurre cuando se sustituye el electrodo metálico por un semiconductor.
Debe recordarse que en la unión semiconductor-electrólito, se produce el doblamiento de bandas en el semiconductor que representa la barrera de potencial de Schottky. Al igual que en las uniones p-n descritas en el capítulo anterior, esta barrera permite el flujo de carga de un sentido, pero lo impide en el otro. Por ejemplo, un material tipo n al cual se aplica un potencial negativo puede suministrar electrones a especies oxidadas, reduciéndolas y, por lo tanto, actuando como cátodo. Sin embargo, si a este material se aplica un potencial positivo con la idea de utilizarlo como ánodo, la barrera de potencial impide el flujo de carga.
De esta manera, en una celda electroquímica que contiene un electrodo semiconductor se observará un proceso de rectificación semejante al de las uniones p-n. Si el semiconductor es tipo n, los procesos de reducción serán posibles, mientras que los de oxidación se verán obstaculizados. Si el semiconductor es tipo p, se facilitarán las reacciones de oxidación, pero las de reducción se dificultarán.
En la descripción anterior se ha considerado que el electrodo semiconductor se encuentra en condiciones de oscuridad. ¿Qué sucederá si se ilumina el electrodo?
Al iluminarse el electrodo semiconductor; si la energía de los fotones es suficiente para generar pares electrón-hueco, surge la posibilidad de observar reacciones fotoelectroquímicas.
Se estableció anteriormente que la unión semiconductor-electrólito suele generar una región de carga espacial empobrecida de portadores mayoritarios. Esto significa que, en un material tipo n, los portadores cercanos a la interfase resultan ser los huecos, mientras que para el tipo p son los electrones.
Al formarse los pares electrón-hueco en un semiconductor tipo n, el doblamiento de las bandas ocasiona que los electrones se alejen de las especies en solución, lo cual impide reacciones de reducción. Por otra parte, los huecos cercanos a la interfase pueden reaccionar con las especies iónicas y generar así procesos de oxidación. Se concluye algo muy interesante: un semiconductor tipo n, que en condiciones de oscuridad actúa prioritariamente como cátodo, bajo una iluminación adecuada favorecerá procesos de oxidación, o sea, actuará como fotoánodo. Por las mismas razones, un semiconductor tipo p actuará como fotocátodo, ya que serán los huecos los que se alejen de la interfase, mientras que los electrones quedarán disponibles para reacciones de reducción. Puede verse que en fotoelectroquímica son, curiosamente, los portadores minoritarios los que juegan el papel principal.
En las celdas electrolíticas convencionales descritas anteriormente, las reacciones químicas se obtienen al aplicar un potencial eléctrico externamente. Así, la energía suministrada como trabajo eléctrico se transforma en energía química acumulada en los productos de reacción.
En una celda fotoelectroquímica, es la energía proporcionada en forma de luz la que genera las reacciones químicas. Una celda fotoelectroquímica resulta, así, una especie de "hoja artificial" que, como las hojas de las plantas, utiliza la luz para promover reacciones químicas.
Como se vio en el capítulo II, la fotosíntesis ocurre en las plantas verdes -específicamente en los cloroplastos- y puede resumirse por la ecuación:
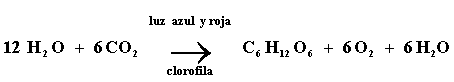
Uno de los puntos más importantes de recordar es que el oxígeno generado proviene de la descomposición del H2O y no del CO2 como se creía originalmente.
En el capítulo III, como antecedente al estudio de las bandas de energía, se presentó el modelo de excitación electrónica que origina el color de los objetos. Así, la clorofila resulta ser de color verde porque absorbe selectivamente las radiaciones característica, del azul y del rojo en el espectro visible. De esta manera, puede establecerse que el comportamiento de la clorofila es análogo al de un material semiconductor que absorbe determinadas energías en función de la magnitud de la banda prohibida.
Hasta hace algunos años, la gran mayoría de los estudios en semiconductores se realizaban con materiales inorgánicos puros, como el silicio o el germanio y, más recientemente, con compuestos como el TiO2 o el CdTe. Sin embargo, la investigación de muchos pigmentos o colorantes, ente ellos la clorofila, ha demostrado que suelen poseer propiedades semiconductoras. De esta manera se ha incrementado en gran forma el estudio de los semiconductores orgánicos. En la figura 38 se muestran:
(a) Molécula de ftalocianina de magnesio
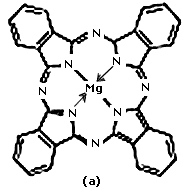
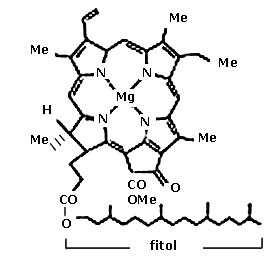
Con base en los conceptos anteriores, desde la década de los setenta, y dentro del marco de la búsqueda de nuevas fuentes de energía, muchos científicos se han dedicado a la construcción de sistemas artificiales de fotosíntesis, donde generalmente se substituye el pigmento natural por otros colorantes de estructura semejante pero más fáciles de obtener en el laboratorio, o bien, por semiconductores inorgánicos. Uno de los objetivos principales es lograr una fotosíntesis "abiótica", o sea, no asociada a un ser vivo y, por lo tanto, menos limitada en condiciones de presión, temperatura o concentración.
Tratar de simular en el laboratorio todas las reacciones que ocurren naturalmente en las plantas durante la fotosíntesis es evidentemente, una tarea muy difícil, sobre todo si se recuerda que no todos los pasos químicos de esta reacción han sido claramente establecidos. Hasta ahora, lo único que ha sido posible construir es un sistema que al iluminarse genera la fotodescomposición del agua para obtener hidrógeno y oxígeno:
En 1981 se fabricó un "cloroplasto artificial" donde ocurre esta reacción al iluminarse una solución acuosa de compuestos orgánicos — muy similares a la clorofila natural— que contienen magnesio. Por supuesto, este dispositivo es miles de veces más grande que el prodigioso cloroplasto natural y, con seguridad, mucho más costoso. Sin embargo, representa el afán del hombre por desentrañar los secretos de la naturaleza en una primera alternativa que suele ser la imitación.
Al igual que en los últimos años las gigantescas calculadoras se han reducido al tamaño de una tarjeta de presentación gracias al uso de los circuitos impresos a base de microcomponentes, se piensa que es posible obtener "micro-cloroplastos". Para esto, al igual que en la electrónica, es necesario recurrir a los materiales semiconductores
Los "micro-cloroplastos artificiales" de que tenemos noticia hasta la fecha son en realidad pequeñísimas partículas de un material semiconductor dispersadas en un medio acuoso. Estas partículas son previamente recubiertas en forma parcial con platino, de forma que en la superficie de la partícula ocurren tanto la reacción de oxidación como la de reducción (ver capítulo II). Esto equivale a tener una microcelda electrolítica donde cátodo y ánodo están contenidos en la misma partícula semiconductora.
El recubrimiento parcial de partículas semiconductoras con elementos metálicos es, por sí mismo, un proceso de gran importancia tecnológica, ya que se utiliza en la preparación de catalizadores, sustancias que ayudan a acelerar muchas reacciones químicas tanto en el laboratorio como en la industria. También las reacciones que intervienen en la impresión y revelado de rollos fotográficos guardan estrecha relación con los procesos fotoquímicos en partículas semiconductoras. Sin embargo, el área de mayor futuro es la posible síntesis de sustancias químicas útiles como el hidrógeno y el amoniaco (NH3) a partir de materiales baratos y abundantes como el agua o el nitrógeno (N2). Hasta la fecha, los sistemas fabricados funcionan con muy baja eficiencia de conversión de energía luminosa a energía química. Esto ha hecho pensar a los científicos que, para algunas reacciones como la descomposición del agua, tal vez resulte conveniente diseñar procesos que, en lugar de buscar una transformación directa de fotón por cada electrón, se asemejen más a los mecanismos utilizados por las plantas verdes, los que involucran la absorción de dos fotones de menor energía por cada electrón generado.
Existe una teoría muy interesante que propone que fotorreacciones en partículas semiconductoras -óxido de zinc, por ejemplo- pudieron ser de gran importancia en la evolución de la vida sobre la Tierra. Se ha demostrado que la irradiación con luz solar de una mezcla que contiene amoniaco, metano (CH4), agua y polvo de TiO2 platinizado y dispersado, genera aminoácidos, que son los componentes básicos de las proteínas. Las condiciones del experimento simulan en gran medida las existentes en nuestro planeta hace cientos de miles de años.
La diferencia básica entre un sistema fotoelectroquímico y uno fotoquímico como los descritos en la sección anterior es, precisamente, la presencia de un flujo de carga eléctrica a través de un conductor externo que une las zonas anódica y catódica, separadas físicamente. Este es el mismo criterio que permite distinguir un proceso químico de uno electroquímico, ya que este último siempre conlleva una transferencia de carga eléctrica a través de una interfase electrodo-electrólito. Si en el diseño de una celda electroquímica convencional se sustituye uno o los dos electrodos metálicos por electrodos semiconductores, se pueden obtener celdas fotoelectroquímicas, ya sean de tipo galvánico o de tipo electrolítico:
a) Una celda fotoelectroquímica de tipo galvánico es aquella diseñada para transformar directamente la energía luminosa en energía eléctrica. A diferencia de una pila galvánica normal en la que los reactivos se consumen, en estos sistemas se busca que las reacciones que suceden en el cátodo y en el ánodo sean iguales pero en sentido contrario. Esto es, una sustancia O que se reduce en el cátodo, transformándose en una especie reducida R, se regenera en el ánodo, donde se lleva a cabo la oxidación de R para dar O. Dado que no hay cambio químico neto de las especies presentes, esta celda permite que la energía luminosa absorbida por el semiconductor sea utilizada directamente como trabajo eléctrico. Por este motivo, estas celdas son llamadas autorregeneradas. También, por su clara semejanza con una celda fotovoltaica tradicional, son conocidas como "fotovoltaicas de unión líquida". En general, el término "unión líquida" identifica la presencia de interfases electrólito/electrólito, lo que identifica a los sistemas fotoelectroquímicos y los distingue de los sistemas en estado sólido, como los construidos a base de silicio.
¿Será posible construir una pila galvánica común que sea autorregenerada? No, ya que esto implicaría la obtención ilimitada de energía eléctrica a partir de un sistema químico invariante: una fuente inagotable que desafortunadamente es solo un sueño, una violación al principio de conservación de la energía.
En teoría, una celda fotoelectroquímica autorregenerada parece ser el medio ideal de aprovechar la energía solar. Desafortunadamente esta idea, al llevarse a la práctica, ha puesto en evidencia una gran serie de obstáculos que hasta el momento han impedido una fabricación a gran escala. Estas dificultades serán comentadas en detalle más adelante.
Otro tipo de sistemas llamados fotogalvánicos, en vez de utilizar electrodos semiconductores como contadores de la energía solar, emplean sustancias coloridas disueltas en el electrólito. En general, se requieren dos pares redox -A/B y Y/Z por ejemplo- donde A es un colorante que puede absorber la radiación solar (¡Por esta razón tiene color!) y pasar a un estado excitado A*
Las reacciones en una celda fotogalvánica típica son:
Absorción de energía luminosa:
A ![]() A*
Reacción de óxido-reducción en la solución electrolítica
A*
Reacción de óxido-reducción en la solución electrolítica
donde A* se oxida para formar B, mientras que Z se reduce para formar el compuesto Y
En los electrodos las reacciones son:
Regeneración de la sustancia A en el cátodo:
Regeneración de la sustancia Z en el ánodo: s
Cátodo y ánodo están unidos externamente por un conducto, de tal forma que es posible obtener un flujo de carga y, por tanto, un trabajo eléctrico.
ocurriera espontáneamente en condiciones de oscuridad, se tendría una celda galvánica común. El fundamento de la celda fotogalvánica es que se requiere la energía luminosa para promover la excitación:
y es esta especie A* la que puede reaccionar con Z. Ya que, finalmente, los compuestos se regeneran, se tiene una transformación directa de energía solar a energía eléctrica sin cambio neto. Estos sistemas también presentan dificultades, especialmente por una lenta degradación de las especies químicas y por reacciones secundarias que son difíciles de evitar.
b) En las celdas fotoelectroquímicas de tipo electrolítico, el objetivo principal no es obtener corriente eléctrica sin cambio químico sino, al contrario, utilizar la energía solar para precisamente promover reacciones químicas.
Es una tendencia natural que compuestos con gran contenido energético reaccionen entre sí para generar especies de menor energía, y por esto más estables. La diferencia de energía es liberada hacia los alrededores, generalmente en forma de calor; por lo que estos procesos se denominan exotérmicos. En cambio, los procesos endotérmicos son aquellos que requieren un suministro de energía para llevarse a cabo. La energía queda entonces contenida como energía química en las sustancias producidas. Si la energía proporcionada al sistema es de origen solar se tiene que:
| Sustancias de bajo contenido energético (reactivos) | + | energía solar |
= | sustancias de alto contenido energético |
Así, la ventaja de un sistema de este tipo es que no sólo se logra la transformación de la energía solar sino que también queda almacenada en los productos obtenidos.
Uno de los procesos más estudiados, como ya se mencionó anteriormente, es la descomposición de un material abundante como el agua para obtener combustibles como el hidrógeno, de gran utilidad. Esta reacción puede obtenerse utilizando únicamente energía solar o también mediante una combinación de iluminación con potencial aplicado externamente. Este último tipo de procesos se denomina fotoasistido, ya que la energía luminosa sólo contribuye parcialmente a la generación de productos.
Las primeras celdas fotoelectroquímicas diseñadas para la reacción:
están constituidas por un electrodo semiconductor de TiO2 (dióxido de titanio) tipo n, un electrodo de platino (Pt) y una solución acuosa de sulfato de sodio (Na2 SO4). Las semiceldas se unen por un vidrio poroso que hace las mismas funciones que un puente salino.
Al ser iluminado, el semiconductor tipo n actúa como fotoánodo y se llevan a cabo dos reacciones:
1) Formación de dos pares electrón-hueco
En el electrodo de platino ocurre la reducción de los protones, liberándose hidrógeno:
El sulfato de sodio presente en la solución no interviene en la reacción y sirve tan sólo para disminuir la resistencia de la celda al paso de cargas.
El siguiente paso en el diseño de estas celdas fue sustituir el cátodo de platino por un semiconductor tipo p que actúe como fotocátodo y aproveche también la energía luminosa proporcionada al sistema. El material elegido fue el fósforo de galio (p-GaP). Al iluminar ambos electrodos, en el n-TiO2 se desprende oxígeno y en el p-Gap se genera hidrógeno. El funcionamiento de esta celda depende de que la solución acuosa contenga un ácido o un álcali. Esto se debe a que la concentración de protones (H+), mucho mayor cuando se utiliza un ácido, influye sobre los potenciales a los que se produce la reducción del protón para formar hidrógeno. Por otra parte, la eficiencia de conversión y el tiempo de vida útil de la celda dependen del tipo de electrólito utilizado. Por ejemplo, el comportamiento del p-GaP se deteriora con el tiempo de funcionamiento si se emplean electrólitos de ácido sulfúrico (H2SO4) mientras que, por el contrario, las soluciones de ácido clorhídrico (HCl) mejoran paulatinamente la fotorrespuesta del material. Esto es indicio de posibles reacciones en la superficie del semiconductor, donde éste participa activamente. Estas reacciones suelen ser perjudiciales, pues alteran la constitución química de los electrodos haciéndolos -en muchas ocasiones- inservibles.
ESTABILIDAD DE LAS CELDAS FOTOELECTROQUÍMICAS
Como se ha mencionado anteriormente, suele suceder que al tratar de pasar de un diseño teórico a una construcción real de la celda fotoelectroquímica surjan diversos obstáculos.
Uno de los principales es la marcada tendencia de muchos materiales semiconductores a reaccionar con el electrólito, especialmente en condiciones de iluminación en las que se generan los pares electrón-hueco (e-/p+). Algunos ejemplos de estas reacciones son:
Reacciones de reducción por electrones
Reacciones de oxidación por huecos
donde el símbolo (H2O) indica que las especies están disueltas en agua. Al igual que para las reacciones de óxidoreducción que se estudiaron anteriormente, a estas reacciones se puede asignar un valor de potencial estándar. Esto permite hacer predicción de reacciones en forma semejante a la utilizada en celdas electroquímicas convencionales.
ESCALA ABSOLUTA Y ESCALA CONVENCIONAL
Para estudiar las posibles reacciones entre un electrodo semiconductor y un cierto electrólito, se requiere poder ubicar ambos sistemas dentro de un marco único de referencia. En este caso, resulta necesario contar con una sola escala de energías.
Dentro de la física del estado sólido, el cero de potencial se asigna
para el electrón libre en el vacío. Por otra parte, ya se ha mencionado que
en electroquímica el cero de potencial corresponde al par redox H+/H2.
Para relacionar la escala absoluta de la física con la convencional referida
al electrodo de hidrógeno, se utiliza la siguiente regla:
| Potencial en escala absoluta | = | - | (Potencial en escala convencional +4.5 V) |
Los potenciales de algunos pares redox, en la escala absoluta seran:
| Mg2+
/ Mg0 |
-2.125V |
|
H+/H2 |
-4.50V |
| Cu2+
/ Cu0 |
-4.846V |
Si se recuerda que la tendencia natural de los electrones es "bajar" hacia niveles de menor energía, se deduce que los pares con menor potencial en escala absoluta son los que más fácilmente se reducen. Un electrón en el nivel del Mg0 tendrá una fuerte tendencia a pasar al nivel del Cu0, por lo que, si estos materiales se utilizan en una celda electroquímica, la reacción esperada será que el magnesio actúe como ánodo y el cobre como cátodo.
¿Concuerda esta afirmación con lo establecido con base en los potenciales de electrodo estándar?
La relación entre escalas es también de gran utilidad para la electroquímica con materiales semiconductores, ya que permite establecer la posición de las bandas de energía respecto a los diferentes pares redox.
La energía asociada al proceso en que un electrón se trae del vacío (energía = cero) y se incorpora a un átomo A
es, por definición, la afinidad electrónica (x) del elemento A. En el caso de semiconductores se considera que este electrón se incorpora a la banda de conducción. Por esto, el nivel inferior de esta banda (Ec) se coloca por debajo del cero absoluto, una cantidad igual a c. Si se conoce el intervalo o "ancho" de la banda prohibida (Eg), resulta entonces sencillo situar el nivel superior de la banda de valencia (Ev) ya que
Por ejemplo, para el óxido de zinc (ZnO) la afinidad electrónica es 3.9 eV y el ancho de banda prohibida es 3.2 eV. Por lo tanto, Ec y Ev estan, en la escala absoluta, a -3.9 eV y -7.1 eV respectivamente.
Con estos datos y la transformación a esta escala de los potenciales "redox"
de varios sistemas, se puede construir un diagrama como el siguiente:
| 0.0 | nivel de vacío | |||
| -3.0 | Ec | (ZnO) Potencial de reacción |
||
| -4.0 | - - - ZnO + 2H+ + 2e- |
(a) | ||
| -5.0 | ||||
| -4.5 - - -2 H+ 2e- |
(b) | |||
| -6.0 | ||||
| - - - ZnO + 2 H+ |
(c) | |||
| -7.0 | Ev | (ZnO) | ||
| - - -H2O + 2 H+ |
d) | |||
| -8.0 | ||||
Se establece, así, una relación directa entre los niveles de energía del semiconductor, los potenciales de reacciones del semiconductor con el electrólito y los de reacciones del propio electrólito. Recuérdese que los huecos (h+) tienden a "subir" y los electrones (e-) a "bajar".
Del diagrama anterior se pueden extraer varios datos: El potencial de descomposición por huecos del ZnO (reacción c) es más positivo que el potencial asociado a la oxidación del agua (reacción d). Esto significa que la reacción de descomposición está más favorecida y, por tanto, el material será inestable en estas condiciones. Recuérdese que los huecos (h+) tienden a ocupar el nivel alto posible.
Por otra parte, el potencial de reducción del H+ es más negativo que el potencial asociado a la reducción del ZnO (reacción a). Esto indica que el proceso de reducción más favorecido es el de obtención de hidrógeno y difícilmente se observará un deterioro en el semiconductor.
Se concluye, por tanto, que el ZnO podrá ser utilizado sin problemas para reacciones de reducción, pero será inestable para procesos de oxidación cuando el electrólito sea acuoso y no contenga otros pares redox. Experimentalmente se ha comprobado que en ZnO, tipo n, debido a defectos estequiométricos, al ser iluminado y actuar como fotoánodo, genera muy poco oxígeno y se deteriora rápidamente. A este fenómeno se le llama fotocorrosión.
En el párrafo anterior se indicó que las conclusiones serían válidas, en principio, si el electrólito no contenía otros pares redox. ¿A qué se debe esto?. Se debe a que la presencia de un par redox, cuyo potencial estándar quedara por encima del potencial de descomposición anódica del ZnO (reacción c), se convertiría automáticamente en el sistema favorecido para la oxidación. De hecho, esta idea ha sido utilizada ampliamente para buscar sustancias que "protejan" al semiconductor. Ya se ha mencionado que la predicción de posibles reacciones con base en un análisis comparativo de los potenciales, es únicamente una primera guía. En muchos casos, si bien una determinada reacción parece ser la más favorecida de acuerdo con los potenciales, resulta que se lleva a cabo en forma muy lenta y no es, por lo tanto, observable experimentalmente. Uno de los ejemplos más conocidos de esta situación es la reducción del ión Cr3+, cuando se utiliza un electrodo de mercurio inmerso en una solución acuosa acidulada que contiene los iones Cr3+. El potencial redox para la reacción:
tiene un valor de -0.41 V respecto al par de referencia H+/H2. Ya que la solución es acidulada se tiene la posibilidad reacción de reducción de los protones:
Esta última reacción debe ser la más favorecida en un proceso de reducción, ya que su potencial (0.0) es más positivo que el potencial del par Cr3+/Cr2+. No obstante, experimentalmente no se observa la formación de hidrógeno (H2) y lo que se obtiene es el ión Cr2+. Esto se debe a que la reducción de los protones es un proceso muy lento en la superficie de un electrodo de mercurio. Dicha lentitud hace posible la aparición de otras reacciones menos "favorecidas" desde el punto de vista energético, como es el caso de la reducción el Cr3+.
Este fenómeno también se observa en algunas reacciones que no son electroquímicas. Por ejemplo, la reacción de formación de agua a partir de hidrógeno y oxígeno:
es un proceso en el que se libera energía y que, por este motivo, debería ocurrir espontáneamente en la naturaleza. En realidad, esta reacción es tan extremadamente lenta en condiciones naturales que para todo fin práctico es como si no ocurriera. Se requiere proporcionar al sistema una gran cantidad de energía inicial (llamada energía de activación) para que la formación de agua ocurra a una velocidad apreciable.
En el caso de los semiconductores, afortunadamente muchos procesos de descomposición también son muy lentos. Esto permite el uso de estos materiales, aun en situaciones en que el análisis de potenciales indica inestabilidad.
Cuando no se cuenta con un par de redox que se oxide fácilmente, existen otras alternativas para evitar la fotocorrosión de los electrodos.
Así como en ocasiones se evita la corrosión de los metales cubriéndolos con pinturas anticorrosivas, la fotocorrosión se puede disminuir depositando una capa polimérica sobre la superficie del electrodo. Los polímeros son materiales constituidos por largas cadenas de moléculas. Algunos ejemplos muy conocidos son los plásticos, el poliuretano y el polietileno.
El silicio, de tanta utilidad en las celdas fotovoltaicas de estado sólido,
no puede ser empleado en una celda fotoelectroquímica. Al contacto con el electrólito
acuoso, el silicio reacciona formando un óxido aislante y esa capa de óxido
impide la transferencia de electrones e inutiliza el sistema. El problema se
presenta aun cuando en vez de agua se utiliza algún otro disolvente orgánico,
ya que las pequeñas trazas de agua presentes como impurezas son suficientes
para oxidar el semiconductor. Si se recubre el electrodo de Si con una película
polimérica, ésta funciona como un impermeabilizante que evita el paso del agua
hacia la superficie, y la corrosión disminuye notablemente. Sin embargo, esta
película protectora debe ser también conductora, pues de otra forma impedirá
el flujo de electrones y el electrodo será inútil. Generalmente, los polímeros
tienen baja conductividad, por lo que ha sido necesario buscar otros materiales
con buenas características de conducción. Uno de los más utilizados es el polipirrol.
Esta sustancia resulta de la oxidación de muchas moléculas de pirrol:
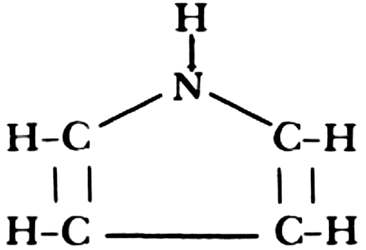 |
(1 molécula de pirrol)
|
las cuales se unen entre sí para formar cadenas de gran longitud. La oxidación se puede hacer electroquímicamente de tal forma que el silicio, actuando como ánodo, se recubre del polímero. La cantidad de polipirrol formada y, por lo tanto, el espesor de la película, se pueden controlar fácilmente mediante el tiempo de aplicación del potencial.
De acuerdo a la energía asociada a la radiación solar, el máximo aprovechamiento se logra con semiconductores cuya banda prohibida sea aproximadamente 1.6 eV. Desafortunadamente, los materiales con bandas prohibidas menores a 2 eV presentan problemas de estabilidad. Este hecho ha motivado que muchos estudios se realicen con semiconductores como el ZnO (Eg = 3.2 eV) o el TiO2 (Eg = 3.2 eV). Sin embargo, la fuerte desventaja de estos materiales es que la formación de los pares electrón-hueco requiere fotones de alta energía, cuya longitud de onda se localiza más en la región ultravioleta del espectro que en la visible. La eficiencia de conversión resulta así muy baja, ya que gran parte de la radiación ultravioleta es retenida en las capas superiores de la atmósfera. Una estrategia para superar estas dificultades consiste en recubrir el semiconductor con una película delgada de algún colorante. Esta sustancia, que obviamente absorbe radiación del espectro visible, funciona como un escalón de energía. Los electrones suministrados a la banda de conducción provendrán de la excitación del colorante y no de la formación de un par electrón-hueco en la banda de valencia. El proceso es análogo al que ocurre en los semiconductores impurificados con especies donadoras.
La obtención de una celda fotoelectroquímica de alta eficiencia, bajo costo y larga vida útil es todavía la meta por alcanzar de muchos investigadores, tanto en industrias como en instituciones de educación superior. En el siguiente capítulo se incluye una revisión de los últimos adelantos logrados en fotoelectroquímica, se presenta el desarrollo de esta ciencia y se analiza su participación dentro de las alternativas de búsqueda de nuevas fuentes de energía.
NOTAS
1 Interfase: frontera entre regiones homogéneas llamadas fases.