II. UN POCO DE HISTORIA
EN EL año de 1828 el botánico inglés Robert Brown (1773-1858)
observó que en una solución de agua el polen de cierta hierba (Clarkia pulchella)
realizaba un movimiento continuo, muy accidentado, en zigzag. El orden de magnitud
de la longitud lineal de estas partículas de polen variaba entre 5 y 6 micras
(1 micra = 0.001 mm). Brown apuntó lo siguiente:
Al examinar la forma de estas partículas inmersas
en agua, vi muchas de ellas evidentemente en movimiento; éste consistía
no solamente en un cambio de lugar en el fluido, manifestado por alteraciones
en sus posiciones relativas, sino que también, con no poca frecuencia,
por un cambio en la forma de la misma partícula [... .] En algunos casos
se veía a la partícula girar sobre su eje mayor. Estos movimientos eran
tales que me convencieron, después de observaciones repetidas, de que
no surgían de corrientes en el fluido, ni de su gradual evaporación, sino
que pertenecían a la misma partícula. |
En el mismo trabajo, Brown señalaba que otros investigadores, antes que él, ya habían notado este movimiento. En particular, menciona los trabajos de F. W. von Gleichen, realizados unos 60 años antes, y de J. T. Needham. Sin embargo, Brown fue el primero que hizo una investigación detallada del fenómeno. En primer lugar quiso saber cuál era la causa de que el polen se estuviera moviendo todo el tiempo. Como primera hipótesis de trabajo sugirió la posibilidad de que se debiera a que el polen tenía vida. En consecuencia, puso dentro de un recipiente con agua el polen de plantas que habían muerto cien años antes. Observó que este polen también realizaba el mismo tipo de movimiento. Brown relata su sorpresa de la forma siguiente: ".... me llamó la atención este hecho tan inesperado de aparente vitalidad retenida por estas moléculas tanto tiempo después de la muerte de la planta."
Posteriormente, el mismo Brown volvió a repetir sus experimentos pero utilizando pequeñísimas partículas de cuerpos inanimados, como minerales. Se dio cuenta que éstas realizaban el mismo tipo de movimiento. Más adelante repitió sus experiencias con humo, obteniendo el mismo resultado. Llegó de esta manera a la conclusión de que el movimiento no se debía a que la partícula tuviera vida.
De todo este trabajo, Brown sacó la conclusión de que tal fenómeno es característico de cualquier tipo de suspensiones en el que las partículas suspendidas tengan dimensiones muy pequeñas.
El trabajo de Brown atrajo mucho la atención de otros científicos europeos, quienes lo criticaron duramente, pues en él se proponía que el movimiento era autoanimado. Sugirieron en cambio todo tipo de explicaciónes físicas como, por ejemplo, diferencias de temperatura en el agua iluminada, evaporación, corrientes de aire, flujo de calor, capilaridad, etcétera.
El famoso físico inglés Michael Faraday defendió las ideas de Brown, señalando que este movimiento no se podía explicar por ninguna de las causas propuestas. Tanto Faraday como Brown admitieron, sin embargo, que no sabían cómo explicar este fenómeno.
Antes de continuar con nuestra historia debemos hacer un paréntesis para relatar algunos acontecimientos que se estaban llevando a cabo paralelamente.
Desde tiempos antiguos, el hombre ha estado en contacto con diversos fenómenos relacionados con el calor. Al igual que en otros casos, se intentó dar explicaciones a dichos fenómenos. Sin pretender hacer una historia detallada de este tema, solamente mencionaremos algunos puntos de interés para nuestros propósitos.
¿Cómo describir el calor? Hacia fines del siglo XVII se propuso el concepto del flogisto; éste era un fluido que los cuerpos ganaban o perdían durante la combustión y otras reacciones químicas. Se creía que el calor era un fluido imponderable. Sin embargo, hacia fines del siglo XVIII, científicos como Antoine Lavoisier (1743-1794), Joseph Black (1728-1799) y otros desecharon esta idea con base en los resultados que habían obtenido en sus experimentos. El mismo Lavoisier propuso una alternativa con la teoría del calórico. Supuso que el calórico era una sustancia que no se podía ni crear ni destruir y que era un fluido elástico. Este modelo pudo explicar adecuadamente un buen número de fenómenos familiares.
Para ese entonces Benjamín Thompson, conde de Rumford (1753-1814) se había
interesado en los fenómenos térmicos. Trabajó durante muchos años construyendo
e inventando aparatos como hornos, chimeneas, etcétera. Se dio cuenta de que
no era posible considerar al calor como una sustancia. En un célebre trabajo
hizo ver que se podía producir calor por medio de fricción. Como ejemplo mencionó
su experiencia en la perforación de cañones. Se había dado cuenta que podía
generar tanto calor como quisiera simplemente produciendo tanta fricción como
fuera necesaria. Esta experiencia la tenemos cotidianamente. Se puede calentar
tanto como queramos algún objeto simplemente haciendo que otro resbale sobre
él; aquí interviene el fenómeno de la fricción. A Rumford le llamó la atención
el hecho de que
... las fuentes de calor generadas por fricción
en estos experimentos parecían ser, evidentemente, inagotables.
No es necesario añadir que algo que cualquier cuerpo o sistema de cuerpos
aislados puede proporcionar sin limites no puede posiblemente ser
una sustancia material; me parece que es extremadamente difícil,
si no es que imposible, formarse una idea clara de algo capaz de ser excitado
y comunicado en la manera en el que el calor fue excitado y comunicado
en estos experimentos, que no sea el movimiento. |
Sin embargo, Rumford no pudo aclarar el origen de este movimiento. Fue hasta la década de 1830 a 1840 que el gran físico inglés James Prescott Joule (1818-1889) realizó una brillante serie de experimentos y pudo demostrar que el calor era una forma de energía. Asimismo, presentó uno de los primeros enunciados de la conservación de la energía. Casi simultáneamente a Joule pero de manera completamente independiente, el médico alemán Robert Mayer (1814-1878) publicó un trabajo en el que también enunció un principio de conservación de la energía. Sin embargo, se debe mencionar que los argumentos utilizados por Mayer para llegar a dicho enunciado contenían muchas generalizaciones sin base firme. Finalmente, el físico alemán Hermann von Helmholtz (1821-1894) publicó un tratamiento cuantitativo de la conservación de la energía en el que incluía también las energiás eléctrica, magnética y química.
Como resultado de estos trabajos se pudo formular entonces el siguiente principio: cuando el calor se transforma en cualquier otra forma de energía, o viceversa, la cantidad total de energía permanece constante; es decir, la cantidad de calor que desaparece es equivalente a la cantidad del otro tipo de energía en que se transforma y viceversa. Este principio se conoce como la primera ley de la termodinámica.
Consideremos ahora otro tipo de experiencias que se tienen acerca de fenómenos térmicos. Sabemos que si se ponen en contacto dos cuerpos con diferentes temperaturas, al transcurrir el tiempo el más caliente se enfría y el más frío se calienta, hasta que llega un momento en que ya no intercambian calor. Una vez alcanzado este momento, los dos cuerpos tienen la misma temperatura que permanece estable al seguir transcurriendo el tiempo. Se dice que los cuerpos en contacto han llegado a un estado de equilibrio térmico. Al observar lo anterior nos damos cuenta de que en la naturaleza los procesos ocurren en cierta dirección, a saber: el cuerpo más caliente se enfría y el más frío se calienta. En nuestra vida cotidiana hemos podido experimentar que el proceso inverso no ocurre en forma espontánea; es decir, sabemos que el cuerpo frío no se enfría más y el cuerpo caliente no se calienta más. Este último proceso no violaría la primera ley de la termodinámica y, sin embargo, no ocurre en la naturaleza.
Otro ejemplo es el siguiente: cuando un cuerpo resbala sobre una superficie rugosa, existe fricción entre ellos. La energía con la que el cuerpo se mueve, llamada energía cinética, se pierde y con el tiempo el cuerpo se detiene. Se dice entonces que la energía cinética se disipó. Esta energía se ha transformado en calor. Uno se puede dar cuenta de ello al tocar las superficies de contacto y sentir que se calientan. Esto es precisamente lo que vio Rumford. Ahora bien, la primera ley no se violaría si el cuerpo en reposo extrajera calor de la superficie con la que está en contacto, transformara este calor en energía cinética y empezara a moverse. Sin embargo, nunca observamos que esto ocurra espontáneamente.
Estos dos ejemplos ilustran un hecho muy general, según el cual los procesos que ocurren en la naturaleza solamente lo hacen en cierta dirección. El principio que nos indica la dirección en la que ocurren los procesos naturales es la segunda ley de la termodinámica.
Fueron varios los científicos que trabajaron en la elaboración de la segunda ley. Mencionaremos solamente a Sadi Carnot (1796-1832), William Thomson, lord Kelvin (1824-1907), B. P. Clapeyron y, finalmente, a Rudolf Clausius (1822-1888), quien hacia 1850 le dio la formulación final.
Una observación muy importante, que tiene gran relevancia para nuestros propósitos, es que las dos leyes de la termodinámica arriba mencionadas se obtuvieron y se aclararon sin la necesidad de establecer o definir en ningún momento de qué estaba hecha la materia. Fueron obtenidas a partir de propiedades y comportamientos macroscópicos de las sustancias.
Las leyes de la termodinámica fueron aceptadas y aplicadas en diversos campos tanto de la ciencia como de la ingeniería. Se puede afirmar que estas leyes tuvieron un fuerte efecto en la Revolución Industrial del siglo X1X. Se aplicaron intensamente en diseños de máquinas de vapor, en diversos procesos químicos, etcétera. El enorme atractivo que tenían era su gran simplicidad y amplio campo de validez.
Desde la antigüedad griega muchos pensadores elucubraron acerca de la composición de la materia. Diversas hipótesis se propusieron, sin que, en general, tuvieran verdaderas bases científicas. Además, estas hipótesis tampoco fueron aceptadas en general. De hecho, fue hasta principios del siglo XIX que, con los trabajos de John Dalton (1766-1844), se empezaron a dar los primeros pasos serios en el estudio de la estructura atómica de la materia. Posteriormente también contribuyeron de manera muy importante científicos como Joseph L. Gay-Lussac (1778-1850). Amedeo Avogadro (1776-1856) y Jöns Jacob Berzelius (1779-1848). Hacia mediados del siglo pasado ya se tenía un cuerpo de teoría adecuado, aunque incompleto, que implicaba que la materia estaba compuesta de partículas microscópicas, llamadas átomos. Debemos mencionar que de ninguna manera esta hipótesis fue aceptada en esa época por la mayoría de los científicos activos. De hecho fueron relativamente pocos los que así lo hicieron.
Hacia mediados del siglo XIX se enfrentaba la siguiente situación: por un lado, se habían planteado las leyes de la termodinámica que, como podemos recordar, se refieren a aspectos macroscópicos del comportamiento de las sustancias; y, por el otro lado, se vislumbraba cada vez con mayor claridad que la materia estaba compuesta de átomos. Surgió entonces la necesidad de conciliar estos dos conocimientos. Dicho en otras palabras, se planteaba la siguiente cuestión: era si la materia, en efecto, está compuesta de partículas microscópicas, ¿qué consecuencias macroscópicas tiene el comportamiento microscópico de una sustancia?
Esta pregunta ya se había planteado desde el siglo XVII, entre otros por Robert Boyle (1627-1691). En el siglo XVIII continuaron trabajando en ello Leonhard Euler (1707-1783) y Daniel Bernoulli (1700-1782). Estos estudiosos obtuvieron algunas consecuencias a las que, sin embargo, no se les prestó la debida atención ya que por un lado, entonces no se aceptaba la hipótesis atómica y, por el otro, muchos de los conceptos utilizados eran bastante oscuros. Fue en la primera mitad del siglo XIX cuando se empezaron a dar los primeros pasos en firme. Varios trabajos de J. Herapath presentados alrededor de 1820 y de J. J. Waterston alrededor de 1845 retomaron la cuestión. Sin embargo, fue hasta mediados de siglo en que este tipo de teoría tuvo un feliz renacimiento. En efecto, entre 1850 y 1875 August Krönig (1822-1879), Rudolf Clausius, James C. Maxwell (1831-1879) y Ludwig Boltzmann (1844-1906) desarrollaron las bases de la moderna teoría cinética de la materia. Supusieron que las sustancias estaban compuestas de átomos y a partir de su comportamiento microscópico obtuvieron como consecuencia algunas propiedades macroscópicas. En particular, pudieron fundamentar varios resultados que ya se conocían en termodinámica y explicar diversos fenómenos. Calcularon, por ejemplo, propiedades tales como el calor específico, la conductividad térmica y la viscosidad de gases poco densos y todo ello en términos de propiedades de los átomos que los constituyen.
Asimismo, hemos de mencionar que, entre otras cosas, Maxwell obtuvo también como resultado de sus trabajos la distribución de las velocidades de los átomos en un gas en equilibrio. Esta cantidad indica cuántos átomos de un gas tienen un cierto valor de velocidad. Así, se puede saber cuál es la velocidad que tiene la mayoría de los átomos. Maxwell explicó la forma en que esta distribución depende de la temperatura del gas, de la masa de sus átomos, etcétera. A esta distribución se le llama maxwelliana. El mismo Maxwell realizó varios experimentos en los que verificó las predicciones teóricas hechas para la conductividad y la viscosidad de un gas poco denso. Fue años después que se verificó experimentalmente que un gas en equilibrio, efectivamente, tiene la distribución de velocidades predicha por Maxwell.
REGRESAMOS AL MOVIMIENTO BROWNIANO
Después de este breve paréntesis regresemos a nuestra reseña de la historia del movimiento browniano.
Durante las tres siguientes décadas posteriores al trabajo de Brown, el interés por el movimiento browniano, que fue bautizado así en honor del botánico inglés, decayó. Casi nadie se dedicó a explicarlo o a investigarlo más.
Posteriormente, diversos investigadores estudiaron este movimiento. Entre ellos se puede mencionar a Christian Wiener (1863), Giovanni Cantoni y S. Oehl (1865) y a G. L Gouy (1889). Hacía mediados del siglo XIX se habían formado muchas hipótesis acerca de las causas del movimiento; sin embargo, con las observaciones experimentales varias de las hipótesis fueron eliminadas. En particular se pudo probar de manera contundente que este movimiento no se debía a que hubiera diferencias de temperatura entre dos regiones del espacio. El movimiento browniano se presenta también cuando la temperatura es la misma en todos los puntos del fluido. Asimismo, se desechó la hipótesis de que el zigzag se debía a fuerzas capilares, ya que también ocurría en recipientes muy grandes en los cuales dichas fuerzas no se manifiestan. Cantoni y Oehl mantuvieron sellada herméticamente una suspensión durante un año y encontraron que el movimiento browniano de las partículas no se alteró en ese intervalo.
En 1863 Wiener formuló varios argumentos para mostrar que el movimiento browniano no podía atribuirse a causas externas, sino que tenía que deberse a movimientos internos del fluido. Asimismo, Cantoni lo atribuyó a movimientos térmicos en el líquido, y consideró que este fenómeno nos daba una demostración experimental, bella y directa, de los principios fundamentales de la teoría mecánica del calor". con esto se refería a la relación entre calor y movimiento, que aún en esas épocas no estaba suficientemente clara. De esta forma, durante la década de 1870 se expresó cada vez más frecuentemente la opinión de que el movimiento browniano estaba, de alguna manera, relacionado con el calor.
Por otro lado, como se relató, en esos tiempos ya se hablaba de que las partículas que componían las sustancias se movían. De hecho, Maxwell ya había estimado sus velocidades. Algunas personas consideraron la posibilidad de que el movimiento browniano fuera causado por las colisiones de los átomos del fluido con la partícula inmersa en él. El botánico alemán Karl Nägeli publicó un trabajo en 1879 en el que trató de probar que este mecanismo no podía ser el causante del movimiento browniano. Para llo, usó las estimaciones de las masas y velocidades de los atómos que se habían obtenido de la teoría cinética para calcular los cambios en la velocidad que experimentaría la partícula browniana después de una colisión con un átomo del fluido. Obtuvo que estos cambios deberían tener valores extremadamente pequeños, por lo que concluyó que ésta no podía ser la causa del fenómeno. El químico inglés William Ramsay llegó, casi simultáneamente, a la misma conclusión.
El argumento que daban era muy sencillo. Si, como es el caso, la partícula inmersa en el fluido tiene una masa mucho mayor que la de un átomo del fluido (Figura 2), entonces al chocar estas dos partículas, la partícula masiva casi no es afectada por el choque. En particular, Nägeli usó los valores apropiados para hongos que introdujo en un gas: la masa del hongo era 300 millones de veces más grande que la de la molécula del gas.
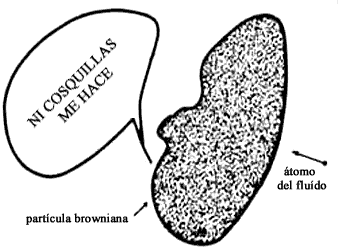
Figura 2. Colisión de un átomo del fluido con la partícula browniana.
Otro científico interesado en el fenómeno fue el francés Léon Gouy que hizo diversos experimentos de los que concluyó que la vivacidad y agilidad mostrada por las partículas aumentaba a medida que el tamaño de la partícula era menor; asimismo, esta vivacidad aumentaba a medida que la viscosidad del líquido en que se metían las partículas disminuía.
Gouy también descartó la posibilidad de explicar este movimiento con base en colisiones con los átomos del fluido. Sin embargo, Gouy hizo la importante sugerencia de que el movimiento browniano podría ser una violación a la segunda ley de la termodinámica. El argumento que daba era que, al moverse la partícula en el fluido, en lugar de disipar su energía cinética en calor debido a la fricción entre ellos (la viscosidad entre el fluido y la partícula) ocurría que en ciertos momentos la velocidad de la partícula ¡aumentaba! Esto significaba que de alguna manera la partícula extraía energía calorífica del fluido y la transformaba en energía cinética.
Aún a principios del siglo XX la teoría de la composición atómica de la materia se encontró bajo muy fuertes ataques. En particular, la teoría era puesta en duda por los integrantes de la llamada escuela energética, como G. Helm, Ernst Mach (1838-1916), Wilhelm Ostwald (1853-1932) y P. Duhem. Ellos sostenían que había muchas contradicciones entre las conclusiones de las teorías atómicas por un lado y las obtenidas de las leyes de la termodinámica, por el otro. Propusieron rechazar de plano las teorías atómica y cinética de la materia y quedarse solamente con las leyes de la termodinámica.
En resumen, podemos decir que en los primeros años del siglo XX la situación era la siguiente: por una parte, no se tenía una explicación firme y clara de las causas del movimiento browniano; al contrario, lo que se tenía era un panorama muy confuso y contradictorio. Por otro lado, un gran número de importantes científicos no aceptaba la hipótesis de la constitución atómica de la materia. Ellos abogaban por la tesis según la cual no era necesario desarrollar una teoría microscópica de las propiedades de la materia (o sea, la teoría cinética) sino que las leyes de la termodinámica eran suficientes, pues contenían toda la información necesaria sobre un sistema físico. Además, así se evitarían todas las inconsistencias y paradojas que aparentemente contenía la teoría atómica.