APÉNDICE II
ECUACIONES PARA LA PRESIÓN OSMÓTICA
En el caso de dos soluciones con dos componentes (A y B) en equilibrio a través de una membrana permeable al componente A e impermeable al componente B se tiene que
|
CBDmB=
DPeq
|
(1)
|
|
DmA=
0
|
(2)
|
Las dos ecuaciones contienen básicamente la misma información. Para demostrarlo,
se utilizará la expresión para el potencial químico,
|
Dmi
= RTD Lnai
+ Vi Dp
|
(3)
|
donde ai
es la actividad y Vi es el volumen molar parcial del
componente i. Sustituyendo la ecuación (3) en la ecuación (1) y considerando
el equilibrio, tenemos que:
|
CBDmB
= RTCBDLnaB
+ CBVBDPeq
|
(4)
|
Por otra parte, la ecuación de Gibbs-Duhem establece que
|
CBDLnaB
= — CADLnaA
|
(5)
|
con lo cual, la ecuación (4) se puede escribir
|
CBDmB
= — CARTDLnaA
+ VBCBDPeq=DPeq
|
|
— RTCADLnaA
— (1 — CBVB)DPeq
= 0
|
(6)
|
Dado que CA VA
= l — CBVB
se tiene que (6) se escribe como
|
RT DLnaA
+ VADPeq=0
|
(7)
|
Lo que de acuerdo con la ecuación (3), lleva a la ecuación (2). La presión osmótica
puede estimarse de acuerdo a la ecuación (7)
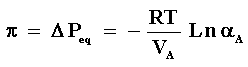 |
(8)
|
En el caso particular de que tomemos en cuenta una solución diluida, el logaritmo
de la actividad del solvente en solución puede escribirse como el negativo de
la fracción de moles de cada componente en la solución.
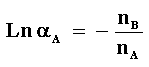
donde nA es el número de moles del
solvente en la solución y nB el número
de moles del soluto. Ahora bien, V = VAnA
es el volumen total y la ecuación (8) se convierte en
|
pV= nB
RT.
|
(9)
|
Es la ecuación de Van't Hoff que muestra la semejanza de la presión osmótica con la presión de un gas ideal.