V. ELECTROÓSMOSIS Y ÓSMOSIS ANÓMALA
EN EL capítulo anterior ha quedado establecido que en presencia
de dos fuerzas termodinámica (DCB)
y (DP) se producen dos flujos directos
cruzados, los cuales dan lugar a las ecuaciones (l) y (2).
|
Flujo del
|
= |
Flujo
|
+
|
Contribución por
|
(1)
|
|
soluto (B)
|
difusión
|
Flujo volumétrico
|
|
Flujo
|
= |
Flujo de
|
+
|
Flujo
|
(2)
|
|
volumétrico
|
Poiseuille
|
osmótico
|
Cuando se tiene una membrana rodeada por baños que sean soluciones electrolíticas,
aparecerá una nueva fuerza termodinámica dada por una diferencia de potencial.
En tal caso, el formalismo de las ecuaciones (1) y (2) se modifica para incluir
un término nuevo en cada ecuación. Además de esto, aparece una tercera ecuación
para el flujo de cargas. Habiendo tres fuerzas termodinámicas, hay tres flujos
directos y seis flujos indirectos o cruzados, como se observa en la figura 5
o en el cuadro 2.
La ecuación (2) se modifica por un término proporcional a Df el cual predice la presencia de un flujo volumétrico producido por un campo eléctrico en la membrana. A este efecto se le conoce como "electroósmosis". A su vez, la ecuación (1) debe cambiar para incluir un término adicional que represente un efecto difusivo originado por el campo eléctrico, debido a la diferencia de potenciales a través de la membrana. Este efecto eléctrico en la difusión fue considerado por M. Planck en 1890 y por W. Nernst en 1904 en términos de una ecuación hoy conocida con el nombre de Nernst-Planck. Este efecto eléctrico en la difusión no es directo, sino cruzado (véase el cuadro 2).
En el cuadro 2 se observa la matriz de los efectos directos y cruzados producidos
por la presencia de las tres fuerzas de transporte (DCB,D
P y Df). Los efectos directos
se presentan en los cuadros que aparecen en la diagonal, y los efectos cruzados
o secundarios se muestran en los cuadros fuera de la diagonal. Entre estos últimos
se encuentra la ósmosis y su efecto recíproco dado por el arrastre viscoso de
solutos por el flujo volumétrico. Este efecto se excluye en el caso de una membrana
semipermeable. La electroósmosis sigue un papel muy semejante al de la ósmosis.
Una diferencia de potencial a través de la membrana produce acumulación de iones
en ambas caras de ella y, como en el caso de la ósmosis, se produce un flujo
volumétrico. El efecto recíproco consiste en que un flujo volumétrico produce
por agregación una concentración de iones en la vecindad de la membrana, que
producirá una diferencia de potencial. Esto puede ocurrir sin necesidad de alterar
la neutralidad eléctrica de los baños alrededor de la membrana. Un efecto semejante,
coadyuvando en la formación de la capa polar, es dado por difusión; que corresponde
al efecto cruzado mostrado en el cuadro central inferior de la matriz del cuadro
2. Esta clase de efecto, de polarización por concentración, es capaz de contrarrestar,
a tal grado, el efecto de la diferencia de presiones que es posible invertir
la dirección del flujo volumétrico. A este fenómeno se le llama "ósmosis anómala"
y fue estudiado por E. Grim y K. Sollner en 1957, considerando membranas compuestas.
La descripción de este efecto señala una inversión del signo en el coeficiente
de reflexión de Staverman. El caso de una polarización por concentración por
difusión fue estudiado por Sollner y Neihof en 1955, y encontraron que una composición
de membranas en presencia de iones se puede comportar como un diodo semiconductor
con dirección preferente.
 |
,p,p,p,
Diferencia de presiones (DP) |
Diferencia de concentraciones de soluto (DC)B
|
(Df) |
|
Flujo de solvente
|
Flujo volumétrico
|
Ósmosis
|
Electroósmosis
|
|
Flujo de solutos —moléculas neutras—
|
Arrastre de solutos por flujo volumétrico
|
Difusión de Fick
|
Difusión de Nernst-Plank
|
|
Flujo de solutos —iones—
|
Polarización por acumulación de cargas
(vía flujo volumétrico)
|
Polarización por concentración (vía
flujo de difusión)
|
Corriente eléctrica (Ley de Ohm)
|
La electroósmosis se verifica en la membrana de la célula, donde flujos masivos
de agua se deben a concentraciones de cargas en ausencia de una diferencia de
presiones. Estos acoplamientos son independientes del transporte activo1
a través de membranas biológicas.
La electroforesis representa el caso de polarización por concentración en la
que hay simetría de los efectos cruzados. Lo que ocurre es que los efectos de
concentración son a su vez originados por la movilidad de iones hacia los electrodos
de signos opuestos. En cambio, la simetría de la difusión iónica se rompe por
medio de una membrana, que ocurre en los casos de baterías alcalinas. En esta
forma se permite el paso de algunos iones (radicales sulfato, por ejemplo) y
se impide el tránsito de otros iones como los de cobre, tal como se muestra
en la figura 8. En electroquímica, se utilizan membranas semipermeables y selectivas
como barreras de la difusión, para reducir la movilidad de constituyentes electrolíticos
y alargar la vida media de las baterías.
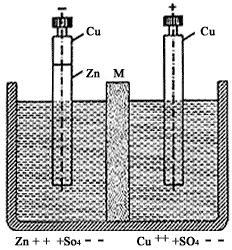
Figura 8. Diagrama esquemático de una celda de batería inventada por
Daniell en 1836. La membrana semipermeable (M) impide la mezcla de las dos soluciones
en los dos recipientes contiguos, impide el depósito de iones de cobre (Cu)
sobre el electrodo de zinc (Zn) y permite el paso de los iones de sulfato(SO
4--).
Es necesario aclarar que los cambios en el tiempo de las variables de estado
en estos sistemas determinan su evolución al equilibrio. Si la membrana es abierta,
permitiendo el libre tránsito de iones y moléculas neutras de un lado y otro
de la membrana, entonces la situación final de equilibrio observará que todas
las diferencias se cancelan, DC = 0
En el caso de membranas semipermeables que impiden el paso de algunas moléculas
neutras y de algunos iones, el equilibrio será dado por la presión osmótica
modificada por el efecto de los potenciales de Donnan. Este equilibrio es conocido,
en igual forma, como equilibrio de Donnan.
Este caso de equilibrio fue descubierto en 1911 por el químico británico Frederich George Donnan (1870-1956), desde entonces se sabe que en el equilibrio de sistemas electrolíticos con membranas semipermeables, los flujos iónicos causados por potenciales electrostáticos y los flujos difusivos causados por gradientes de concentraciones, se cancelan mutuamente.
En todo lo que se ha mencionado en los últimos capítulos, se ha considerado que el sistema es isotérmico, y que por ningún concepto se preveen cambios en la temperatura en las distintas porciones del sistema. Desde luego que esto es una posibilidad que queda contemplada dentro del formulismo de la teoría irreversible lineal, ya que una diferencia de temperatura es, en efecto, una fuerza termodinámica. Si esta fuerza la agregamos a la descripción formal de la misma manera como se ha introducido la diferencia de potencial, el arreglo del cuadro 2 se convierte en un arreglo de 4 X 4 efectos, tal como se aprecia en el cuadro 3. De todos los efectos mostrados en el cuadro 3, cuatro son directos y se indican en diagonal (de izquierda a derecha y en orden descendente), y los 12 restantes son efectos cruzados y se localizan en los cuadros que están fuera de la diagonal. Por otra parte también hay un sistema de cuatro ecuaciones de transporte, una para cada uno de los flujos mostrados en los diferentes tipos de acoplamiento entre flujos y fuerzas. El efecto equivalente al electroosmótico es el llamado de termoósmosis, y representa el caso en que una diferencia de temperatura motiva un flujo volumétrico. El acoplamiento entre los efectos cruzados puede ser de superposición o de interferencia mutua, de manera que la descripción de la situación de equilibrio resulta complicada.
| Diferencia de presiones (DP) |
Diferencia de concentraciones de soluto (DC)B
|
Diferencia de potencial eléctrico (Df) |
Diferencia de temperatura (DT)
|
|
|
Flujo de solvente
|
Flujo volumétrico
|
Ósmosis
|
Electroósmosis
|
Termoósmosis
|
|
Flujo de solutos —moléculas neutras—
|
Arrastre de solutos por flujo volumétrico
|
Difusión de Fick
|
Difusión de Nernst-Plank
|
Termodifusión Soret
|
|
Flujo de solutos —iones—
|
Polarización por acumulación de cargas
(vía flujo volumétrico)
|
Polarización por concentración (vía
flujo de difusión)
|
Corriente eléctrica (Ley de Ohm)
|
Termoeléctricidad Thomson
|
|
Flujo de calor
|
Flujo Térmico Joule-Thomson
|
Difusión térmica. Dufour
|
Termoeléctricidad. Electropirosis
|
Conducción térmica. Fourier
|
En el caso de sistemas biológicos, la temperatura, como variable de estado,
juega un papel importante y su regulación se observa en la escala global de
un organismo animal o vegetal. Por ejemplo, en una elevación o una disminución
de la temperatura de 25 a 30 grados centígrados sobre el valor medio de la temperatura
ambiente, los efectos térmicos se contraponen a los osmóticos, de tal manera
que se arriesga la sobrevivencia de los organismos, sobre todo la de las plantas,
que dependen básicamente de la ósmosis para la realización de sus procesos vitales.
NOTAS
1 El transporte activo no sigue el comportamiento termodinámico irreversible lineal.