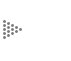VI. EXPLICACIÓN DEL FENÓMENO OSMÓTICO
DESDE el descubrimiento de la ósmosis por Dutrochet en 1828, hasta
su explicación racional por Kedem y Katchalsky en 1958, transcurrieron 130 años
en que se debatió la naturaleza del flujo osmótico. Todavía a finales de los
años cincuenta, se discutió si el flujo osmótico era un flujo de difusión del
solvente originado por una diferencia de potenciales químicos o un flujo viscoso
semejante al producido por una diferencia de presiones hidrostáticas. A pesar
de que esta última cuestión había sido ya resuelta en 1908 por Hartley, volvió
a verificarse en los años de 1957 a 1960, cuando A. Mauro demostró que una diferencia
de presión osmótica produce en efecto un flujo de igual magnitud al producido
por una diferencia de presiones hidrostáticas. En esta forma, la discusión parecía
quedar resuelta; no obstante, se comprueba luego que tal desacuerdo no era en
realidad de fondo, sino sólo de tipo formal, ya que la distinción entre flujo
de difusión y flujo osmótico es arbitraria.
A este respecto se recuerdan las palabras de L. Onsager (1945): "El flujo viscoso es un movimiento relativo de las porciones adyacentes de un líquido. La difusión es un movimiento relativo de sus diferentes constituyentes. Estrictamente hablando, los dos flujos son inseparables, ya que la velocidad hidrodinámica en una mezcla difusiva es meramente un promedio determinado por medio de una convención arbitraria."
Ello significa que podemos escribir la ecuación de transporte para el solvente como una ecuación de difusión, donde el coeficiente correspondiente de difusión se modifica cuantitativamente para incluir el efecto osmótico. Esto mismo quedó explicado en el trabajo de D. C. Mikulecky y S. R Caplan en 1966, al observar que el flujo osmótico podría depender de un cambio en el sistema de referencia. Con lo que se hace ver que el flujo osmótico aparecerá o no en las ecuaciones, dependiendo del sistema del observador. Esto no representa más complicaciones que la aceptación de que las ecuaciones de transporte pueden escribirse de muchas maneras equivalentes y son los coeficientes de transporte los que cambian de significado. Esta situación, en el caso del flujo osmótico, hace estimar que su identificación no puede ser única. A pesar de que esta objeción es fundamentalmente correcta, la mayoría de los autores han insistido en la descripción por separado del flujo osmótico y se preguntan por el mecanismo que lo produce. De manera que, habiendo establecido una identificación hidrodinámica del flujo osmótico a fines de los años cincuenta, en los primeros años de la siguiente década surgió una discusión sobre el mecanismo que produce el fenómeno osmótico. El problema que se planteó entonces era explicar la mecánica donde una diferencia de concentraciones a través de una membrana produce un flujo equivalente al producido por una caída de presiones. Esta dificultad no había tenido una explicación directa en más de 130 años y tampoco pareció obvia, porque jamás se midió una diferencia de presiones asociada en forma directa al flujo osmótico. La interpretación que se dio entonces fue que esa caída de presión no podrá medirse porque ocurre justamente en el interior de la membrana. Es decir, la función de la membrana es resistir internamente una caída de presión. Discusiones de este tipo fueron realizadas por A. Mauro (1960), L. G. Longsworth (1960), P. Mears (1966) y J. R. Philip (1969). Los trabajos de Mauro y Longsworth fueron analizados respectivamente por Onsager y John Kirwood, dos genios de las teorías de los fenómenos de transporte. De aquí se ha derivado la única explicación que se conoce hasta la fecha del mecanismo por el que ocurre el fenómeno osmótico. Esta explicación se proporcionará a continuación y para facilidad del lector se divide en tres momentos, de acuerdo a la secuencia gráfica siguiente:
a) En una membrana semipermeable existe la reflexión total de las moléculas del soluto y la transmisión parcial de las moléculas del solvente. Esta restricción ocurre básicamente cuando el fluido entra a la membrana entre las porciones abiertas (poros).
En la figura 9, la fase I representa una solución concentrada (C') y la fase
III representa una solución diluida (C"). La discontinuidad que observa la interfase
frente a la membrana se debe a que esta capa es de unos cuantos diámetros moleculares,
por lo que macroscópicamente se observará una caída brusca en los valores de
la concentración de la fase 1 al acercarse a la membrana (fase II).
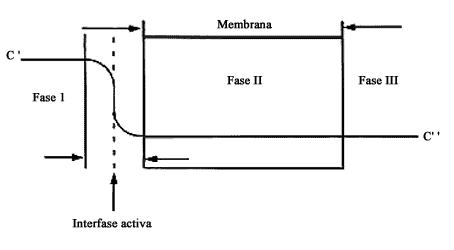
Figura 9. En una membrana semipermeable hay una interfase frente a la membrana
que representa una discontinuidad en la concentración.
b) La interfase conlleva también una disminución en el valor de la presión.
Este cambio se debe particularmente a una alteración local de la cantidad de
movimiento, debido a la presencia de una asimetría por la exclusión del soluto
(figura 10).
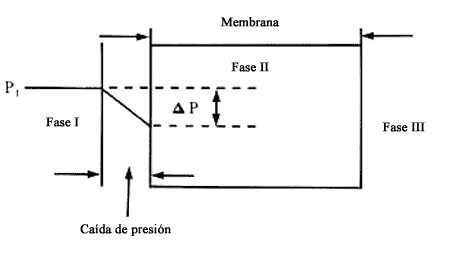
c) La caída de presión en la interfase puede manifestarse de tres maneras distintas:
Para cancelar el déficit de presión en la interfase, es necesario aplicar un
exceso de presión a la fase I, dando juntamente por el valor DP,
para que al producirse la caída en la interfase no exista una diferencia de
los valores de la presión entre los fluidos de la interfase y los de la fase
II. Es de reconocerse que dicho exceso de presión es necesario para mantener
el equilibrio y por definición corresponderá al valor de la presión osmótica
(figura 11).
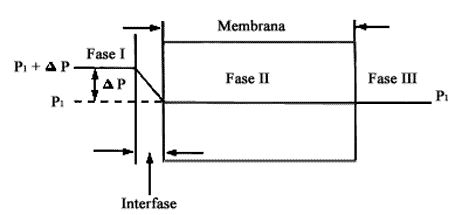
Figura 11. Es necesario aplicar un exceso de presión P a la fase concentrada
para mantener el equilibrio.
Si los valores de las concentraciones de las fases I y III se mantienen constantes, sosteniendo la misma presión (p) en dichas fases, no habrá ese exceso de presión para mantener el equilibrio y encontraremos entonces un flujo de solvente, debido a que en una cara de la membrana (punto a de la figura 12) hay una presión que es menor al valor P1 en la cara opuesta. Este flujo produce una caída cuando el flujo es de tipo viscoso (de Poiseuille). Este es precisamente el flujo osmótico.
De acuerdo a la figura 12 no se mide ninguna diferencia de presiones entre
las fases I y III, sin embargo, hay un flujo osmótico. La única diferencia que
experimentalmente se aprecia es la de concentraciones. El valor del flujo osmótico
es tal, como el diámetro del poro de la membrana, su longitud y la viscosidad
del fluido permitan una caída de presión que compense exactamente el déficit
de presión en la interfase.
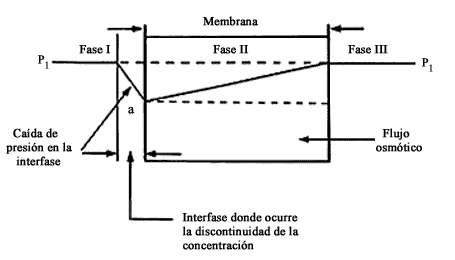
Figura 12. Experimento en estado estacionario donde a ambos lados de la
membrana no hay una diferencia de presiones.
Si el sistema de las tres fases es cerrado, de manera que no se permita el
flujo osmótico, entonces la caída de presión en la interfase se manifestará
como una tensión negativa en la fase III. Es decir, el déficit de presión se
propaga de la interfase al solvente de la fase II, y de ahí a la fase III (V.
figura 13).
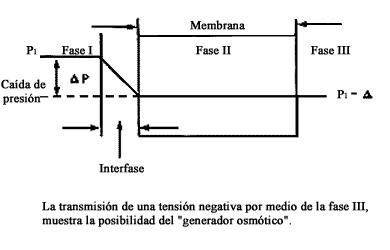
Figura 13. La Fase III se encuentra en un estado de equilibrio metaestable,
sujeta a una tensión negativa.
La tensión negativa en la fase III se manifiesta en cuanto a que una partícula de fluido atrae hacia sí a la partícula vecina y así, nuevamente se transmite una capacidad de absorción. El descubrimiento de este estado de los líquidos no es nuevo; históricamente Young y Laplace en 1805 trataron de explicar tales estados en términos de las fuerzas de cohesión. Actualmente se busca una explicación en términos de estados metaestables, descritos por una ecuación de estado.
En nuestro caso, lo importante de un sistema cerrado es que la tensión negativa puede transmitirse a un punto distante de su producción en la interfase por medio de la fase III. Esto significa la posibilidad de hacer un trabajo cuando la fase III se ponga en contacto con otro dispositivo poroso, donde aparece el intercambio del solvente y se genera finalmente el flujo osmótico.
Esta capacidad de la ósmosis para realizar un trabajo ha sido considerado como una posibilidad de obtener dispositivos generadores de energía. Hasta ahora se trata de una "buena posibilidad", pues su realización en el campo de las aplicaciones tecnológicas no ha proporcionado algún motor que involucre un ciclo de este tipo. La dificultad de esta aplicación estriba en que los procesos de la ósmosis son lentos, pero tienen la ventaja de integrar presiones altas, como las indicadas en el osmómetro de Frazer de 273 atmósferas. Por otra parte, parece ser que en el caso de los vegetales hay un ciclo de este tipo. Refiriéndonos a la figura 13, la fase 1 y la membrana se encuentran en las hojas, donde se genera la tensión negativa o de absorción.
La savia juega el papel de la fase III, que se encuentra en un estado metaestable debido a que el vegetal representa en sí un sistema cerrado. La savia constituye un sistema continuo y transmite esa tensión negativa hacia la raíces. Es en las raíces donde, a través de un sistema de membranas, se hace posible la utilización de la tensión negativa dando lugar a una absorción efectiva de humedad y haciéndose un trabajo en contra de las fuerzas de adherencia de la matriz de los suelos. La tensión en que se encuentra la savia se puede medir y en algunos casos se reportan valores de 80 atmósferas para árboles en el desierto. Del estado metaestable en membranas seguiremos exponiéndolo en el capítulo VIII.
Ahora bien, recapitulando sobre el mecanismo de origen del flujo osmótico, es de llamar la atención su identificación con el flujo viscoso. Esto hace posible la explicación dada en la figura 12, con objeto de que la caída de presión de la interfase no se manifiesta exteriormente. Esta idea se plantea un tanto diferente en el caso de otros sistemas que se comporten como membranas semipermeables. Por ejemplo, cuando se unen dos soluciones de H³e y H4e a temperaturas por abajo del punto l por medio de un capilar finísimo, el fenómeno osmótico se presenta cuando el H4e superfluido atraviesa el capilar y al componente H3e se le impide fluir. En este caso, tenemos que lo expuesto en la figura 12 no se obtiene, pues el H4e superfluido no presenta el fenómeno de viscosidad cuando se desplaza a través del capilar.
Con esta circunstancia, a pesar de contar con un flujo osmótico existe una situación parecida a la presentada en la figura 13; por lo que hay que contemplar la posibilidad de realizar un trabajo en otra parte del sistema, con la finalidad de llevarlo hasta el equilibrio. Una cantidad de trabajo puede realizarse por medio de la elevación de una columna de fluido sobre la superficie libre de la solución concentrada. En esta forma, se salva la generalidad del mecanismo que produce el flujo osmótico.