VII. REGRESANDO A LOS CRISTALES Y OTRAS COSAS MÁS
UNA vez descubierto el hecho de que los cristales pueden difractar
rayos X, se inició una gran actividad en este nuevo campo.
En particular, W. L. Bragg, en Inglaterra desarrolló una explicación alternativa
a la de Laue, que resultó ser más sencilla.
Debido a la primera Guerra Mundial (1914-1918) hubo un paréntesis en que prácticamente se suspendieron los trabajos de investigación en los países participantes en la contienda. Sin embargo, hacia los primeros años de la década de 1920 ya se habían determinado las estructuras de un buen número de materiales inorgánicos. Posteriormente, ya entrada la misma década, se analizaron con éxito cristales inorgánicos más complejos; después de 1930 se encontraron estructuras de cristales orgánicos.
Al transcurrir el tiempo se fueron desarrollando técnicas cada vez más refinadas
para poder encontrar la estructura de una sustancia a partir de los patrones
de difracción de rayos X que producen. Es claro que diferentes
estructuras producen distintos patrones de difracción. En la figura 20 se ilustra
esta afirmación. Se presentan en ella, del lado izquierdo, los arreglos de átomos
en una estructura, y en el lado derecho el patrón de difracción de rayos X
que produce. En forma análoga a lo que ocurre con la difracción de una rejilla
con distinto número de rendijas, vemos que a medida que el número de átomos
aumenta las imágenes que se producen van siendo más marcadas. En la sucesión
mostrada en la figura 19 se han colocado los átomos en forma regular y ordenada.
Es interesante notar cómo los patrones van cambiando y que en forma análoga
a lo que ocurre al difractarse luz visible en rejillas con varias rendijas (véase
la sucesión de la Figura 13), ahora los rayos X difractados
adquieren patrones que se van haciendo más y más puntuales a medida que los
elementos de la rejilla aumentan. Por supuesto, estos elementos son los átomos
que componen el cristal. Como en el caso de la luz visible, los patrones de
difracción se van volviendo más nítidos (Figura 13).
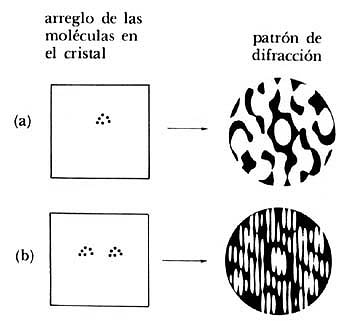
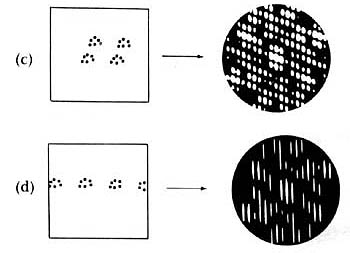
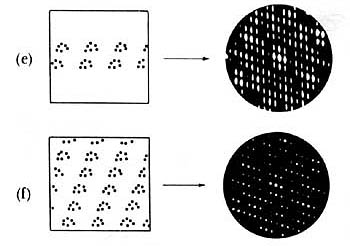
Figura 19. Distintos arreglos de las moléculas en un cristal dan lugar a diferentes
patrones de difracción.
Si se cambian tanto las distancias como la colocación geométrica de los átomos, entonces el patrón de difracción que resulta también se modifica.
Mencionaremos algunos resultados obtenidos para varias estructuras cristalinas.
En primer lugar, consideremos el cloruro de sodio NaCl, que es la bien
conocida sal de mesa común. Este compuesto está formado de dos átomos: sodio
y cloro. El análisis de la difracción de rayos X por el cloruro
de sodio muestra que tiene una estructura cristalina cúbica en la que los átomos
de cloro y sodio se encuentran dispuestos en forma alternada, como se muestra
en la Figura 20(a). Este arreglo se repite con la misma orientación a lo largo
de toda la sustancia formando la red cristalina. Se encuentra que la longitud
del lado del cubo que se acaba de mencionar es de 5.63 Å. La estructura
que tiene el cloruro de sodio es característica también de la mayoría de los
halogenuros alcalinos como el bromuro de potasio KBr (con longitud de
la arista de su cubo igual a 6.59 Å), así como de otros compuestos
como el bromuro de plata AgBr (con longitud de 5.77 Å),
el óxido de uranio UO (4.92 Å), etcétera.
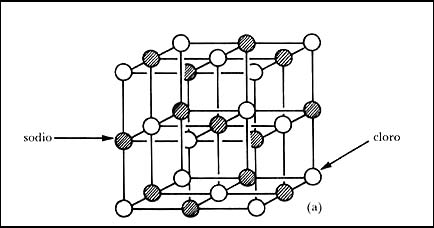
Figura 20. Estructuras de diversos cristales obtenidas por análisis de difracción
de rayos X: (a) cloruro de sodio, cúbica.
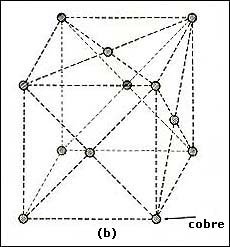
Otro ejemplo es la estructura del cobre, mostrada en la figura 20(b). Esta
estructura es una red que recibe el nombre de cúbica centrada en las caras.
Los átomos de cobre se encuentran colocados en los vértices de un cubo así como
en el centro de cada una de las caras que forman el cubo. La longitud del cubo
es de 3.61 Å. Este arreglo se repite con la misma orientación a
lo largo de todo el cristal. La estructura cúbica centrada en las caras es característica
de muchos metales como el níquel (3.52 Å), aluminio (4.04 Å),
oro (4.07 Å), plomo (4.94 Å) y platino (3.92 Å),
por ejemplo.
Existe otro tipo de estructura, la llamada cúbica centrada en el cuerpo (Figura
20(c)) que tiene el cristal de cloruro de cesio CsCl. En cada vértice
del cubo se encuentra un átomo de cesio, mientras que en el centro del cubo
está un átomo de cloro. La longitud del lado del cubo es de 4.11 Å.
El cloruro de rubidio RbCl es otro compuesto que tiene esta estructura,
con una longitud de la arista del cubo igual a 3.74 Å.
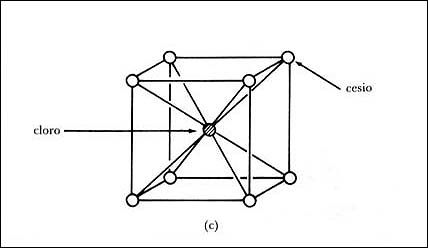
Figura 20 (c). Cloruro de cesio, cúbica centrada en el cuerpo.
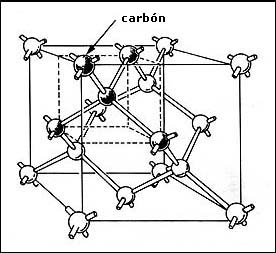
El diamante es una sustancia que también tiene estructura cristalina, sin embargo,
ésta resulta ser más complicada que las anteriores. El diamante está formado
de átomos de carbón. La diferencia entre el diamante y otras formas de carbón
que conocemos radica en la disposición de sus átomos. En el diamante cada átomo
de carbón está enlazado con otros átomos, en forma de tetraedro (cuatro caras).
La estructura del diamante se forma de dos estructuras cúbicas centradas en
las caras, estando una de éstas desplazada, con respecto a la otra, a lo largo
de la diagonal del cubo en una distancia igual a la cuarta parte de su longitud.
En la figura 21 se muestra la estructura del diamante; se ven también los enlaces
que forman un tetraedro. La longitud del lado del cubo del diamante es de 3.56
Å. Es justamente a causa del enlace en forma de tetraedro que se
suelen encontrar los diamantes en formas octaédricas (ocho caras), resultado
de la colocación de dos tetraedros tocando sus bases. Combinando de diversas
maneras las posiciones de varios tetraedros también se encuentran formas de
diamante dodecaédricas (doce caras), con 24 y 48 caras.
El diamante es la sustancia más dura que existe. Esto se debe a que la unión entre los átomos de carbón es muy intensa. Sin embargo, dicha dureza varía de manera muy significativa a lo largo de distintas direcciones. Las direcciones en las cuales es más sencillo pulir el diamante son las de las caras cristalinas. El diamante se puede partir perfectamente en cuatro direcciones, paralelas a las caras del octaedro. Los técnicos que trabajan estas joyas utilizan esta característica para dividir piedras grandes en varias porciones más pequeñas.
El carbón también cristaliza en otra forma, dando lugar al grafito. La estructura cristalina del grafito consiste en anillos hexagonales que se encuentran en diferentes planos paralelos, que están unidos entre sí. Resulta que la unión entre átomos de carbón que están en un plano es muchísimo más intensa que la unión entre átomos de carbón que están en planos adyacentes. A diferencia de lo que ocurre en el diamante, en donde cada átomo de carbón está unido fuertemente a otros cuatro átomos de carbón formando un tetraedro, dándole a la sustancia la dureza en tres dimensiones, en el grafito, un átomo de carbón está unido fuertemente sólo con otros tres átomos de carbón en un plano, mientras que la unión con el cuarto átomo de carbón es muy débil y ocurre perpendicularmente al plano. En consecuencia, hay una unión muy intensa en dos dimensiones, a lo largo de la superficie del plano. Es por este motivo que el grafito se divide a lo largo de planos formando láminas delgadas y es relativamente fácil separar los planos.
A pesar de que tanto el diamante como el grafito son ambos sustancias formadas con los mismos átomos de carbón, tienen propiedades muy distintas debido a la estructura cristalina que adquieren. Además del precio, el diamante se distingue del grafito en lo siguiente: el diamante es transparente, mientras que el grafito es negrogrisáceo; el diamante es muy duro, mientras que el grafito es blando; el diamante es mal conductor de electricidad, mientras que el grafito es buen conductor, etcétera.
De las dos estructuras que mencionamos para el carbón, la que corresponde al grafito es la más estable en las condiciones ordinarias de temperatura y presión en las que vivimos. Para formar la estructura del diamante se requiere de muy altas presiones, que se han logrado en el transcurso de las eras geológicas en las profundidades de la Tierra. En principio, la estructura del diamante no es estable y debería transformarse en la estructura estable, es decir, en grafito (¡uuy!, ¿qué le va a pasar a mis joyas?); sin embargo, una vez formado el diamante, su estructura persiste, en la práctica, indefinidamente (¡uuf, qué suerte!) ya que en las condiciones de temperatura y presión en que nos encontramos la transformación de la estructura inestable a la estable ocurre de manera extraordinariamente lenta.
Otros elementos también cristalizan en una estructura igual a la del diamante, como por ejemplo el germanio (5.65 Å) y el silicio (5.43 Å).
La cristalización en forma laminar, como la que ocurre en el grafito, también se da en otras sustancias que reciben el nombre genérico de micas. Las micas tienen composiciones químicas muy variables, por ejemplo, aluminosilicatos con potasio, magnesio, hierro o litio, así como con flúor. Consecuentemente sus propiedades físicas son diversas. Sin embargo, su estructura cristalina es análoga a la del grafito.
Con las técnicas de difracción de rayos X se han revelado imperfecciones de las estructuras cristalinas. Estas imperfecciones se detectaron al comparar el patrón de difracción de estas sustancias con el patrón de difracción de estructuras perfectas y darse cuenta de que hay pequeñas variaciones.
Otra aplicación que se ha hecho de los rayos X es la determinación de la estructura de moléculas. Las distancia entre los átomos que forman una molécula resulta ser también del orden de angstroms, es decir, del orden de longitud de onda de los rayos X. Por lo tanto, un conjunto de moléculas también sirve como rejilla de difracción al hacer incidir sobre ellas radiación X. Aplicando las mismas ideas que para la determinación de estructuras cristalinas se han determinado estructuras moleculares de compuestos químicos, algunos de ellos muy complejos, como por ejemplo la penicilina, una vez conocida su estructura se pudo efectuar su síntesis. Otro caso fue la determinación de la estructura de la aspirina.
El conocimiento de estructuras moleculares biológicas ha contribuido a desarrollar
la biología moderna. El paso inicial fue la celebrada determinación de la estructura
del ácido desoxirribonucleico (ADN) (Figura 22(a)), hecha por
medio de difracción de rayos X por el físico Francis Crick
y el biólogo James Watson en Cambridge, Inglaterra, en 1953. Con ello descubrieron
la estructura del material genético de los seres vivos. Por este trabajo recibieron
el premio Nobel de Medicina en 1956. El ADN existe dentro de
cada cromosoma de cada célula de cada organismo vivo, desde la más sencilla
amiba hasta el hombre. Crick y Watson descubrieron que el ADN
está formado por una hélice doble, como escalera en espiral, compuesta de azúcares
y fosfatos en sus dos lados; además, los "escalones" están hechos de parejas
de moléculas: adenina y timina, guanina y citosina. Cada una de las moléculas
de la pareja está unida a una espiral. El orden en que se encuentran estas parejas
a lo largo de la hélice determina el mensaje genético y es el que controla el
desarrollo posterior del individuo: que sea un pino o una rosa, que el pelo
sea rizado o los ojos azules, etcétera. Cada molécula de ADN
está constituida por segmentos codificados o genes, que llevan instrucciones
hereditarias para producir las proteínas que gobiernan todos los procesos vivos.
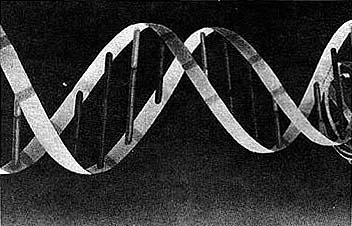
Figura 22(a). Estructura helicoidal del ácido desoxirribonucleico
(ADN) donde se encuentra contenida la información genética de los seres vivos.
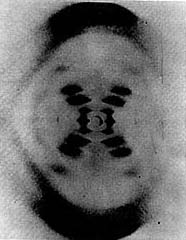
En la figura 22(b) vemos una fotografía del patrón de difracción del ADN.
Se puede ver claramente en este patrón la X que se forma y
que es característica de estructuras helicoidales.
Podemos ahora apreciar la gran capacidad que tiene el método de difracción de rayos X para proporcionar información sobre diversas características de estructuras microscópicas.